芍药苷调控JAK/STAT3通路干预HepG2细胞PD-L1表达的研究
2019-05-23万南燕蒋翠花殷志琦
万南燕,蒋翠花,高 萌,张 健,殷志琦,潘 珂
(1中国药科大学中药学院天然药物化学系,南京 210009;2江苏省中医药研究院转化医学实验室,南京 210028;3南京中医药大学附属中西医结合医院 南京 210028;4中国药科大学中药学院中药制药系&天然药物活性组分与药效国家重点实验室,南京 210009)
肝癌(hepatocellular carcinoma,HCC)是世界上最常见和最具侵袭性的肿瘤之一[1-2]。尽管多激酶抑制剂在分子治疗方面取得了进展,但晚期HCC的预后仍然很差,5年生存率为3%~11%[3]。免疫逃逸是肿瘤发展的重要因素,程序性死亡配体1(PD-L1)的过度表达参与肿瘤的免疫逃逸,与肿瘤的发生、发展及预后不良密切相关[2,4]。PD-L1是PD-1的配体,在肿瘤细胞和免疫细胞上均表达,而PD-1主要在活化的T细胞上表达。PD-L1与PD-1的结合通过诱导T细胞的衰竭和凋亡来抑制T细胞效应功能,导致免疫抑制状态[5]。研究表明PD-L1/PD-1信号通路在T细胞介导的肿瘤免疫应答中发挥重要作用,且针对PD-1/PD-L1的治疗性阻断已经证实可以使部分肿瘤患者具有持久的抗肿瘤反应[6-7]。目前HCC的免疫治疗试验已发现组织学证实的肿瘤自发性消退,但患者反应率相对较低,并且基于抗体检查点抑制剂的不良反应和高成本限制了其应用[8-9]。近年来,小分子抑制剂的研究逐步兴起,天然小分子对PD-L1调控的研究也取得了一定进展,挖掘潜在干扰PD-1/PD-L1表达的天然小分子可能是肿瘤治疗的新领域[10-11]。
芍药苷(paeoniflorin)是一种单萜葡萄糖苷,作为天然植物药被广泛使用。芍药苷具有抗炎、镇痛、免疫调节、肝脏和神经保护、认知障碍改善和抗高血糖效应等药理作用[12-13]。近年来临床前研究表明芍药苷对非小细胞肺癌、胃癌、肝癌和白血病等发挥抗肿瘤活性[14-15],可通过调控PI3K/AK、JAK/STAT3、NF-κB等多种通路调节机体免疫功能,抑制肿瘤生长[16-17]。因此,推测芍药苷可能通过JAK/STAT3通路调节PD-L1,参与肿瘤患者的免疫调控系统,增强抗肿瘤免疫应答。因此,本研究拟通过IFN-γ诱导的HepG2细胞模型探究芍药苷对PD-L1的调节作用及其作用机制。
1 材 料
1.1 药品与试剂
芍药苷(HPLC面积归一化法测定纯度大于99%,四川维克奇生物科技有限公司);胎牛血清(美国Hyclone公司);DMEM、胰蛋白酶、噻唑兰MTT(江苏凯基生物技术股份有限公司);牛血清白蛋白(BSA)、IFN-γ(美国R&D公司);PD-L1 ELISA检测试剂盒(美国Protintech公司)、IL-2 ELISA检测试剂盒(美国Novus公司);PHA、PMA、Ruxolitinib(美国Sigma公司);BCA蛋白定量试剂盒(南京建成生物工程研究所);二甲基亚砜DMSO、RIPA裂解液、PMSF、Anti-PD-L1抗体(美国Cell Signaling Technology公司);Trizol(美国Life Technologies公司),引物、DEPC水(上海捷瑞生物工程有限公司);SYBR Green Real-time PCR Master Mix、ReverTra Ace qPCR RT Master Mix with gDNA Remover[东洋纺(上海)生物科技有限公司];其他试剂均为国产分析纯。
1.2 仪 器
全波长多功能酶标仪(美国赛默飞世尔科技有限公司);超速控温离心机(美国Beckman Coulter公司);荧光倒置显微镜(德国Carl Zeiss公司);A101439电泳仪、QuantStudioTMDx Real-Time PCR循环仪(美国Bio-Rad公司)。
1.3 细胞株
人肝癌细胞株HepG2购自上海ATCC细胞库。HepG2细胞用含10% FBS的高糖DMEM培养液,在37 ℃、体积分数5% CO2的饱和湿度条件下培养,每隔3天用0.25%胰蛋白酶消化细胞,按1∶3比例进行传代,取对数期的细胞用于实验[18]。
2 方 法
2.1 PD-L1高表达模型建立和药物溶解
IFN-γ 100 μg用去离子水500 μL溶解为0.2 mg/mL母液,然后用PBS稀释为400 ng/mL储备液,0.22 μm滤膜过滤待用。
取一定量的芍药苷,先用DMSO溶解至一定浓度,使DMSO浓度不超过药物最终使用浓度的0.1%,然后用DMEM稀释至相应浓度。
2.1.1 ELISA检测IFN-γ对HepG2细胞PD-L1表达的影响 取对数生长期HepG2细胞,以每孔1×106个细胞接种于6孔板中,细胞贴壁后分别给予含有10、20、30 ng/mL IFN-γ的DMEM培养基,培养24 h后,裂解细胞后收集上清液,用ELISA试剂盒测定上清液中PD-L1的含量。同时抽提各孔细胞总蛋白,采用BCA定量试剂盒检测蛋白浓度,以较正PD-L1浓度。
2.1.2 Real-time PCR检测IFN-γ对HepG2细胞PD-L1表达的影响 HepG2细胞按照“2.1.1”项下方法处理后,PBS清洗细胞2次,用Trizol试剂提取细胞RNA,酶标仪测定A260/280及其浓度。RNA在65 ℃条件下热变性5 min后,立即置于冰上,按照反转录试剂盒说明配制体系,使RNA反转录为cDNA,反应参数分别为:37 ℃,15 min;50 ℃,5 min;98 ℃,5 min。按照PCR试剂盒配制反应体系后进行反应,反应参数为95 ℃,15 s;60 ℃,15 s;72 ℃,45 s。其中,95 ℃预变性60 s;共循环40次[19]。测得基因引物序列见表1。
2.1.3 流式细胞术检测IFN-γ对HepG2细胞PD-L1表达的影响 HepG2细胞按照“2.1.1”项下方法处理后,用预冷的PBS清洗细胞两次,之后用胰酶消化收集离心后弃去上清液,细胞用0.1% BSA稀释的一抗稀释液(兔抗,1∶400) 100 μL重新悬浮,孵育1 h后,离心去上清液,用预冷PBS清洗两遍后,加入用0.1% BSA稀释的二抗稀释液(抗兔,1∶8 000) 100 μL重新悬浮,孵育40 min后,离心去上清液,用预冷PBS清洗两遍,加入PBS 50 μL重新悬浮后,用流式细胞术检测PD-L1蛋白的表达。
2.2 MTT法检测芍药苷对HepG2细胞的活性的影响
取生长状态良好的HepG2细胞,消化后以每孔1×104个细胞的密度接种于96孔板中,待细胞贴壁后吸去培养基,加入不含血清的DMEM饥饿8 h后,分别给予1,5,10,20,40 μmol/L的芍药苷,空白组加入不含血清的DMEM,孵育24 h后吸去培养基,每孔加入含5 mg/mL MTT的空白培养基100 μL,孵育4 h,吸去上清液,每孔加入DMSO 150 μL,酶标仪测定490 nm处的吸收度,计算细胞活力,实验平行3次。
2.3 检测芍药苷对HepG2细胞PD-L1表达的影响
2.3.1 ELISA检测芍药苷对HepG2细胞PD-L1表达的影响 取对数生长期HepG2细胞,以每孔1×106个细胞接种于6孔板中,分别设置空白组(Control)、模型组(Model)和芍药苷给药组(20 μmol/L)。空白组每孔加入空白DMEM培养基,模型组每孔加入30 ng/mL IFN-γ的DMEM培养基,给药组每孔分别加入30 ng/mL IFN-γ和20 μmol/L 芍药苷的DMEM培养基,孵育24 h后,裂解细胞后收集上清液,用ELISA试剂盒测定上清液中PD-L1的含量。同时抽提各孔细胞总蛋白,采用BCA定量试剂盒检测蛋白浓度,以较正PD-L1浓度。
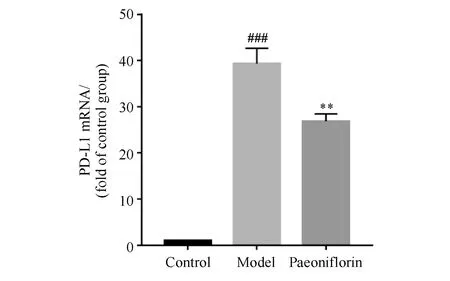
2.3.2 Real-time PCR检测芍药苷对HepG2细胞PD-L1表达的影响 HepG2细胞按照“2.3.1”项下方法处理后,PBS清洗细胞2次,用Trizol试剂提取细胞RNA,酶标仪测定A260/280及其浓度。RNA在65 ℃条件下热变性5 min后,立即置于冰上,按照反转录试剂盒说明配制体系,使RNA反转录为cDNA,反应参数分别为:37 ℃,15 min;50 ℃,5 min;98 ℃,5 min。按照PCR试剂盒配置反应体系后进行反应,反应参数为95 ℃,15 s;60 ℃,15 s;72 ℃,45 s。其中,95 ℃预变性60 s;共循环40次。测得基因引物序列见表1。
Table1 Primer sequence for real-time PCR assay

GenePrimer sequencePD-L1Forward 5'-GGTGCCGACTACAAGCGAAT-3'Reverse 5'-AGCCCTCAGCCTGACATGTC-3'GAPDHForward 5'-ACAACTTTGGTATCGTGGAAGG-3'Reverse 5'-GCCATCACGCCACAGTTTC-3'
2.3.3 流式细胞术检测芍药苷对HepG2细胞PD-L1表达的影响 HepG2细胞按照“2.3.1”项下方法处理后,用预冷的PBS清洗细胞2次,之后用胰酶消化收集离心后弃去上清液,细胞用0.1% BSA稀释的一抗(1∶400) 100 μL重新悬浮,孵育1 h后,离心去上清液,用预冷PBS清洗两遍后,加入用0.1% BSA稀释的二抗(1∶800) 100 μL重新悬浮,孵育40 min后,离心去上清液,用预冷PBS清洗两遍,加入PBS 50 μL重新悬浮后,用流式细胞仪检测PD-L1蛋白的表达。
2.4 T细胞和HepG2细胞共培养
取对数生长期HepG2细胞,以每孔1×105个接种于12孔板中,分别设置空白组(Control)、模型组(Model)和芍药苷给药组(20 μmol/L)。给药后1 h加IFN-γ,孵育24 h 后,用PBS清洗两遍后,Jurkat细胞按照每孔8×105个细胞加入孔中,加入10 μg/mL PHA+10 ng/mL PMA孵育24 h后,收集上清液和Jurkat细胞,1 000 r/min离心5 min,分别检测Jurkat细胞活性和上清液中IL-2的浓度。
2.5 Western blot分析
取对数生长期HepG2细胞,以每孔1×106个接种于6孔板中,分别设置空白组(Control)、模型组(Model)、芍药苷给药组(20 μmol/L)和抑制剂组。空白组每孔加入空白DMEM培养基,模型组每孔加入30 ng/mL IFN-γ的DMEM培养基,给药组每孔分别加入30 ng/mL IFN-γ和20 μmol/L芍药苷的DMEM培养基,孵育24 h后,PBS清洗细胞两次,用细胞刮刮取细胞,收集后300 r/min离心5 min,分别加蛋白裂解液60 μL在冰上裂解30 min,吹打细胞数次,收集裂解液,12 000 r/min离心15 min,收集上清液,用BCA试剂盒测定总蛋白浓度。将蛋白质样品稀释至相同且合适的浓度进行SDS-PAGE电泳(电泳参数:85 V、20 min;120 V、80 min),然后转移至PVDF膜上在5%脱脂奶粉封闭液中室温封闭1 h,加入一抗(1∶1 000)于4 ℃过夜,后加入二抗(1∶2 000)室温孵育2 h,采用电化学发光检测法(ECL法)显色。对感光胶片条带进行灰度分析,以目的条带与内参照条带GAPDH的比值代表目的蛋白的相对表达量。
2.6 数据分析
3 结 果
3.1 HepG2细胞PD-L1高表达模型的建立
IFN-γ刺激HepG2细胞24 h后,ELISA检测结果显示:30 ng/mL IFN-γ对于PD-L1的上调作用最为明显(图1),PCR检测结果证明IFN-γ对于PD-L1 mRNA的上调呈现剂量依耐性(图2),流式细胞术检测结果也进一步证明了这个结论(图3)。
3.2 芍药苷对HepG2细胞活力的影响
通过MTT检测不同浓度的芍药苷对HepG2细胞存活率的影响。如图4显示,与正常对照组相比,1、5、10、20 μmol/L的芍药苷处理后的细胞活力明显大于90%,无明显细胞毒性,故选择20 μmol/L芍药苷作为药物安全浓度开展后续实验。
3.3 芍药苷对HepG2细胞PD-L1表达的影响
如图5所示,与正常对照组相比,模型组细胞PD-L1的表达水平显著增加。加入芍药苷后,PD-L1的表达受到抑制。ELISA检测PD-L1与流式细胞术检测结果一致(图6),30 ng/mL IFN-γ处理的细胞PD-L1的蛋白和mRNA表达水平显著增加。与模型组相比,给予20 μmol/L的芍药苷24 h后,给药组HepG2细胞的PD-L1蛋白和mRNA的表达水平显著降低(图7)。


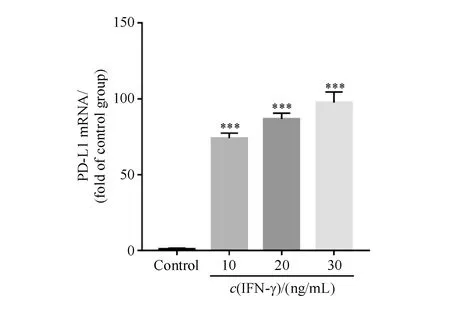

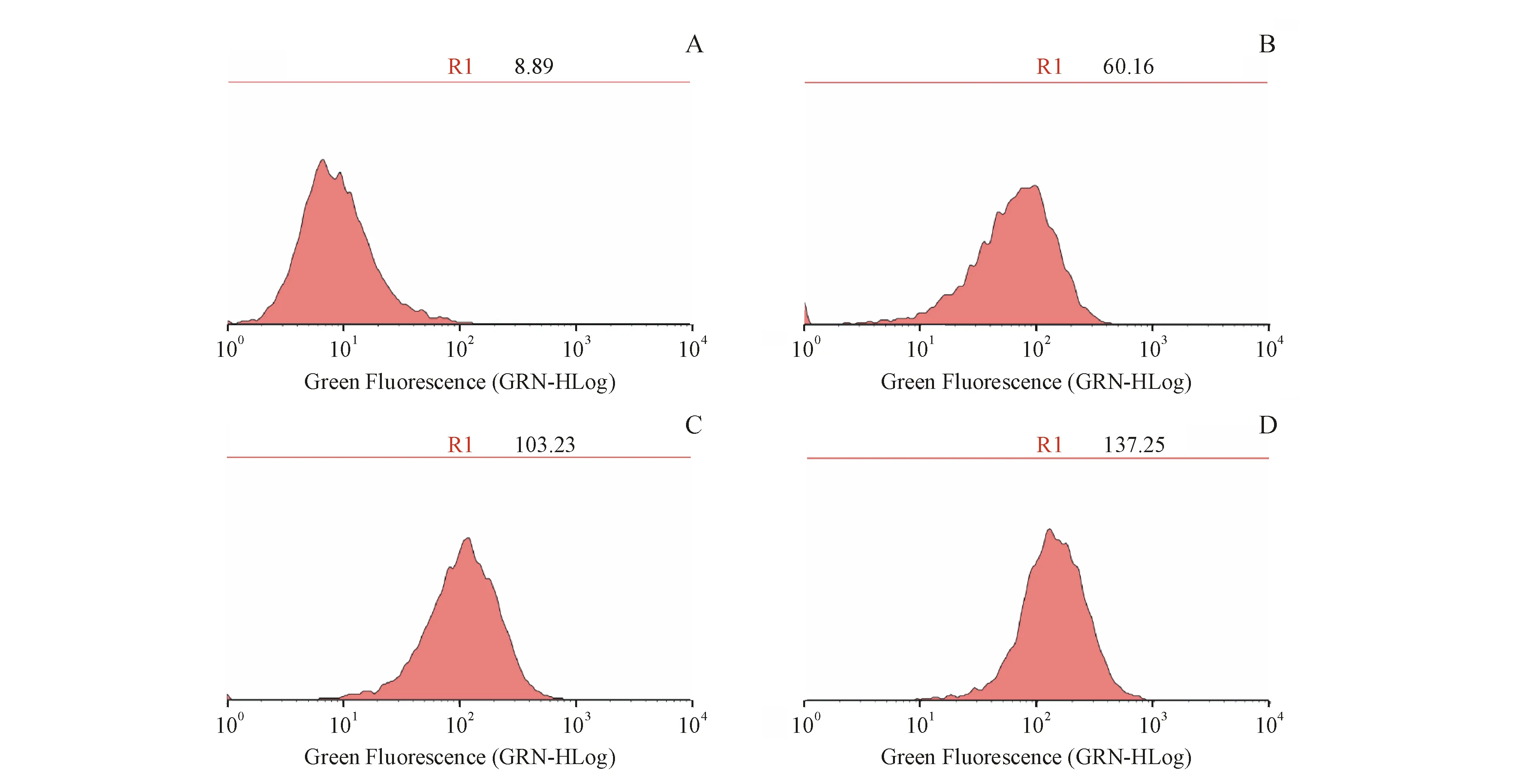
Figure3 Effect of IFN-γ on PD-L1 protein expression of HepG2 cells.HepG2 cells were treated with different concentration of IFN-γ for 24 h,and then PD-L1 was measured by flow cytometry
A:Control group;B:HepG2 cell treated with 10 ng/mL IFN-γ;C:HepG2 cell treated with 20 ng/mL IFN-γ;D:HepG2 cell treated with 30 ng/mL IFN-γ


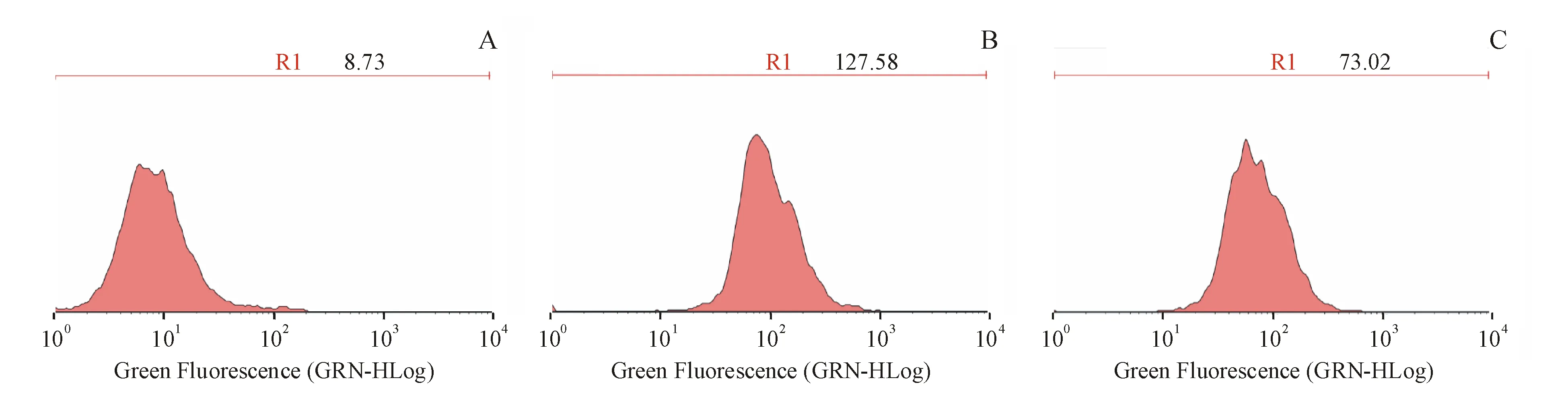
Figure5 Effect of IFN-γ on PD-L1 protein expression of HepG2 cells.HepG2 cells were treated with different concentration of IFN-γ for 24 h,and then PD-L1 was measured by flow cytometry
A:Control group;B:HepG2 cell treated with 30 ng/mL IFN-γ;C:HepG2 cell treated with 20 μmol/L paeoniflorin in the absence or presence of 30 ng/mL IFN-γ for 24 h



3.4 芍药苷对共培养体系中T细胞IL-2分泌的影响
为了检测芍药苷是否能够逆转PD-L1高表达的HepG2细胞对表达PD-1细胞的T细胞的抑制作用,将IFN-γ刺激的PD-L1高表达的HepG2细胞用芍药苷20 μmol/L处理24 h后,与激活的Jurkat T细胞共孵育,24 h后分别收集上清和Jurkat T细胞,检测IL-2的分泌水平和T细胞的增殖情况。如图8和9所示,模型组较空白组,HepG2高表达PD-L1,显著抑制T细胞的增殖活性,IL-2的分泌也受到抑制。加药组与模型组相比,芍药苷显著逆转了高表达PD-L1的HepG2细胞对高表达PD-1的T细胞的细胞增殖抑制作用,T细胞增殖活性显著增强,IL-2的分泌水平也显著提高。




3.5 芍药苷对HepG2细胞中PD-L1、JAK和STAT3磷酸化水平的影响
与正常组相比,IFN-γ刺激下的模型组的PD-L1、JAK和STAT3的表达水平均显著上升。芍药苷干预后,PD-L1的表达显著降低,与抑制剂作用结果类似。JAK、STAT3的磷酸化水平在芍药苷作用后均有所降低(图10)。
4 讨 论
肿瘤免疫逃逸是肿瘤发生发展的重要原因之一,PD-L1表达上调是肿瘤细胞的常见免疫逃避策略[20],并预示着肿瘤治疗的预后不良。本研究采用IFN-γ刺激HepG2细胞24 h,成功建立PD-L1高表达模型,评价天然小分子芍药苷对PD-L1的调控作用。实验结果证实芍药苷能够显著降低PD-L1的表达,降低JAK、STAT3的磷酸化水平,提示芍药苷可能通过JAK/STAT3通路抑制PD-L1的表达,从而改善肿瘤免疫逃逸。


目前,靶向免疫检查点PD-1/PD-L1和CTLA-4的抗体治疗晚期肝细胞癌的临床试验正在进行中,PD-1/PD-L1抗体nivolumab在晚期HCC中的Ⅰ/Ⅱ期试验中显示出有利的结果,目前正在进行两项Ⅲ期研究比较PD-1/PD-L1抗体和激酶抑制剂索拉非尼在HCC患者一二线治疗疗效,临床前研究数据明确了免疫检查点抑制剂在肿瘤治疗中的发展前景[23],结果表明,抗PD-1抗体与局部治疗或其他靶向分子相结合药物是HCC的有效治疗策略。因此,免疫检查点抑制剂可以为HCC的治疗打开新的大门。但PD-1/PD-L1检查点抑制剂的高昂价格和所引起的严重免疫相关副反应限制了其在HCC中的应用。研究发现,天然小分子化合物如芹菜素、人参皂苷Rg3、雷公藤甲素、青藤碱等均能抑制PD-L1的表达,显示了天然小分子下调PD-L1表达的潜力。
已有研究表明,实体瘤可通过上调肿瘤微环境中的IFN-γ诱导PD-L1表达,从而抑制抗肿瘤免疫应答[5,24]。例如,肝细胞瘤细胞系(HepG2,Hep3B和PLC)暴露于IFN-γ或IFN-α后PD-L1的表达显著增加[25]。本研究发现采用IFN-γ刺激HepG2细胞,PD-L1蛋白和mRNA表达显著增加,说明模型成立。文献报道PD-1/PD-L1相互作用,引起T细胞凋亡和耗竭,抑制T细胞分泌IL-2,从而减弱T细胞对肿瘤细胞的抑制作用,促进肿瘤的发生发展[26]。本研究结果显示,HepG2细胞经IFN-γ刺激后高表达PD-L1,与活化的Jurkat细胞表达的PD-1结合,Jurkat细胞活性显著下降,其分泌的IL-2较空白组相比显著降低。加入芍药苷干预后,T细胞增殖显著增强,IL-2的分泌水平较模型组也显著增加。由此说明芍药苷能够通过抑制PD-L1的表达,从而逆转PD-L1与PD-1结合后对T细胞活性的抑制作用。
JAK/STAT3信号通路对免疫反应、细胞生长和分化等都发挥着至关重要的作用。细胞因子和生长因子与激活非受体酪氨酸激酶JAK的膜受体结合,STAT转录因子被活化的JAK磷酸化并二聚化,后入核与相应DNA片段结合,调控基因转录[27]。STAT3作为肿瘤发生过程中的癌蛋白已被广泛研究,其信号转导通路的不断激活与肿瘤的发生发展密切相关[28-29]。JAK/STAT3通路在多种癌症中被证明与PD-L1的表达调控密切相关,STAT3能结合到PD-L1启动子区域从而调控PD-L1的表达[30]。文献研究证实芍药苷可通过调控STAT3表达抑制人胶质瘤细胞、胃癌细胞等肿瘤细胞增殖[16-17]。本研究发现芍药苷能显著降低IFN-γ诱导的HepG2细胞的PD-L1的高表达,降低细胞内JAK、STAT3的磷酸化水平,进一步提示芍药苷具有通过抑制JAK/STAT3信号通路达到抑制PD-L1表达的作用。
综上所述,芍药苷可能通过JAK/STAT3通路抑制PD-L1表达,从而发挥改善肿瘤免疫逃逸的作用,但仍需体内实验进一步验证。
