热休克蛋白内质网亚型Grp94特异性荧光探针的设计、合成与应用
2019-05-23郭安平徐晓莉尤启冬李玉艳
郭安平,姜 奋,徐晓莉,尤启冬,李玉艳*
(中国药科大学1江苏省药物分子设计与成药性优化重点实验室;2药物化学系,南京 210009)
热休克蛋白家族(human heat shock proteins,Hsp)是控制蛋白折叠与装配的最为重要的家族之一。Hsp90是热休克蛋白家族中最重要的蛋白分子,在非应激条件下其表达量占据细胞蛋白总量的1%~2%,控制着细胞中5%~10%蛋白的折叠和活化。Hsp90有4个亚型,分别是细胞质中的Hsp90α和Hsp90β、内质网中的Grp94及线粒体中的Trap-1[1]。每一种亚型都调控着不同种类的客户蛋白。葡萄糖调节蛋白94(glucose-regulated protein 94,Grp94)是Hsp90家族在内质网中的亚型。与Hsp90类似,Grp94主要功能是调节其客户蛋白成熟和分泌的过程,保证客户蛋白能够形成生理功能所需的正常构象[2]。Grp94所负责的客户蛋白种类与细胞质中的Hsp90α/β相比较少,主要包括Toll样受体(TLRs)、整合素(integrins)、胰岛素样生长因子(IGF-1、IGF-2)、Wnt通路受体(LRP6)、表皮生长因子受体2(HER2)等[3-8]。这些客户蛋白在肿瘤的发生发展以及炎症反应中起到重要作用。临床上,Grp94高表达与包括肝癌、胃癌、非小细胞肺癌以及多发性骨髓瘤在内的多种肿瘤患者的不良预后密切相关[9-10]。选择性抑制Grp94影响的客户蛋白较少,与泛Hsp90抑制相比可能会有更好的安全性;此外,抑制Grp94不会诱导热休克反应,可以解决泛Hsp90抑制引起的热休克反应问题[11]。鉴于Grp94客户蛋白在肿瘤、炎症等疾病中的重要作用,选择抑制Grp94的功能可以从多条通路上阻断肿瘤、炎症等疾病的发生发展,同时产生较好的治疗效果,因而Grp94目前已成为备受关注的分子靶点之一。目前已有多种Grp94选择性抑制剂报道,其结构和活性如图1所示。
荧光偏振实验(fluorescence polarization,FP)[12]是目前广泛用于测试Hsp90抑制剂活性的方法之一,其主要具有以下3个优点:(1)该测试方法不需要分离游离和结合的配体,可重复性高,并且易于自动化检测;(2)Hsp90是一种结构高度灵活的分子伴侣蛋白,其功能对标签的附着可能导致的构象变化的干扰非常敏感,而FP实验是一种不需要对蛋白质进行工程改造的分析方法,是测试这类敏感蛋白质功能的优选方法;(3)该方法需要一个带有荧光标签并且能够与Hsp90发生紧密结合的探针分子,多种结构类型的Hsp90抑制剂与Hsp90结合的共晶结构已被报道,为探针分子荧光基团的引入位置提供了指导。荧光偏振实验测试方法同样适用于测试Hsp90内质网亚型Grp94抑制剂的活性。由于Hsp90和Grp94蛋白结构仍然存在着一定的差异,而现在广泛使用的荧光探针是以格尔德霉素(geldanamycin,GA)为基础开发的探针分子GA-FITC,由于格尔德霉素对Hsp90 4种亚型具有相近的亲和力,并不完全适合用于Hsp90亚型抑制剂的活性评价方法中。因此,亟需开发能够用于内质网亚型Grp94的特异性荧光探针,以供利用荧光偏振的方法进行Grp94抑制剂活性表征。
本课题组最近发现并报道了苯甲酰胺类Grp94抑制剂DDO-5813(图2),该化合物可以特异性的诱导Grp94蛋白的lid区发生重排,并占据新形成的疏水口袋site 2,利用荧光偏振实验检测该类化合物对热休克蛋白亚型具有选择性,Grp94(IC50=2 nmol/L);Hsp90α(IC50>100 μmol/L)[13]。通过Discovery Studio(DS)4.0软件进行对接研究,发现DDO-5813结构中反式4-氨基环己醇的羟基指向蛋白溶剂区(图2),在该位点引入荧光基团可能对活性的影响较小。基于此,用哌啶环替代环己醇片段,并在哌啶环氮上通过长链引入荧光基团5-羧基荧光素(5-FAM),设计合成得到了荧光探针Grp94-probe。
1 Grp94-probe的合成路线
本研究以3-氰基-4-氟苯硼酸频哪醇酯(1)为原料,与1-溴-4-异丙苯通过Suzuki-Miyaura偶联反应得到化合物2,与1-叔丁氧羰基-4-氨基哌啶进行氨解反应,然后水解氰基得到化合物3,通过脱Boc保护基得到化合物4,经过缩合反应、脱Boc保护基反应得到化合物5,与荧光原料5-FAM缩合得到Grp94-probe。具体合成路线见图3。

Figure1 Structures and activity profiles of the reported Grp94-selective inhibitors
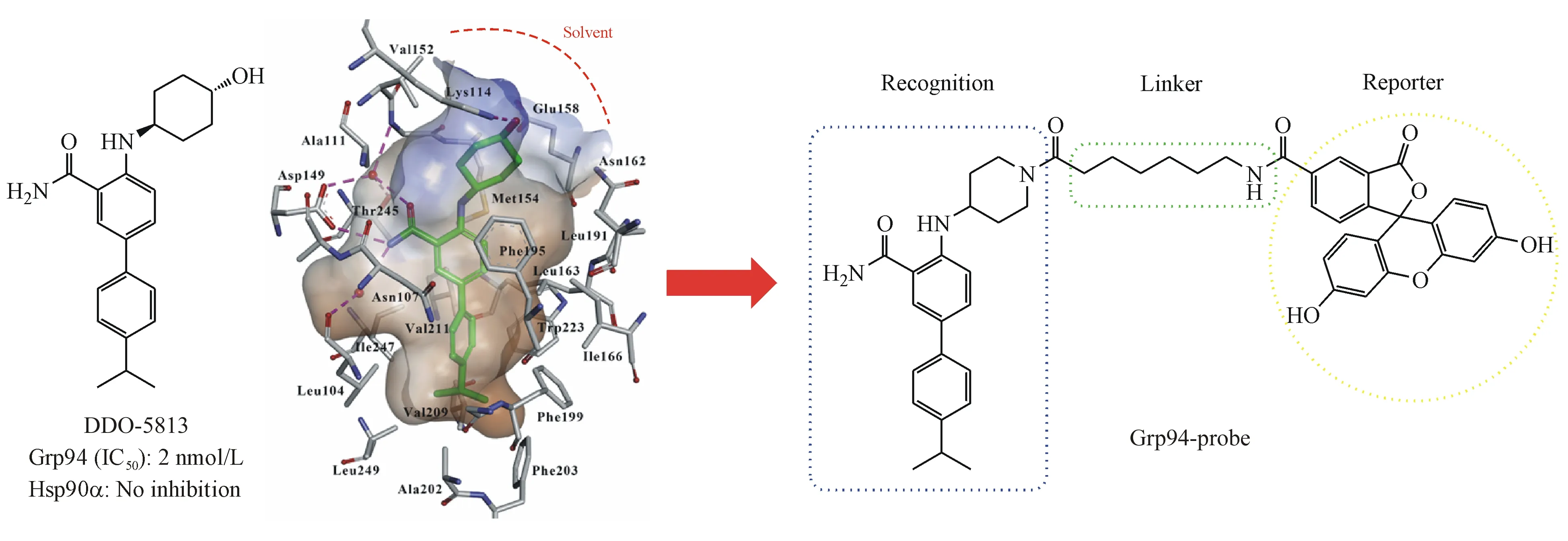
Figure2 Predicted binding mode of compound DDO-5813 with Grp94,and the design of Grp94-probe

Figure3 Synthetic route for Grp94-probe
Reagents and conditions:(a) 1-Bromo-4-isopropylbenzene,Pd(PPh3)4,Cs2CO3,dioxane,90 °C,overnight;(b) 4-Amino-1-Boc-piperidine,DIPEA,120 °C,24 h;(c) EtOH,DMSO,2 mol/L NaOH,30% H2O2,30 °C,6 h;(d) TFA,DCM,r.t.,24 h;(e) Boc-7-aminoheptanoic acid,BOP,DIPEA,DMF,r.t.,5 h;(f) TFA,DCM,r.t.,24 h;(g) 5-FAM,BOP,DIPEA,DMF,r.t.,4 h
2 实验部分
2.1 材 料
核磁共振波谱由德国Bruker公司Avance 300 MHz核磁共振仪测定,DMSO-d6为溶剂,TMS作为内标;质谱由GC-MS 2010型质谱仪(EI-MS)(日本岛津公司)、1946AMSD型质谱仪(ESI-MS)(美国安捷伦公司)、Q-Tof型质谱仪(HRMS)(美国Weters公司)测定;柱色谱用100~200目硅胶(青岛海浪硅胶干燥剂厂);薄层色谱采用GF254薄层色谱硅胶(烟台江友硅胶开发有限公司);紫外吸收用ZF7型三用紫外分析仪(上海科兴仪器有限公司)检测;5-羧基荧光素(250 mg)购自中国Adamas公司,其他合成所用原料也均来源于市售分析纯试剂;实验所用MCF-7细胞株购自中国科学院细胞库。
2.2 化学合成
3-氰基-4-氟-4′-异丙基-1,1′-联苯(2) 将3-氰基-4-氟苯硼酸频哪醇酯(1,1 g,4 mmol)与1-溴-4-异丙苯(1.19 g,6 mmol)溶于1,4-二氧六环(10 mL)中,加入Pd(PPh3)4(464 mg,0.4 mmol)和Cs2CO3(2.6 g,8.0 mmol),氮气保护下90 ℃过夜反应。将反应液通过硅藻土过滤,减压蒸馏除去溶剂。正相柱色谱法用石油醚纯化,得化合物2,淡黄色油状液体(796 mg,83.2%);1H NMR(300 MHz,DMSO-d6)δ:8.19(1H,dd,J=6.2,2.5 Hz,Ar-H),8.07~8.02(1H,m,Ar-H),7.64~7.55(3H,m,Ar-H),7.34(2H,d,J=8.2 Hz,Ar-H),2.98~2.86(1H,m,-ArCH),1.23(6H,d,J=6.9 Hz,2×-CH3)。
4-(1-叔丁氧羰基哌啶-4-基)氨基-4′-异丙基-1,1′-联苯-3-甲酰胺(3) 将化合物2溶于二甲基亚砜(10 mL)中,加入1-叔丁氧羰基-4-氨基哌啶(3 g,15 mmol)和N,N-二异丙基乙基胺(5.3 mL,30 mmol),120 ℃ 回流反应24 h。完全反应后,将反应液倒入水(50 mL)中并用乙酸乙酯(50 mL×2)萃取。合并乙酸乙酯层,无水硫酸钠干燥。减压蒸馏浓缩,将残余物溶于乙醇(30 mL)和二甲基亚砜(1 mL)的混合溶剂中,加入氢氧化钠溶液(6 mL,2 mol/L)和30%H2O2(3 mL),30 ℃ 下反应6 h。减压蒸馏除去乙醇,将残余物溶于乙酸乙酯(50 mL)中并用水(50 mL×2)和饱和氯化钠溶液(50 mL×1)洗涤,乙酸乙酯层用无水硫酸钠干燥,减压蒸馏除去溶剂。将残余物分散于少量乙醇中搅拌,过滤,得化合物3,白色固体(1.05 g,72.6%);mp:229~231 ℃;1H NMR(300 MHz,DMSO-d6)δ:8.26(1H,d,J=7.8 Hz,Ar-H),8.02(1H,s,-CONH2),7.89(1H,d,J=2.2 Hz,Ar-H),7.56(3H,d,J=8.1 Hz,Ar-H),7.27(2H,d,J=7.9 Hz,Ar-H),7.18(1H,s,-CONH2),6.84(1H,d,J=8.7 Hz,Aromatic amine-NH),3.81~3.77(2H,m,Piperidine-CH2),3.63~3.58(1H,m,Piperidine-CH),3.08~2.99(2H,m,Piperidine-CH2),2.95~2.86(1H,m,-ArCH),1.95~1.91(2H,m,Piperidine-CH2),1.41(9H,s,-C(CH3)3),1.30~1.26(2H,m,Piperidine-CH2),1.22(6H,d,J=7.0 Hz,2×-CH3);HRMS(ESI):Calcd.for C26H36N3O3[M+H]+438.267 8,Found 438.275 1;通过HPLC(MeOH 100%)测定,纯度为95.88%。
4-(哌啶-4-基)氨基-4′-异丙基-1,1′-联苯-3-甲酰胺(4) 将化合物3溶于二氯甲烷(40 mL),加入三氟乙酸(2.7 mL,36 mmol),室温反应24 h后减压蒸馏除去溶剂,分散于水(50 mL)中,调pH至9~10,过滤,得化合物4,淡黄色固体(662 mg,81.2%);mp:217~219 ℃;1H NMR(300 MHz,DMSO-d6)δ8.13(1H,d,J=7.9 Hz,Ar-H),7.93(1H,s,-CONH2),7.78(1H,d,J=2.2 Hz,Ar-H),7.48~7.45(3H,m,Ar-H),7.17(2H,d,J=8.0 Hz,Ar-H),7.09(1H,s,-CONH2),6.70(1H,d,J=8.8 Hz,Aromatic amine-NH),3.44~3.37(2H,m,Piperidine-CH and Piperidine-NH),2.88~2.75(3H,m,Piperidine-CH2and-ArCH),2.57~2.50(2H,m,Piperidine-CH2),1.85~1.81(2H,m,Piperidine-CH2,Piperidine-CH2),1.24~1.17(2H,m,Piperidine-CH2),1.13(6H,d,J=6.9 Hz,2×-CH3);HRMS(ESI):Calcd.for C21H28N3O[M+H]+338.215 4,Found 338.223 2;通过HPLC(MeOH 100%)测定,纯度为96.43%。
4-(1-(7-氨基庚酰基)哌啶-4-基)氨基-4′-异丙基-(1,1′-联苯)-3-甲酰胺(5) 邻苯二甲酰丁辛酯(1.3 g,3 mmol),N,N-二异丙基乙基胺(1 mL,6 mmol),室温反应5 h。完全反应后,减压蒸馏除去溶剂并重新溶解于二氯甲烷(50 mL)中,用水(50 mL×2)和饱和氯化钠溶液(50 mL×1)洗涤。二氯甲烷层用无水硫酸钠干燥,然后通过正相柱色谱法(石油醚-乙酸乙酯,2∶1)纯化,得到白色固体。将白色固体溶于二氯甲烷(30 mL)中,加入三氟乙酸,室温下搅拌24 h,加入饱和碳酸钠溶液(20 mL),乙酸乙酯(20 mL×1)萃取,乙酸乙酯层分别用水(50 mL×3)和饱和氯化钠溶液(50 mL×1)洗涤,无水硫酸钠干燥。减压蒸馏除去溶剂,得化合物5,淡黄色固体(788 mg,86.7%);mp:67~68 ℃;1H NMR(300 MHz,DMSO-d6)δ:8.27(1H,d,J=8.2 Hz,Ar-H),8.05(1H,s,-CONH2)),7.88(1H,s,Ar-H),7.56(3H,m,Ar-H),7.41~7.36(1H,m,-CONH2)),7.26(2H,d,J=8.0 Hz,Ar-H),6.86(1H,d,J=9.1 Hz,Aromatic amine-NH),4.15~4.11(1H,m,Piperidine-CH),3.79~3.66(2H,m,Piperidine-CH2),3.27~3.19(1H,m,-ArCH),2.97~2.88(2H,m,Piperidine-CH2),2.33~2.28(2H,m,2-CH2),1.97(2H,m,-NH2),1.48~1.45(2H,m,3-CH2),1.33~1.21(16H,m,2×Piperidine-CH2,4-CH2,5-CH2,6-CH2and 2×-CH3);HRMS(ESI):Calcd.for C28H41N4O2[M+H]+465.322 4,Found 465.321 3;通过HPLC(MeOH-H2O,90∶10,1‰ Et3N)测定,纯度为95.19%。
Grp94-probed的化学合成 将化合物5(100 mg,0.215 mmol)溶于DMF(8 mL)中,加入5-FAM(97 mg,0.258 mmol)和邻苯二甲酰丁辛酯(143 mg,0.323 mmol),N,N-二异丙基乙基胺(115 μL,0.645 mmol),室温反应4 h。减压蒸馏除去溶剂并重新溶解于二氯甲烷(10 mL)中,用水(20 mL×2)和饱和氯化钠溶液(20 mL×1)洗涤。将二氯甲烷层用无水硫酸钠干燥,然后通过正相硅胶柱色谱(二氯甲烷-甲醇,12∶1)纯化,得到Grp94-probe(39 mg,22.0%);mp﹥250 ℃。1H NMR(300 MHz,DMSO-d6)δ:10.17(2H,s,2×-OH),8.81(1H,s,Ar-H),8.48(1H,s,Ar-H),8.29~8.26(2H,m,Ar-H),8.05(1H,br.s,-CONH),7.91(1H,s,-CONH2),7.59(3H,d,J=4.8 Hz,Ar-H),7.38(1H,d,J=4.7 Hz,Ar-H),7.29(2H,d,J=4.7 Hz,Ar-H),7.19(1H,br.s,-CONH2),6.88(1H,d,J=5.4 Hz,Aromatic amine-NH),6.73(2H,s,Ar-H),6.62~6.57(4H,m,Ar-H),4.16~4.13(1H,m,Piperidine-CH),3.82~3.79(1H,m,Piperidine-CH2),3.71(1H,s,Piperidine-CH2),3.02~2.90(4H,m,Piperidine-CH2,7-CH2and-CH),2.78(1H,d,J=6.1 Hz,7-CH2),2.36(2H,t,J=4.4 Hz,2-CH2),2.02~1.96(2H,m,Piperidine-CH2),1.60~1.56(4H,m,3-CH2and 6-CH2),1.43~1.35(4H,m,Piperidine-CH2and 5-CH2),1.25(6H,d,J=6.9 Hz,2×-CH3),1.17~1.12(2H,m,4-CH2);HRMS(ESI):Calcd.for C49H51N4O8[M+H]+823.362 9,Found 823.371 2;通过HPLC(MeOH-H2O,90∶10)测定,纯度为96.02%。
2.3 Grp94-probe探针适用于荧光偏振实验
探针-蛋白曲线(图4-B)结果显示,Grp94-probe对Grp94N有较好的结合作用,其EC50为117.9 nmol/L,而与Hsp90α没有明显结合(结果未显示),表明该探针是Grp94的特异性探针。为了验证Grp94-probe能否应用于FP实验测试化合物的Grp94抑制活性,本研究以Grp94-probe作为荧光探针,测试了本课题组先前得到的化合物DDO-5812、DDO-5813、Hsp90泛抑制剂AT13387及细胞质亚型Hsp90α选择性抑制剂SNX2112对Grp94的抑制活性(图4-C),结果显示DDO-5813仍是对Grp94抑制活性最优的,而SNX-2112展现出较弱的Grp94抑制活性,与文献报道一致。此外,以GA-FITC作为探针测试这几个化合物对Grp94抑制活性的实验结果见图4-D。对比这两个测试结果,可以看出测得的Grp94抑制活性趋势是相同的。但是以Grp94-probe作为探针分子,测试得到的细胞质亚型Hsp90α选择性抑制剂SNX2112的Grp94抑制活性(1.76±0.22 μmol/L)显著低于以GA-FITC作为探针的测试结果(0.097±0.22 μmol/L),表明Grp94-probe能够更好的区分Grp94高亲和力与低亲和力抑制剂。因此,Grp94-probe作为Grp94特异性探针相较于GA-FITC可更好地用于考察内质网亚型Grp94抑制剂的活性。

Figure4 (A) Structure of Grp94-Probe;(B) Probe-protein curve (Grp94-probe concentration of 30 nmol/L);(C) Using Grp94-Probe to test Grp94 inhibitory activity of compounds (Grp94-probe concentration of 30 nmol/L,protein concentration of 100 nmol/L);(D) Using GA-FITC to test Grp94 inhibitory activity of compounds (GA-FITC concentration of 6 nmol/L,protein concentration of 15 nmol/L)
2.4 细胞荧光成像研究
本实验考察了Grp94-probe探针分子在乳腺癌细胞MCF-7细胞上与内质网Grp94的结合情况。染料ER-Red是细胞内质网特异性染料,DAPI是一种能够与DNA强力结合的荧光染料。将处于对数生长期状态良好的细胞制成每毫升2×104个细胞的悬液。取细胞悬液(2 mL)接种于6孔板上并孵育24 h。加入DAPI染色15 min,吸去DAPI并用PBS洗涤2次,再与ER-Red(1 μmol/L)和Grp94-probe(2 μmol/L)共染色1 h,吸去染色液,PBS洗涤2次后荧光显微镜下观察。
通过共染色结果(图5)可以看到探针分子与细胞内质网中Grp94发生结合,并且4 h后荧光未随着时间快速衰减,Grp94-probe与Grp94的结合仍然较稳定,排除了非特异性染色的可能性。以上结果表明,Grp94-probe可以在细胞内与Grp94发生结合,该探针分子有助于在细胞内对Grp94的定位研究。

Figure5 Co-staining assay for Grp94-probe,ER-Red and DAPI in cell.Merge 1 showed the co-staining DAPI and ER-Red;Merge 2 showed the co-staining DAPI and Grp94-probe;Merge 3 showed the co-staining DAPI,ER-Red and Grp94-probe
3 结 论
本研究通过分析Grp94选择性抑制剂DDO-5813与Grp94结合模式,设计合成了一种Grp94特异性荧光探针。荧光偏振实验数据表明:Grp94-probe能够特异性地与Grp94结合,并且作为探针分子时能较好地区分化合物对Grp94抑制活性的强弱。通过与ER-Red细胞内共染色证明Grp94-probe可以在细胞内与内质网Grp94结合。综上所述,本研究得到了第1个Grp94特异性荧光探针,其在荧光偏振实验考察Grp94抑制剂活性及研究Grp94生物学功能中有一定应用前景,具有进一步研究和应用价值。
