一种转基因猪血中重组人血清白蛋白分离纯化新方法
2019-05-22钱小红秦伟捷张普民张养军
余 谦,王 勇,钱小红,秦伟捷,张普民,张养军*
(1.安徽医科大学 研究生院,安徽 合肥 230032;2.军事医学研究院生命组学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206;3.中国人民解放军陆军军医大学(第三军医大学) 基础医学院实验动物学教研室,重庆 400038)
人血清白蛋白(Human serum albumin,HSA)在人血液中含量约为40 mg/L,约占血浆总蛋白含量的60%[1],在维持体液的正常分布、保持血容量及血压等方面起着重要作用[2]。在临床上用于治疗出血性休克、烧伤、肝硬化或者肾病引起的腹水等疾病[3]。另外,HSA还应用于药剂辅料、诊断试剂、手性物质分离剂、培养基添加剂等研究[4]。目前,仅从人血液中提取HSA难以满足市场的需求,且人血来源极其复杂,存在血源污染等潜在威胁[5]。因此,迫切需要一种安全可靠、成本相对低廉的HSA替代品。
随着基因重组技术飞速发展,通过基因工程获得重组人血清白蛋白(Recombinant human serum albumin,rHSA)已成为可能。由于该技术能够克服传统方法存在的血源供应不足以及血源污染等缺陷,已经成为研究和生产rHSA的重点技术。如Lawn等[6]在大肠杆菌(E.coli)中成功表达了rHSA;日本三菱公司Sumi等[7]利用毕赤酵母作为表达系统,获得的rHSA产量高达10 g/L;华北制药有限公司邓建慧等[8]设计的“发酵生产重组人血清白蛋白HSA的方法”获得国家发明专利;He等[9]利用水稻胚乳细胞作为生物反应器生产植物源rHSA,每1 kg种子提取的rHSA量可达2.75 g;Peng等[10]利用CRISPR/Cas9技术对猪受精卵的基因组进行编辑,在猪白蛋白基因区域插入人血清白蛋白基因,使猪血中只产生rHSA,通过纯化猪血浆获得大量高纯度的rHSA。由于转基因猪血中分离纯化的rHSA必须符合临床用药和生化研究的要求,因此,分离纯化rHSA是从转基因猪血中制备rHSA的关键步骤。为此,本工作采用低温乙醇沉淀法的改良方法[11],即热乙醇沉淀法[12-13]与多级色谱法[14]相结合的分离纯化方法,从猪血中获得了高纯度和高收率的rHSA,从而为规模化的rHSA制备奠定了基础。
1 实验部分
1.1 仪器、试剂与材料
Rigol L-3000高效液相色谱(北京普源精仪科技有限责任公司);IEC CM-825色谱柱(75 mm×8 mm,8 μm,日本Shodex公司);BioSuite DEAE AXC色谱柱(75 mm×7.5 mm,10 μm,美国Waters公司);BEH C4色谱柱(250 mm×4.6 mm,3.5 μm,美国Waters公司);RCT basic加热磁力搅拌器(德国IKA公司);7020全自动生化分析仪(日本HITACHI公司);pH测量仪、EASY-nLC 1 000纳升级液相色谱仪、Q ExactiveTMHF质谱仪(美国Thermo Fisher Scientific公司)。
人血白蛋白注射液(Baxter HSA,美国Baxter公司);植物源重组人血清白蛋白注射液(Heyuan rHSA,武汉禾元生物科技有限公司);预染蛋白Marker(美国Thermo Fisher Scientific公司);测序级修饰胰蛋白酶(美国Promega公司);白蛋白(ALB)测定试剂盒(北京利德曼生化股份有限公司);辛酸钠(北京万佳首化生物科技有限公司);无水乙醇(北京化工厂);氯化钠(西陇化工股份有限公司);浓盐酸、氢氧化钠(国药集团化学试剂有限公司);Tris(美国Affymetrix公司);三氟乙酸、乙腈(美国Sigma公司);所用试剂均为分析纯。
1.2 rHSA分离纯化方法
1.2.1 初步分离血浆将80 g/L的柠檬酸钠溶液与新鲜转基因猪血按体积比1∶19混匀,2 000×g离心30 min,取上清,即转基因猪血浆,-20 ℃冻存备用。
1.2.2 热乙醇沉淀法将冻存的血浆在4 ℃解冻,2 000×g离心15 min,取上清;加入等体积含有6 g/L辛酸钠、8 g/L氯化钠和14%(体积分数)无水乙醇的混合水溶液,调节pH至5.0~7.0,在不断机械搅拌条件下,加热溶液至55~70 ℃,恒温保持20~60 min;移至冰水浴,不断搅拌,待溶液冷却至室温后,调节pH值至4.3;室温静置2 h后在5 000×g条件下离心30 min,收集上清液和沉淀,沉淀用pH 4.8的蒸馏水淋洗,在相同条件下再次离心,取上清液,2次上清液混合即为粗提取的rHSA上清液。
1.2.3 多级色谱分离法对热乙醇沉淀法粗提的rHSA上清液进行离子交换色谱分离,收集目标组分;再将目标组分经过反相色谱进一步纯化,收集最终目标组分,冷冻干燥后进行纯度分析。
(1)阳离子交换色谱:采用阳离子交换色谱柱Shodex IEC CM-825;流动相A为0.02 mol/L 醋酸钠(pH 4.6),流动相B为0.02 mol/L 醋酸钠-0.3 mol/L NaCl(pH 5.2);流速1 mL/min;检测波长280 nm;柱温25 ℃;梯度洗脱程序:0~10 min,100% A;10~15 min,100%~50% A;15~25 min,50% A;25~50 min,50%~0% A;50~70 min,0% A。
(2)弱阴离子交换色谱:采用弱阴离子交换色谱柱BioSuite DEAE AXC;流动相A为0.02 mol/L Tris-HCl(pH 8.8),流动相B为0.02 mol/L Tris-HCl+0.3 mol/L NaCl(pH 8.8);流速1 mL/min;检测波长280 nm;柱温25 ℃(室温);梯度洗脱程序:0~5 min,100% A;5~50 min,100%~0% A;50~60 min,0% A。
(3)反相色谱:采用反相色谱柱BEH C4;流动相A为2%(体积分数)乙腈-0.1% 三氟乙酸溶液,流动相B为98% 乙腈-0.1% 三氟乙酸溶液;流速0.7 mL/min;检测波长280 nm;柱温35 ℃;梯度洗脱程序:0~10 min,100% A;10~45 min,100%~5% A;45~50 min,5% A;50~53 min,5%~100% A;53~60 min,100% A。
1.3 rHSA纯度的表征方法
1.3.1 反相色谱法表征采用反相色谱柱BEH C4对收集的目标组分进行纯度表征,所用反相色谱条件同上。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)表征采用10% SDS-PAGE凝胶对收集的目标组分进行纯度表征。凝胶制备方法:分离胶为10% 丙烯酰胺、0.1% 十二烷基硫酸钠、0.1% 过硫酸铵、0.01% 四甲基乙二胺及40% 1.5 mol/L Tris-HCl(pH 8.8)的混合水溶液;浓缩胶为5% 丙烯酰胺、0.1% 十二烷基硫酸钠、0.1% 过硫酸铵、0.01% 四甲基乙二胺及10% 1 mol/L Tris-HCl(pH 6.8)的混合水溶液。
1.3.3 液相色谱-串联质谱表征条件:酶解肽段混合物使用流动相A(0.1% FA溶液)溶解,上样体积5 μL,流速600 nL/min。使用二元泵进行高压混合梯度洗脱(流动相B为0.1% FA乙腈溶液),洗脱梯度为:0~30 min,95%~70% A;30~40 min,70%~5% A;40~46 min,5% A;46~47 min,5%~95% A;47~52 min,95% A。选择正离子模式,喷雾电压为2.4 kV,一级扫描范围为m/z350~1 600,分辨率为120 000,动态增益控制(AGC target)为3×106;二级扫描分辨率为30 000,动态增益控制(AGC target)为5×104,动态排除时间(Dynamic exclusion)为12.0 s。
数据库检索:质谱分析RAW文件使用MaxQuant软件(1.5.3.8 版本)进行分析。Maxquant搜索参数设置:一级质谱扫描母离子肽段质量误差为20 ppm,二级质谱扫描肽段碎片离子质量误差为20 mmu,蛋白质酶解选择胰蛋白酶,最大漏切位点设为2个;固定修饰为半胱氨酸烷基化修饰,可变修饰为甲硫氨酸氧化修饰,肽段假阳性率为1%;蛋白质数据库分别为猪、水稻和人全蛋白数据库(2018年8月15日下载于Uniprot 蛋白质组数据库)。
1.4 rHSA的回收率
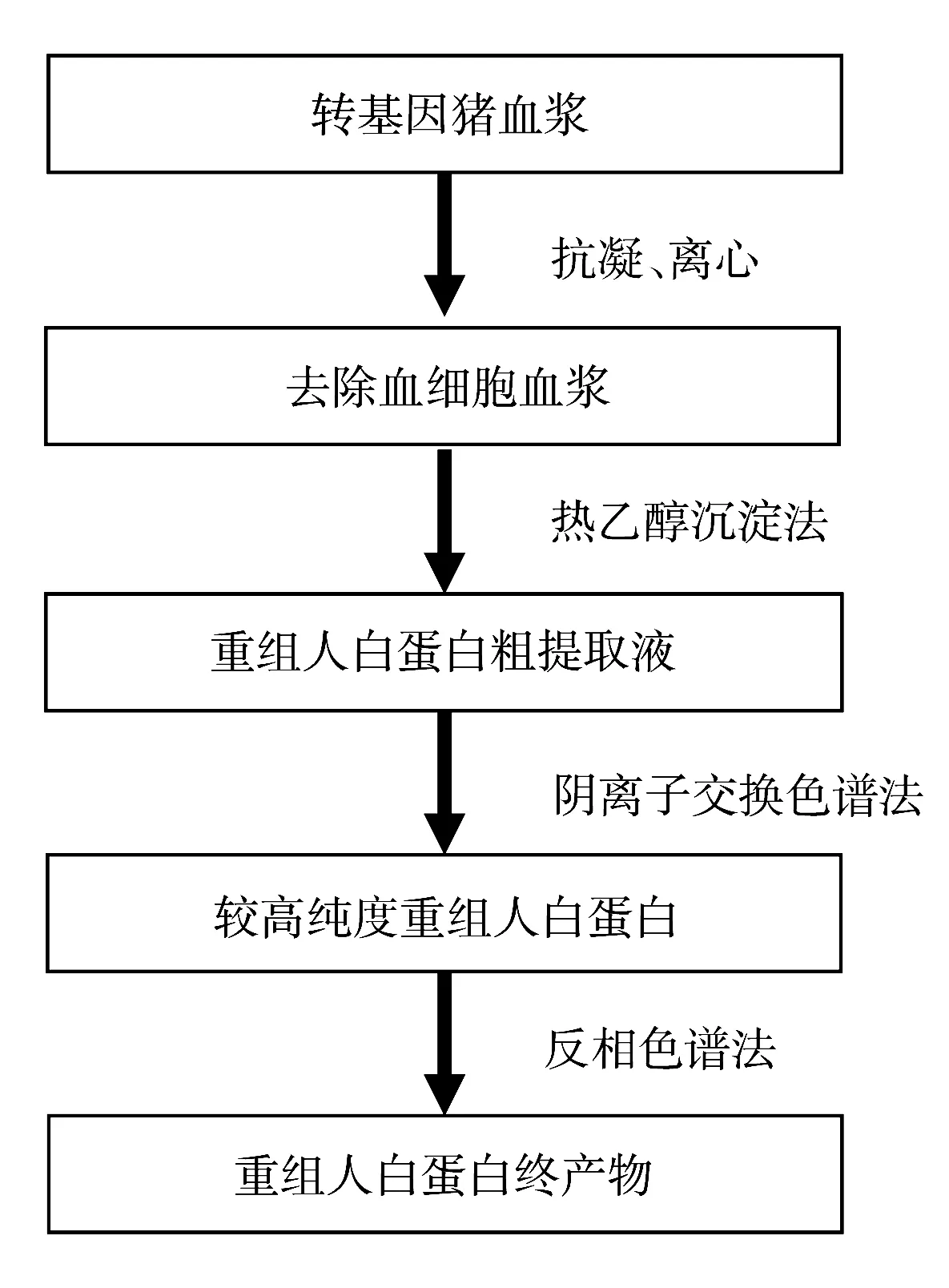
图1 rHSA分离纯化技术路线Fig.1 Strategy of rHSA separation and purification
rHSA浓度采用白蛋白(ALB)测定试剂盒测定,即在pH 4.2条件下,样本中的白蛋白与溴甲酚绿偶合形成蓝绿色络合物,在630 nm处有吸收峰,颜色深浅与样本中的白蛋白浓度成正比。与同样处理的牛血清白蛋白标准液做比较,可求得样本中白蛋白含量。试剂盒中包含R液和S液,将R液放入日立7020型全自动生化分析仪中相应的试剂盘位置,再用试剂盒中的S液(校准液)放入进样盘中进行校准,校准完毕后测试样本中rHSA浓度,并计算回收率。
2 结果与讨论
2.1 rHSA分离纯化流程
取新鲜的转基因猪血,加入抗凝剂,离心去除血细胞后,经热乙醇沉淀法粗提取rHSA,再经过多级色谱分离法(阴离子交换色谱法和反相色谱法)精纯化,最终获得高纯度的rHSA,具体分离纯化技术路线如图1所示。
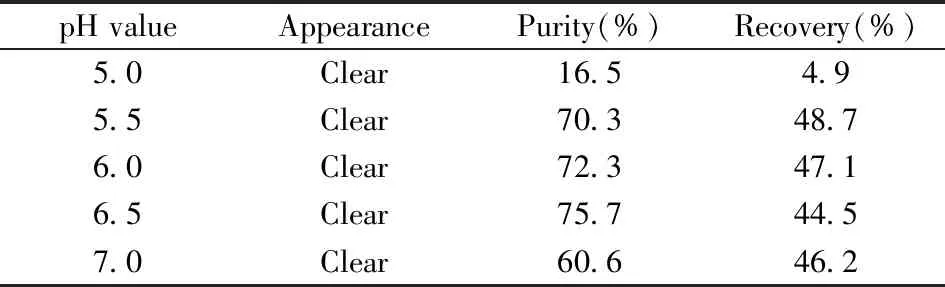
表1 pH值对rHSA纯度和回收率的影响Table 1 Effect of pH value on purity and recovery of rHSA
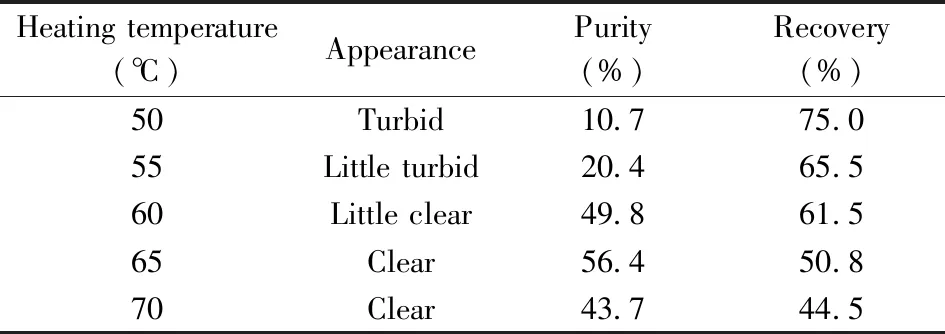
表2 加热温度对rHSA纯度和回收率的影响Table 2 Effect of heating temperature on purity and recovery of rHSA
2.2 热乙醇沉淀法
2.2.1 pH值的影响在加热温度65 ℃和恒温反应时间60 min的条件下,考察了反应体系不同pH值(5.0~7.0)对热乙醇沉淀法提取rHSA纯度和回收率的影响。含rHSA上清液外观、反相色谱表征纯度及回收率列于表1。由表1可看出,当pH 6.5时,rHSA的纯度(75.7%)和回收率(44.5%)均较为理想,故选择pH 6.5作为热乙醇沉淀法提取rHSA的最佳pH值。
2.2.2 加热温度的影响在反应体系pH 6.5和恒温反应时间60 min的条件下,考察了不同加热温度(50~70 ℃)对热乙醇沉淀法提取rHSA纯度和回收率的影响。含rHSA上清液外观、反相色谱表征纯度及回收率列于表2。结果显示,当加热温度为65 ℃时,rHSA的纯度和回收率均较为理想,故将65 ℃作为热乙醇沉淀法提取rHSA的最佳加热温度。
2.2.3 恒温反应时间的影响在反应体系pH 6.5和加热温度65 ℃的条件下,考察了不同恒温反应时间(20~60 min)对热乙醇沉淀法提取rHSA纯度和回收率的影响,并考察含rHSA上清液外观、反相色谱表征纯度及回收率数据。结果显示,在考察的恒温反应时间内,含rHSA的上清液均为澄清。且当恒温反应时间40 min时,rHSA的纯度(69.5%)和回收率(51.3%)均为最佳,故选择40 min作为热乙醇沉淀法提取rHSA的最佳恒温反应时间。
2.2.4 稀释倍数的影响为了考察不同稀释倍数(稀释倍数=原液浓度/(原液浓度×移取体积/定容体积))对热乙醇沉淀法提取rHSA纯度和回收率的影响,将猪血浆按不同倍数(2、4、6、10倍)稀释,并调节pH值为6.5,加热温度为65 ℃,恒温反应40 min,离心后得到含rHSA上清液。观察含rHSA上清液的外观,并测定反相色谱表征纯度及回收率。结果显示,随着稀释倍数的增加,反应体系过度稀释会使其他血清蛋白不能完全变性沉淀分离,导致纯度降低,不能满足rHSA纯化的要求。故在pH 6.5,加热温度为65 ℃,恒温反应40 min的条件下,选择2倍稀释倍数作为热乙醇沉淀法提取rHSA的最佳反应条件。
综上,最终确定将血浆按2倍稀释,在pH 6.5以及65 ℃恒温加热下反应40 min作为热乙醇沉淀法的最佳反应条件。采用该条件对血浆热乙醇沉淀纯化后的rHSA上清液进行反相色谱和SDS-PAGE表征,同时与商品化的植物源Heyuan rHSA样本进行同样表征作为对照,结果如图2所示。
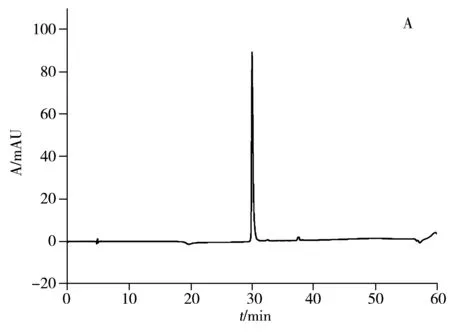
结果显示,在最佳条件下,热乙醇沉淀法制备的rHSA反相色谱表征纯度约为69.5%(图2A);商品化的Heyuan rHSA反相色谱表征纯度为100.0%(图2B);根据SDS-PAGE电泳表征(蛋白上样量均为7 μg,图2C),将热乙醇沉淀后rHSA(泳道2~6)与Heyuan rHSA(泳道7)纯度进行比较,在10、13、25、100 kDa处还存在杂质蛋白,需采用多级色谱分离方法进一步纯化。而经热乙醇沉淀法纯化后,测得rHSA的回收率约为51.3%。
2.3 阴离子交换色谱法
由于白蛋白的等电点约为4.7~4.9,因此,既可选择阳离子交换色谱也可以选择阴离子交换色谱对热乙醇法纯化的白蛋白组分进一步纯化。为此,首先对两种色谱方法的纯化结果进行比较。热乙醇沉淀法粗提取的rHSA分别经阳离子和阴离子交换色谱纯化后,收集它们的产物进行反相色谱表征,结果显示,阴离子交换色谱的纯化产物纯度(92.6%)略优于阳离子交换色谱的产物(90.5%),因此,本实验选择阴离子交换色谱法对经热乙醇沉淀法粗提纯的rHSA作进一步纯化。
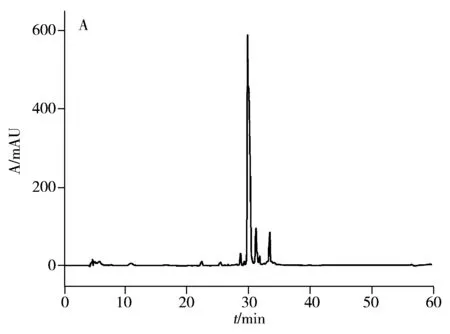
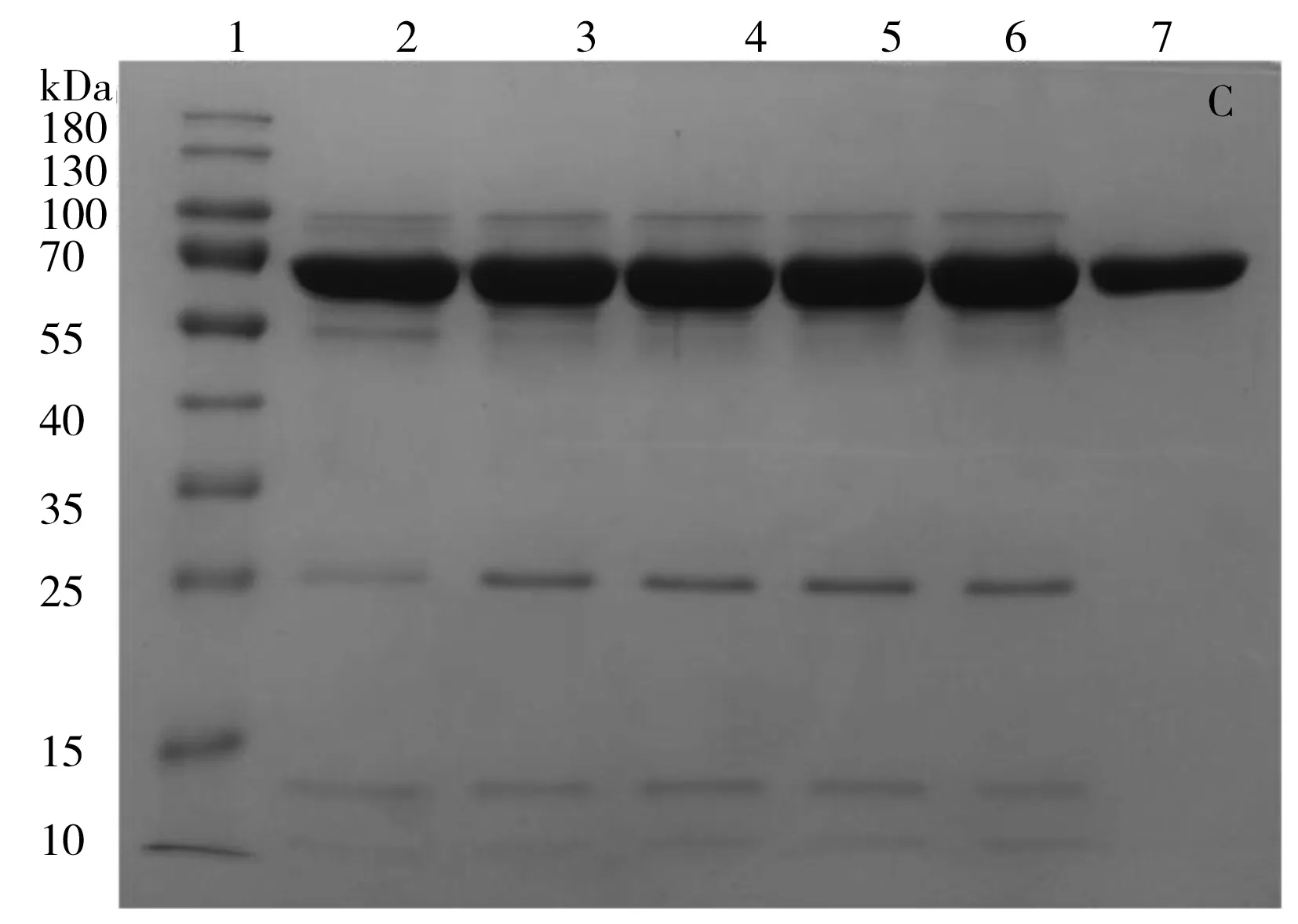
图2 热乙醇沉淀制备的rHSA反相色谱纯度表征(A)、商品化植物源Heyuan rHSA反相色谱纯度表征(B)及SDS-PAGE纯度表征(C)Fig.2 Purity characterization of rHSA after thermal ethanol precipitation(A) and Heyuan rHSA from plants source(B) by a reversed-phase liquid chromatography and their purity characterization by SDS-PAGE(C)
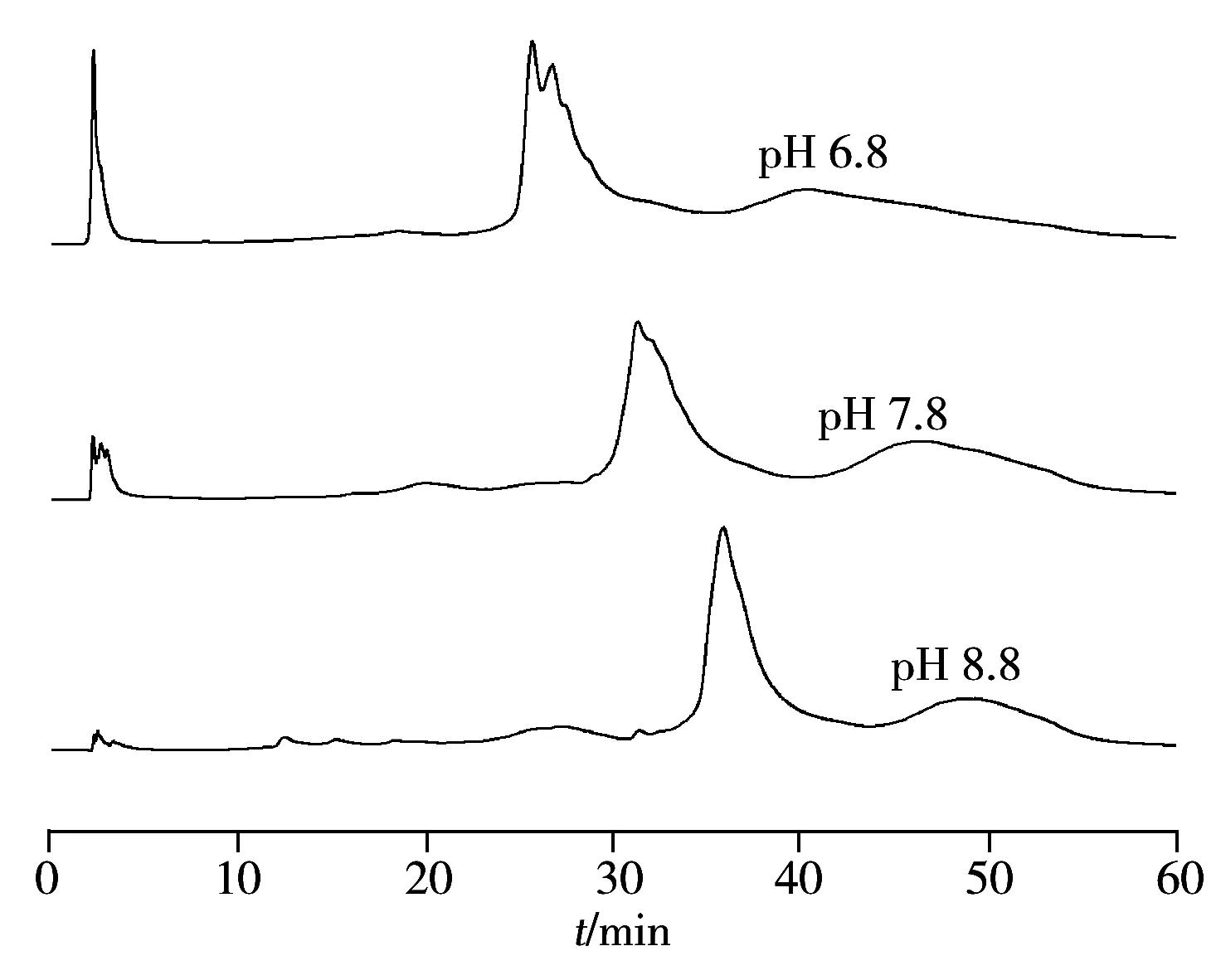
图3 热乙醇沉淀后rHSA样本分别经不同流动相pH值的阴离子交换纯化色谱图Fig.3 Anion exchange chromatograms of rHSA samples purified by mobile phase with different pH values
2.3.1 流动相种类与盐浓度预试验中选用NaCl作为离子强度试剂,浓度从0 mol/L升至1 mol/L,线性梯度洗脱结果显示,样本中各组分有效洗脱的盐浓度范围为0~0.3 mol/L。盐浓度大于0.3 mol/L后,无新组分被洗脱,故确定阴离子交换色谱最合适的流动相为A相:0.02 mol/L Tris-HCl;B相:0.02 mol/L Tris-HCl+0.3 mol/L NaCl。
2.3.2 流动相pH值的影响一般DEAE-弱阴离子交换色谱柱推荐的pH范围为5.0~9.0。当采用盐浓度从0 mol/L增至0.3 mol/L进行线性梯度洗脱时,考察了流动相不同pH值(6.8、7.8、8.8)对分离纯化结果的影响。结果显示,当流动相pH值较高时能明显提高样本中各组分在阴离子交换色谱中的分离效果(见图3),因此,实验选择pH 8.8作为阴离子交换色谱流动相的最佳pH值。
综上,采用上述色谱条件对血浆经热乙醇沉淀纯化后的rHSA上清液进行阴离子交换色谱分离纯化,并收集33.0~43.0 min目标组分脱盐后冷冻干燥,然后将目标组分用反相色谱表征纯度。结果显示,rHSA纯度较上一步热乙醇沉淀法的纯度明显提高,但仅达到85.0%(面积归一化法),还需采用反相色谱进一步纯化。
2.4 反相色谱法
对阴离子交换色谱纯化后的rHSA产物进行反相色谱分离纯化,收集28.5~30.0 min组分,脱盐后冷冻干燥,进行反相色谱和SDS-PAGE纯度表征,结果如图4所示。结果表明,经反相色谱进一步纯化后的rHSA纯度约为100.0%(图4A),与商品化的Heyuan rHSA纯度基本一致;采用SDS-PAGE凝胶电泳对每个步骤制备rHSA的纯度表征结果可知(图4B),rHSA分别经热乙醇沉淀(泳道3)、阴离子交换(泳道4)和反相色谱(泳道5)制备后,与原始猪血浆(泳道2)的条带进行比较,杂质条带逐渐变少;其中反相色谱纯化的最终rHSA的电泳条带与商品化的Heyuan rHSA(泳道6)和Baxter HSA(泳道7)基本一致,未见明显杂质条带。
另外,采用基于信号强度的绝对定量方法(Intensity based absolute quantification,iBAQ)[15]对产物rHSA的酶切产物(胰蛋白酶酶切)进行HPLC-MS/MS和MaxQuant软件分析,计算出最终产物rHSA的纯度,即将质谱鉴定蛋白肽段的质谱信号强度之和除以该蛋白的理论酶切肽段数,得到该蛋白的iBAQ值,然后对鉴定的所有蛋白的iBAQ值进行归一化处理,从而计算出每个蛋白在所有鉴定蛋白中的百分比。对每一纯化步骤得到产物用反相色谱表征以及对阴离子交换色谱和反相色谱纯化产物进行HPLC-MS/MS表征的结果列于表3。

表3 各步骤纯度表征结果Table 3 Purity characterization results in different stages (%)
*:no data
结果显示,各步骤rHSA经反相色谱纯度表征后,产品rHSA的纯度逐渐升高,最终其纯度接近100.0%,与对照品Heyuan rHSA的100.0%纯度基本相同。另外,反相色谱纯化的最终产物rHSA经HPLC-MS/MS表征的纯度约为95.8%,与对照品Heyuan rHSA的99.8%纯度有一定差距,但略高于对照品Baxter HSA的94.7%,表明采用多步骤纯化方法可以较好地分离纯化猪血中的rHSA。另外,经多级色谱(阴离子交换色谱和反相色谱)纯化后,测得色谱法纯化后rHSA的回收率约为80.1%,故热乙醇沉淀和多级色谱纯化的总回收率约为41.1%。
3 结 论
通过热乙醇沉淀、阴离子交换色谱和反相色谱多步骤纯化方法对猪血中rHSA纯化后,rHSA纯度分别从猪血浆中的9.3%提高到热乙醇沉淀法的69.5%,再到阴离子交换色谱的85.0%,最终达到反相色谱的100.0%(反相色谱表征),HPLC-MS/MS表征的纯度约为95.8%;总回收率约为41.1%。说明本纯化方法能够较好地分离纯化猪血中的重组人白蛋白。尽管由于本方法纯化的重组人白蛋白仍然存在微量的猪蛋白,目前纯度的rHSA尚不能满足临床用药要求,但可用于生化研究,从而为替代人血源rHSA的规模化制备方法建立奠定了基础。
