傅立叶变换离子回旋共振质谱法对赤灵芝的化学成分鉴定和指纹图谱研究
2019-05-22杨秋霞杨运云刘耀慧向章敏郭鹏然
杨秋霞,杨运云,刘耀慧,2,向章敏,郭鹏然*
(1.广东省测试分析研究所,广东省化学危害应急检测技术重点实验室,广东省原位电离质谱分析工程技术研究中心,广东 广州 510070;2.华南农业大学 食品学院,广东 广州 510642)
灵芝(Ganodermalucidum)属于担子菌纲多孔菌科灵芝属真菌。《中华人民共和国药典》2015年版所收载的灵芝药用正品为赤灵芝Ganodermalucidum(Leyss.ex Fr.) Karst.或紫芝Ganodermasinense的干燥子实体。作为灵芝中的一种,赤灵芝含有大量的生物活性成分[1-2],主要包括多糖[3-5]、三萜[6-8]、核苷酸、类固醇、甾醇、脂肪酸、蛋白质、肽及微量元素[9],具有抗肿瘤[10-12]、抗糖尿病[13]、免疫调节[14-15]、抗菌、抗病毒(包括抗HIV)[16]等多种药理作用。
目前,主要采用薄层色谱(TLC)、紫外光谱(UV)、红外光谱(IR)、核磁谱(NMR)、质谱(MS)[6,17]、高效液相色谱(HPLC)、高效液相色谱-质谱联用(HPLC-MS)等技术对赤灵芝进行质量控制[18-19]。然而,这些技术均存在不足,如UV、IR、NMR的专属性较差;HPLC、HPLC-MS的分析时间长且需要标准品。因此,亟需建立一种快速的赤灵芝化学成分鉴定和指纹图谱分析新方法。傅立叶变换离子回旋共振质谱(FTICR-MS)技术具有灵敏度高、分辨率高、准确度好的特点,可直接进行质谱分析,大大缩短了分析时间,其超高的质量精度和分辨率有利于测定化学成分的精确分子量[20-21];此外,FTICR-MS还提供了多种碎裂方式,可以获得非常丰富的离子碎片信息以进行化合物结构的鉴定[22]。
本文建立了一种基于FTICR-MS的赤灵芝化学成分快速鉴定和指纹图谱分析方法,采用聚类分析和主成分分析等统计学手段对不同产地的赤灵芝进行来源区分和质量评价。该方法可实现赤灵芝药材的直接、快速、高效分析,在中药分析和质量控制领域有着良好的应用前景。
1 实验部分
1.1 仪器与设备
SolariX XR 7.0 T FTICR-MS质谱仪(德国Bruker公司,配有电喷雾离子源),BS 210S电子分析天平(德国Sarrorius公司),XY-200高速多功能粉碎机(浙江省永康市松青五金厂),1 mL带针注射器(宣城市江南医疗器械有限公司),0.22 μm微孔滤膜(天津市津腾实验设备有限公司),HH-4数显恒温水浴锅(常州澳华仪器有限公司),DataAnalysis 4.4数据处理软件(德国Bruker公司)。

表1 不同来源赤灵芝样品的具体信息Table 1 Detailed informations of different Ganoderma lucidum samples
1.2 材料与试剂
甲醇(色谱纯,德国默克股份两合公司);实验用水为纯化水,由Milli-Q超纯水系统制备;三氟乙酸钠校准溶液(NaTFA)、芥子酸(美国Sigma-Aldrich公司);标准品均购自中国药品生物制品鉴定所;原儿茶酸(批号:110809-201205)、柠檬酸(批号:W142449191102)、赤灵芝样品购自当地不同药店,具体信息见表1。
1.3 质谱条件
电喷雾离子源(ESI离子源),负离子扫描模式,扫描质荷比范围:m/z100~1 000;喷雾气压力(Nebulizer pressure):40 kPa;干燥气体(Dry gas):氦气,流速:4.0 L/min;干燥气温度(Drying gas temperature):200 ℃;喷雾电压(Spray capillary voltage):4.0 kV;采样大小为4 M(兆),累加次数16次;二级质谱采用碰撞诱导解离(Collision-induced dissociation,CID)方式进行母离子碎裂,碰撞能量范围为10~30 eV。每个样品注入ESI源前,需对离子源进行清理,直至背景信号强度小于105的响应,以确保样品的信号强度大于背景信号的3倍信噪比(S/N)。数据采集及数据分析均采用仪器配有的专用软件进行处理。
1.4 样品制备
将赤灵芝样品粉碎后,过24目筛,准确称取赤灵芝样品1.0 g,精确至0.000 1 g,加入40 mL 50%甲醇,80 ℃水浴回流1 h,将回流液冷却至室温,过滤后获取滤液。将滤液稀释(10倍),过0.22 μm滤膜后质谱直接测定。
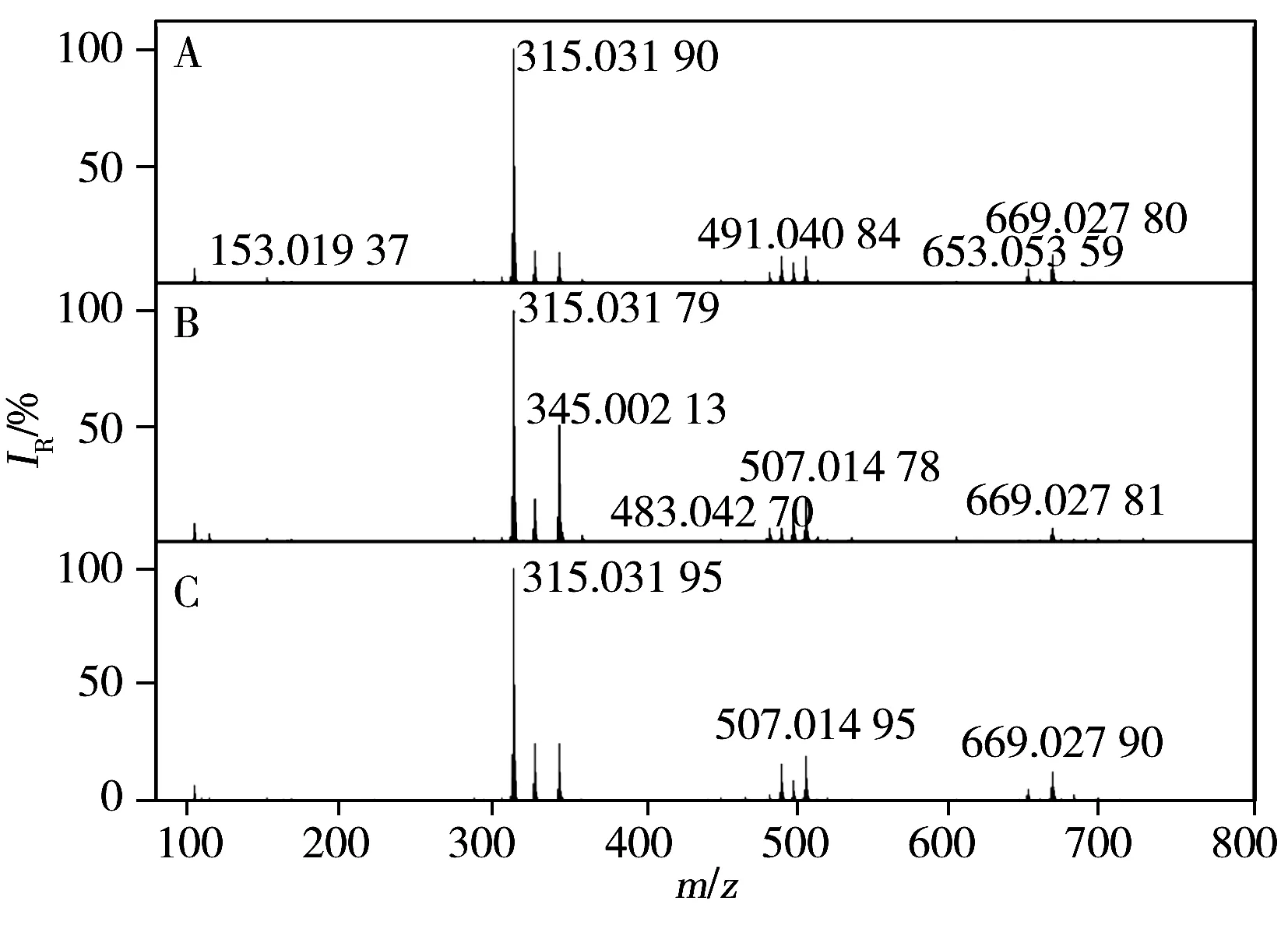
图1 不同提取溶剂的赤灵芝质谱图Fig.1 MS spectra of Ganoderma lucidum with different extract solventsA.pure water;B.50% methanol;C.methanol
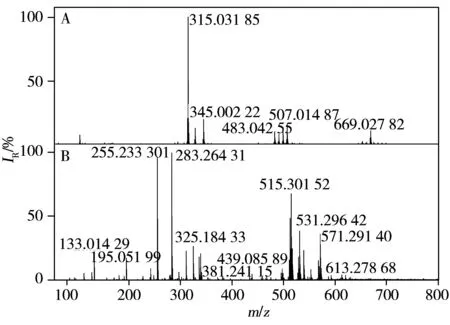
图2 不同离子源下赤灵芝的FTICR-MS质谱图Fig.2 MS spectra of Ganoderma lucidum with different ion sourcesA:MALDI source,B:ESI source
2 结果与讨论
2.1 质谱条件的优化
以获取更多的样品质谱信息作为基础,为建立快速分析鉴定赤灵芝化学成分的方法,本实验分别对赤灵芝的提取溶剂和离子源进行了优化。分别考察了水、50%甲醇、甲醇作为赤灵芝提取溶剂时,样品的谱图情况(见图1)。结果显示,以50%甲醇作为提取溶剂时能获取更多的质谱信号。近年来,基质辅助激光解吸电离源(MALDI)直接快速鉴定中药化学成分的方法取得了飞速发展。为开发快速检测中药化学成分的分析方法,本实验考察了电离喷雾(ESI)与MALDI两种电离源对赤灵芝化学成分快速分析的情况,其中,采用MALDI对赤灵芝进行检测分析时,利用芥子酸作为基质。两种电离源的检测结果见图2。由图可见,ESI离子源电离模式下获得的质谱数据除包含MALDI离子源电离模式的质谱数据之外,还获得更多其它质谱数据,因而ESI源电离效果更有利于赤灵芝成分的电离。由于赤灵芝中含有大量的有机酸类成分,因此,选择负离子检测模式进行赤灵芝样品的检测分析。最终确定利用50%甲醇提取赤灵芝样品,在ESI源负离子模式下对样品进行检测分析,以获得更多的样品质谱信号。
2.2 ESI/FTICR-MS成分分析方法的评价
2.2.1 精密度与重复性对同一样品溶液重复注入6次进行质谱检测,使用相对峰值强度的验证方法[23]以确定仪器的精密度。经计算,m/z133.014 35、195.051 34、515.300 99等质谱峰的相对峰值强度的RSD均小于3.6%,说明ESI/FTICR-MS具有较好的仪器精密度。
对6个独立制备的样品进行质谱检测,使用相对峰值强度的验证方法[23],分别计算m/z133.014 35、195.051 34、515.300 99等质谱峰的相对峰值强度的RSD,结果均低于4.8%,说明ESI/FTICR-MS成分分析方法具有较好的重复性。
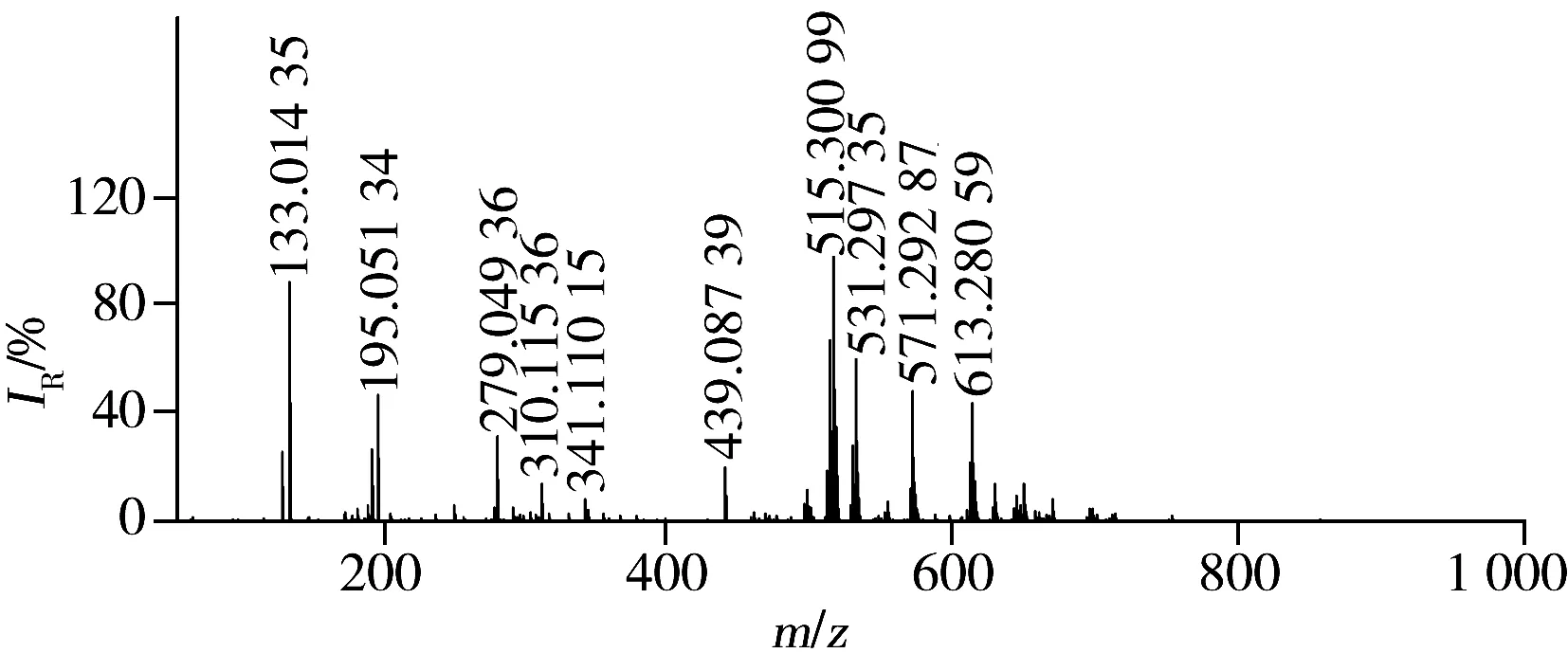
图3 赤灵芝的FTICR-MS指纹质谱图Fig.3 FTICR-MS fingerprint of Ganoderma lucidum
2.2.2 稳定性与准确性对同一样品在0、2、4、8、12、24、36、48 h采集的质谱数据进行相对峰值强度[23]分析,分别计算峰强度较高的质谱峰,如m/z133.014 35、195.051 34、515.300 99等的相对峰值强度的RSD,结果均小于4.2%。表明样本在48 h内保持稳定,使用ESI/FTICR-MS成分分析方法可行,且结果稳定可靠。
进一步通过ESI/FTICR-MS检测原儿茶酸、柠檬酸标准品,获得的质谱数据与理论值的误差值均小于3×10-6,这表明ESI/FTICR-MS的质量准确度可信。因此,本实验建立的ESI/FTICR-MS方法有效可行。
2.3 赤灵芝主要成分的鉴定
为确保分析结果的准确性,每次实验前均在ESI源正离子模式下用三氟乙酸钠校正液对质量轴进行校正。赤灵芝的主要质谱峰如图3所示,表2为赤灵芝主要成分的鉴定结果。通过采用ESI/FTICR-MS法,将母离子及其碎片离子与相关文献进行比较,比较的数据包括分子式、质荷比和碎片离子信息,从而准确识别出主要成分63种,包括1种萜烯醛,3种糖,4种三萜醇,6种有机酸和49种三萜酸类成分。这些数据由仪器系统工作站计算推导,误差值均小于3.0 ×10-6。
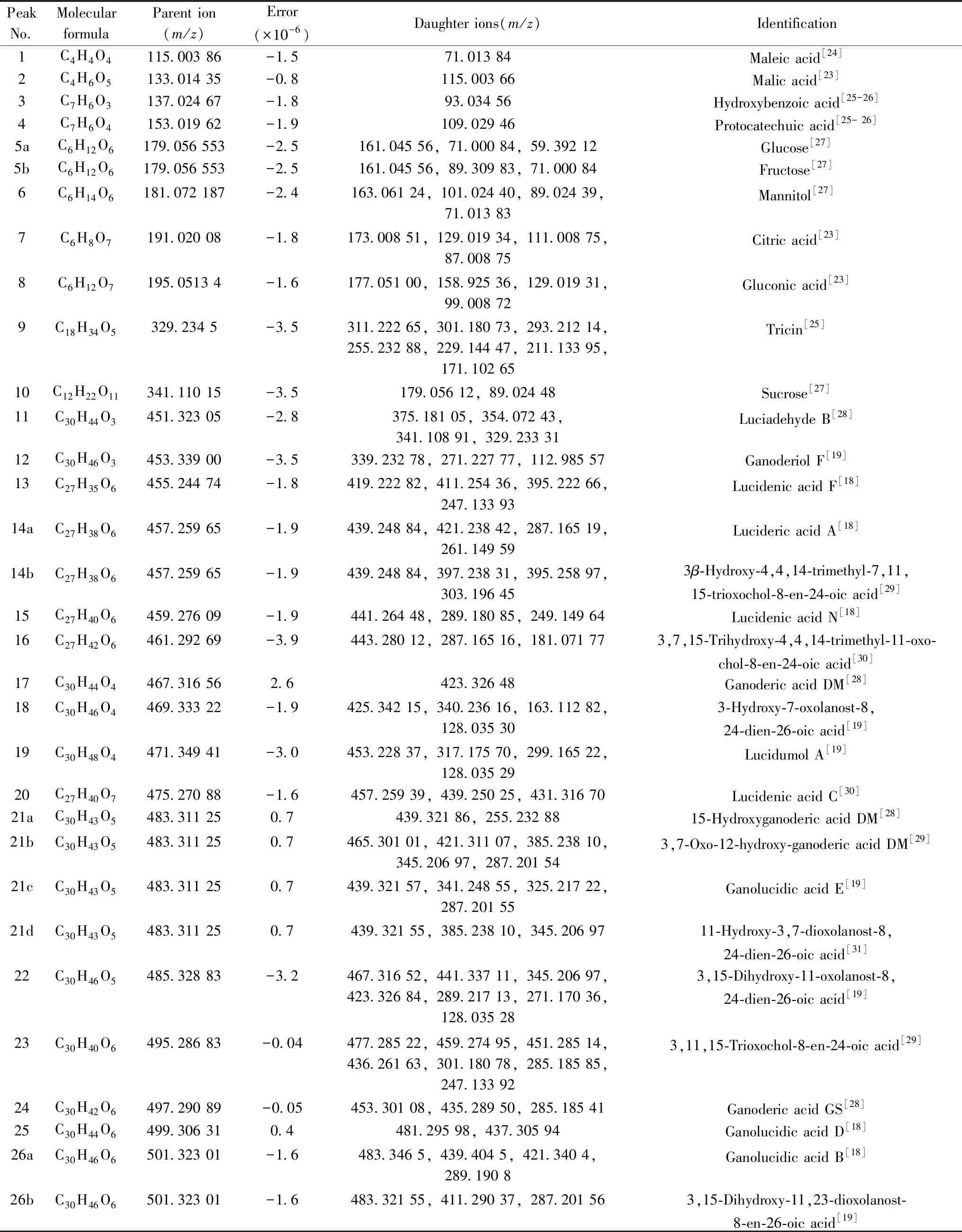
表2 赤灵芝成分的鉴定结果Table 2 Ingredient identification of Ganoderma lucidum
(续表2)

Peak No.Molecular formulaParent ion(m/z)Error(×10-6)Daughter ions(m/z)Identification27C30H38O7509.256 01-3.0491.243 40,467.316 46,461.196 74,447.253 86,432.230 43,417.206 93,299.165 17Ganoderenic acid F[19]28aC30H40O7511.271 50-2.7478.235 03,431.259 24,301.180 92,261.149 73,247.133 98Ganoderenic acid D[18]28bC30H40O7511.271 50-2.7493.259 32,449.269 61Ganoderic acid F[18]29aC30H40O7513.287 33-3.0451.286 05,436.261 75Ganoderic acid J[18]29bC30H40O7513.287 33-3.0495.275 09,451.285 25,436.261 180Ganoderic acid AM1[18]29cC30H40O7513.287 33-3.0495.275 09,451.285 25Ganoderic acid D[18]29dC30H40O7513.287 33-3.0495.275 09,451.285 25,329.175 70,303.196 55,287.201 61Ganoderenic acid B[29]30aC30H44O7515.300 990.8497.290 74,479.280 22Ganoderic acid A[18]30bC30H44O7515.300 990.8497.290 74,453.300 82,435.291 18Ganoderic acid δ[32]30cC30H44O7515.300 990.8497.290 74,453.300 823,7,15-Trihydroxy-11,23-dioxolanost-8,16-dien-26-oic acid[7]30dC30H44O7515.300 990.8498.294 03,454.304 21,304.199 90,287.165 24Ganoderic acid B[18]31aC30H46O7517.315 912.3499.306 62,481.295 98,455.316 51,437.305 89Ganoderic acid C2[18]31bC30H46O7517.315 912.3302.188 67Ganolucidic acid C[28]32aC30H40O8527.263 822.3509.254 30,465.264 57,317.175 73,301.180 56Elfvingic acid A[18]32bC30H40O8527.263 822.3509.254 30,465.264 57,301.180 5612-Hydroxy-3,7,11,15,23-pentaoxo lanost-8-en-26-oic acid[18]32cC30H40O8527.263 822.3509.254 30,483.274 89,465.264 57,317.175 733,12-Dihydroxy-4,4,14-trimethyl-7,11,15-trioxo-lanost-8,9,20,22-en-26-oic acid[18]33aC30H42O8529.281 60-1.7511.269 85,467.280 1212-Hydroxyganoderic acid D[18]33bC30H42O8529.281 60-1.7511.269 93,493.259 52,301.180 83,263.128 85Ganoderic acid D2[19]33cC30H42O8529.281 60-1.7511.269 93,467.280 10,437.233 19Ganoderic acid C6[18]34C30H44O8531.297 35-1.9513.285 56,469.295 81,454.272 41,436.263 27,301.180 89Ganoderic acid G[32]35aC30H46O8533.311 84-0.3515.289 87,485.291 0312-Hydroxyganoderic C2[19]35bC30H46O8533.311 84-0.3515.301 18,497.290 73,485.290 63,467.280 07,453.300 77,423.290 23,303.160 05,287.165 173,7,12,15-Tetraphydroxy-11,23-dioxolanost-8-en-26-oic acid[19,26]36C30H44O9547.292 77-2.8529.280 48,511.269 89,493.259 34,485.290 60,317.175 583,12,15,20-Tetraphydroxy-7,11,23-trioxolanost-8-en-26-oic acid[19]37C32H43O8555.296 210.2513.287 68,495.274 47Lucidenic acid GS-3[33]38C32H42O9569.277 14-2.7551.264 70,509.252 6812-Acetoxyganoderic acid F[18-19]39aC32H44O9571.292 87-2.8553.280 51,511.269 93,481.222 01Ganoderic acid H[18]39bC32H44O9571.292 87-2.8553.280 51,538.264 16,511.269 93,467.280 16Ganoderenic acid K[18]39cC32H44O9571.292 87-2.8551.264 82,509.254 27,465.264 4612-Acetoxyganoderic acid D[18]40C32H46O9573.306 500.7555.297 07,511.306 28,496.281 91Ganoderic acid K[18]41aC37H41O8613.280 590.2595.267 36,553.281 18,509.294 103-Acetylganoderic acid H[18]41bC37H41O8613.280 590.2595.267 36,553.281 183-Acetylganoderenic acid K[18]
2.4 聚类分析
为了区分不同产地的赤灵芝,实验采用统计学方法对16个样品进行分组。通过“距离”大小以获悉样品相似度情况,具体结果如图4所示。在95%的置信区间下,不同产地的样本均得到很好的区分,通过数据点的分离情况可知16批赤灵芝来源于4个不同的产地。如SD-1和SD-2均来自山东省;JL-1、JL-2、JL-3、JL-4、JL-5来自吉林省。结果表明,利用FTICR-MS检测赤灵芝的化学成分并通过聚类分析法有助于鉴别赤灵芝的来源,为评价药材来源提供了依据。
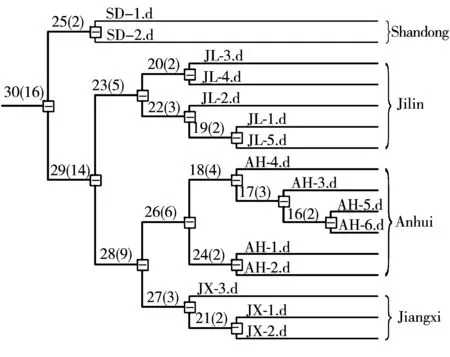
图4 16批赤灵芝样品的聚类分析结果Fig.4 Cluster analysis results of 16 Ganoderma lucidum samples
2.5 主成分分析
为了评价赤灵芝样品的质量和来源,采用化学计量主成分分析(PCA)方法,根据FTICR-MS获得的质谱数据对16批赤灵芝样品进行分类。在95%的置信区间下,根据PCA得分图和荷载图对样品进行区分,具体结果如图5所示。在图5A中,4个不同来源的数据点被清晰分离。结果表明,安徽和江西的赤灵芝均落在负相关区域,山东与吉林的赤灵芝处于正相关区域,因此安徽和江西的赤灵芝样本相似,且不同于山东与吉林的样品,这可能是由地理区域、气候变化、生态环境的综合影响所致。具体影响得分结果的化学成分见图5B,影响得分的因素分别用PC1和PC2表示。由图5B,根据各个成分(质荷比)的偏离程度,主要影响得分结果的质荷比分别有:m/z133.01(苹果酸)、128.05(Unkonwn)、191.05(柠檬酸)、515.35(Ganoderic acid A、ganoderic acidδ、3,7,15-trihydroxy-11,23-dioxolanost-8,16-dien-26-oic acid)、513.25(Ganoderic acid J、ganoderic acid AM1、ganoderic acid D、ganoderenic acid B)、531.30(Ganoderic acid G)、613.25(3-Acetylganoderic acid H、3-acetylganoderenic acid K)。这些成分与赤灵芝的质量控制呈较强的正相关关系,其中赤灵芝的小分子有机酸m/z133.01、128.05、191.05与PC1密切相关;同样,m/z513.25、515.35、531.30和613.25是与PC2密切相关的三萜化合物。该结果指出的小分子有机酸和三萜类化合物与现代医学治疗疾病的有效化合物相一致。这些化合物之间的相关性在PCA图中得到了明显的体现,因此,这些化合物是全面评估赤灵芝质量的潜在成分。
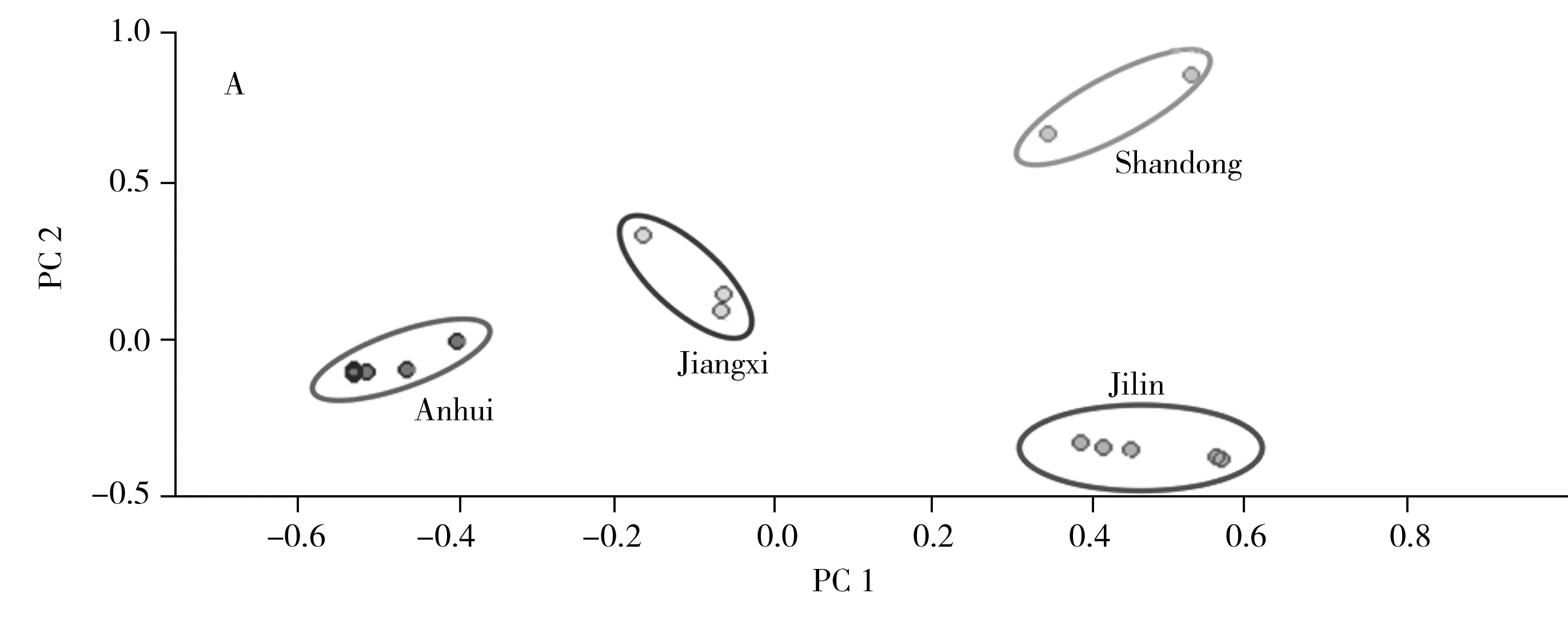
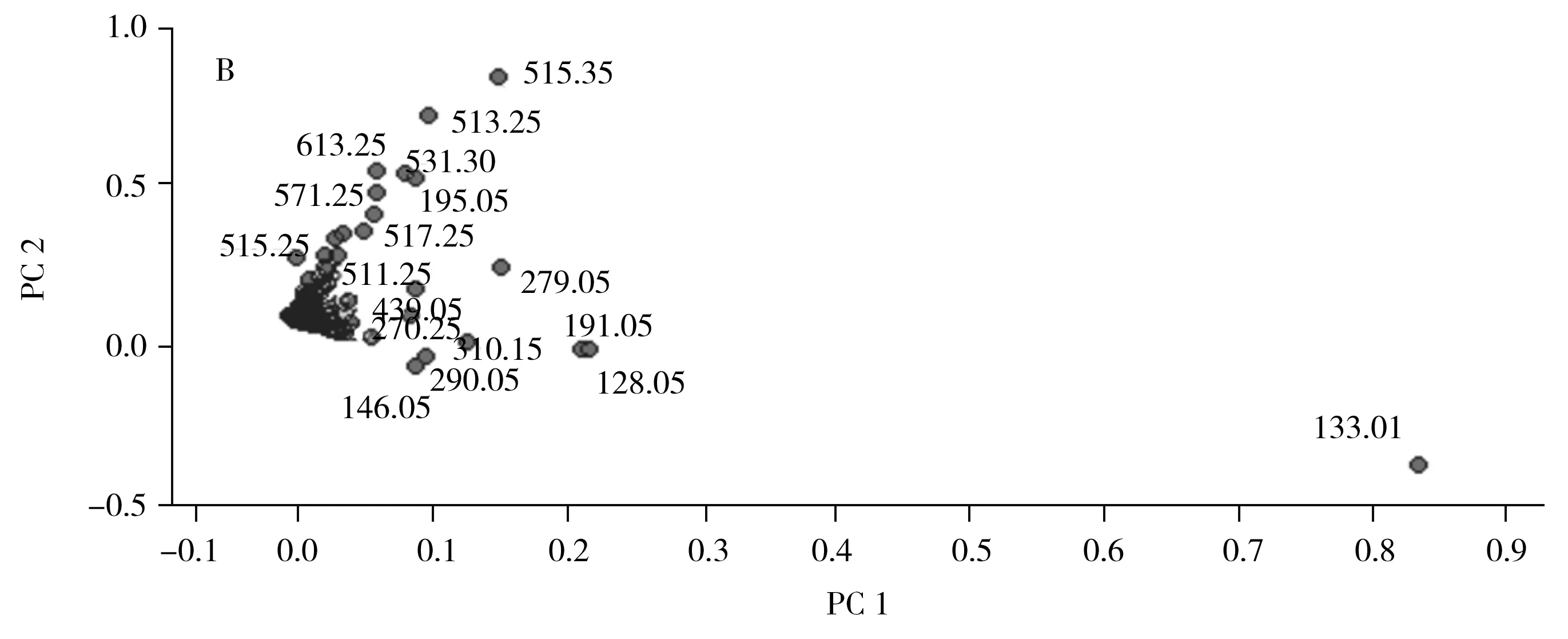
图5 16批赤灵芝样品的主成分分析结果Fig.5 Principal component analysis(PCA) of 16 Ganoderma lucidum samplesA.scores plot;B.loading plot
3 结 论
本研究建立了一种基于FTICR-MS的赤灵芝化学成分快速鉴定和指纹图谱分析方法,结合一级、二级质谱数据与相关文献的报道共鉴定出赤灵芝中63种化学成分,包括1种萜烯醛、3种糖、4种三萜醇、6种有机酸和49种三萜酸类成分。采用聚类分析、主成分分析等统计学方法对不同产地的赤灵芝样品进行来源分析,得到了较好的来源区分结果。PCA结果显示不同产地来源的赤灵芝存在一定的差异性,其差异与有机酸、三萜酸类化合物相关,这些化合物可作为评估赤灵芝质量稳定性和一致性的标记物。研究结果表明,FTICR-MS可直接、快速、高效地实现赤灵芝的化学成分鉴定和指纹图谱研究,在中药分析和质量控制领域有广阔的应用前景。
