电致发光细胞传感器及其分析应用
2019-05-22陈成炽李金花杨培慧
周 凡,姚 政,陈成炽,李金花,杨培慧*
(1.暨南大学 化学与材料学院,广东 广州 510632;2.暨南大学 第一附属医院,广东 广州 510632)
细胞传感器是21世纪迅速发展的一种生物检测技术,成为生物传感器领域的一大研究热点[1]。它通过将细胞固定在传感界面作为识别元件或研究对象,使其与电极或其他信号元件组合,从而对被分析物的性质和功能进行分析研究,在生物医学、食品安全和药物筛选等领域有着广阔的应用前景[2]。细胞传感器具有实时、动态、特异性高、分析简便快速等特点,克服了传统免疫化学和核酸等检测方法费时、操作复杂且不安全等不足,它与电致发光技术结合所构建的电致发光细胞传感器目前成为了生命科学领域的研究热点。
电致发光(Electrogenerated chemiluminescence,ECL)或电化学发光是一种由电化学反应引起的发光现象,对电极施加给定电压使电极表面发生反应,产生的电生物质彼此之间或与体系中某些组分经过电子传递作用形成激发态,然后以辐射光子的形式回到基态[3]。一方面,它是化学发光和电化学结合的产物,兼具两者的优点(如灵敏度高、动力学范围宽、操作简单等)[4]。另一方面,ECL作为一种发光技术,相对于其他发光方法具有独特优势。与光谱学分析法相比,ECL无需借助外来光源激发,降低了背景噪声;与化学发光法相比,它可以通过定向修饰电极提高选择性。近年来,ECL技术在肿瘤细胞浓度检测、细胞表面或内部生物分子分析、细胞凋亡以及其它细胞功能监测、单细胞分析等方面展现了独特优势,结合纳米材料和分析设备的设计及应用,促进了ECL细胞传感器的进一步发展。本文将简要介绍电致发光探针,并结合本课题组的研究工作和近年来的文献论述电致发光细胞传感器在肿瘤细胞定量分析、肿瘤标志物分析、单细胞分析和细胞功能分析等方面的应用。
1 电致发光探针
目前已报道的电致发光体系有很多种,根据发光试剂的差异性可分为以下3类[5]:无机金属配合物、有机化合物和纳米材料等。无机金属配合物主要包含钌配合物和铱配合物等;有机化合物主要包括鲁米诺类、吖啶类以及多环芳烃类等;近年来,纳米材料发光体(如半导体纳米晶体、贵金属纳米簇和碳纳米材料)作为新型的ECL体系也得到了迅速发展。
1.1 三联吡啶钌
1.2 鲁米诺
鲁米诺(Luminol)作为化学发光免疫分析领域中常用的发光试剂,具有电化学发光性质以及发光量子产率较高、激发电位低、试剂便宜、毒性小等优点,已被应用于电致发光生物传感领域。其电致发光机理主要分为阴极和阳极电致发光[10];鲁米诺阴极ECL的产生通常涉及电化学还原溶解氧生成活性氧的过程,由于鲁米诺在负电位下不能在电极上氧化,其ECL信号非常弱;鲁米诺阳极ECL是以H2O2作为共反应剂在碱性溶液中进行,发光机理为Luminol先解离成阴离子并进行电化学氧化,与H2O2电氧化生成的过氧化氢自由基或超氧阴离子进一步反应形成激发态分子3-氨基邻苯二甲酸盐,之后返回至基态产生发光信号。Shi等[11]通过DNA双链组装AuNPs,既作为Luminol/H2O2反应的催化剂,又作为阳极溶解探针Ag化学还原的种子,利用Ag@Au猝灭Luminol的ECL发射及信号恢复来反映阳极溶解程度,通过监测细胞在阴极上孵育前后的ECL恢复时间来定量分析肿瘤细胞。Zuo等[12]采用Luminol电致发光法同时测定单个细胞质膜中活性胆固醇和非活性胆固醇的含量。Ge等[13]设计了一种由封闭双极电极组成的纸质分析装置,基于Luminol产生的ECL信号与细胞释放出的H2O2量成正比来检测MCF-7乳腺癌细胞。
1.3 纳米材料
1.3.1 量子点量子点(Quantum dots,QDs)由于量子产率高、抗光漂白稳定性好以及发光具有尺寸依赖性,近年来将其作为ECL发光探针受到广泛关注。在QDs-ECL过程中,电极表面产生的物质涉及高能电子传递反应,并形成发光激发态,主要有两种发光机制[14]:湮灭型和共反应剂型。湮灭型ECL要求自由基QDs在与相反电荷的QDs发生碰撞时,需具备一定的化学稳定性和长期保持其带电状态等条件来转移电荷,此外所施加的电位必须足够保证电极表面同时产生带正、负电荷的QDs。共反应剂型ECL涉及发光体与共反应剂在电极上进行单向电位扫描反应,根据电极表面氧化和还原过程分为氧化-还原反应和还原-氧化反应,常用共反应剂有亚硫酸盐、草酸盐、过硫酸盐以及溶解氧等。共反应剂的引入克服了溶剂电势限制并产生了比湮灭反应更强的ECL信号,被广泛应用于生物传感器构建。Jie等[15]利用AuNPs上的多支链DNA杂交链反应制备了一种基于CdSe/ZnSQDs的信号放大的电致发光探针,用于检测肿瘤细胞。Ding等[16]以CdTeQDs和Luminol为双发光体,构建了双模态ECL系统用于MCF-7细胞的检测。
1.3.2 碳纳米材料近年来,碳纳米材料尤其是碳纳米点(CNDs)、石墨烯量子点(GQDs)和石墨碳氮化物(g-C3N4)成为一种新型ECL发光体。CNDs是尺寸小于10 nm的球形点,由以sp2碳为主的无定形或结晶的核和带有含氧基团的氧化碳壳层组成[17];GQDs是一种厚度介于3~20 nm之间的石墨烯纳米薄片,其晶体网格由碳原子组成,呈蜂窝状排列[18];g-C3N4尺寸约为数百纳米,为二维材料,由于C和N的sp2杂化而具有p-共轭石墨晶面结构[19]。碳纳米材料的ECL发光行为类似于量子点,其优越性在于无毒、成本低,具有良好的导电性、化学和光稳定性,因此被认为在生物分析领域极具应用前景。Liu等[20]在纸工作电极上生长Au纳米花用于固定抗体以捕获MCF-7细胞,负载于Au纳米笼表面的GQDs作为ECL探针,构建夹心式细胞传感器检测MCF-7细胞表面的乳腺癌特异性标志物CA153。Xu等[21]将C3N4QDs/g-C3N4纳米片复合材料与二茂铁标记的适配体偶联导致ECL信号猝灭,引入目标物血小板衍生生长因子BB(PDGF-BB)使其信号恢复,用于定量测定PDGF-BB。
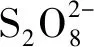
2 电致发光细胞传感器及其应用
2.1 肿瘤细胞定量分析
癌症是当前危害人类健康的重大疾病,对肿瘤细胞进行准确、灵敏的检测对于该疾病的诊断和治疗具有重要意义。ECL分析法由于背景值低、成本低且操作简单而日益受到关注,目前,基于ECL技术的各种分析方法[25]被广泛用于肿瘤细胞定量分析,如共振能量转移,利用生物识别反应产生的空间位阻降低信号,产生或消耗共反应剂影响ECL发射强度,通过电子转移方式减弱或增强ECL性能等。

图1 选择性检测肿瘤细胞和细胞表面聚糖的ECL生物传感器结构[26]Fig.1 Configuration of ECL biosensor for selective detection of cancer cell and cell surface carbohydrate profiling[26]
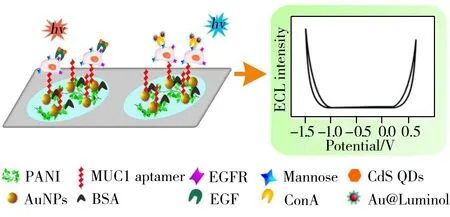
图2 双电化学发光信号示意图[43]Fig.2 Schematic illustration of the dual electrochemiluminescence signal system[43]
2.2 肿瘤标志物分析
肿瘤标志物存在于肿瘤细胞发生、发展过程中,由机体与肿瘤细胞相互作用产生或由肿瘤细胞直接合成、分泌,是一种正常细胞中含量很低或不存在的具有生物活性的特异性物质[35]。按照其自身性质可分为胚胎类抗原、糖类糖蛋白抗原、酶及蛋白类、激素类和循环核酸类。与正常生命体相比,肿瘤患者体内与肿瘤相关的标志物表达异常,因此,对肿瘤标志物进行检测在肿瘤预防、早期诊断、指导治疗和预后判断等方面具有重要作用[36]。
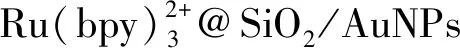
通常,细胞表面会表达一些与疾病相关的生物分子,通过对细胞表面多种标志物进行检测,有助于提高对疾病早期诊断的精准率。Su等[41]采用大孔金纸工作电极,以AuPd纳米粒子为信号放大器,CdTeQDs和Luminol作为ECL探针与α-甲胎蛋白和CEA的抗体连接,双探针发出的ECL信号被限制在有限的电位窗口内,从而实现对MCF-7细胞表面对应抗原的同时检测。Lü等[42]在CNNS(碳氮纳米板)-AuNPs 和S-CNNS(含硫碳氮纳米板)-AuNPs固定的电极上分别组装CA19-9抗体和间皮素(MSLN)抗体,构建波长分辨的多路复用ECL生物传感器,在电极界面同时检测了胰腺癌生物标志物CA19-9和MSLN。Yang等[43]采用PANI电聚合修饰氧化铟锡(ITO)电极上的两个空间分辨区,并在其表面加入AuNPs,增强传感界面的导电性和稳定性,将MUC1适配体固定在AuNPs上,捕获MUC1阳性的MCF-7细胞,Au@Luminol和CdSQDs组合使用以构建在正、负电位(+0.5 V和-1.2 V)同时发光的双信号探针,与Con A和EGF共价连接,用于检测MCF-7细胞表面过表达的甘露糖(Mannose)和EGFR,对细胞检测范围为102~1.0×106cells/mL,检测限为20 cells/mL,每个细胞表面Mannose和EGFR的平均表达量分别为1.2×106、0.86×105(如图2)。在此基础上,Yang等[44-45]利用CQDs、CdSQDs和Luminol构建电位可分辨的高灵敏电致发光探针,分别标记二抗,采用夹心式检测模式对结核病生物标志物IFN-γ、IL-2和TNF-α抗原分子进行多组分同时检测,其检出限为1.6 pg/mL,从而构建了一种可同时检测多组分标志物的ECL新方法。
2.3 单细胞分析
细胞存在个体差异性即异质性,这会造成细胞在化学组成、生物活性以及生理响应等方面各有不同。可见,在单细胞水平上进行研究能使人们更好地了解细胞异质性及其功能差异性,为探究重大疾病发病机理、发展和治疗提供更为可靠的科学依据[46]。
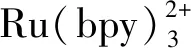
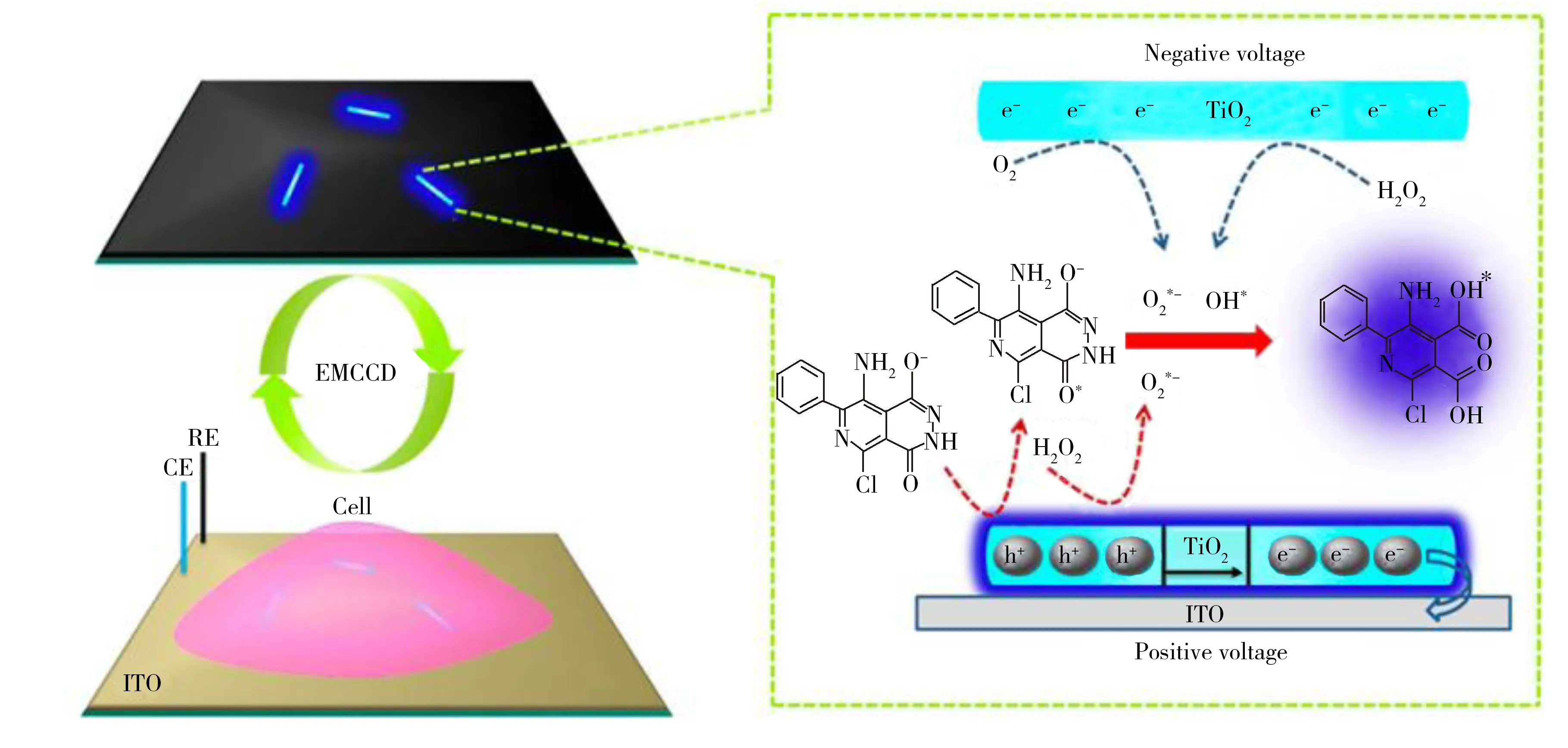
图3 用于观察单细胞局部过氧化氢流出的单个TiO2纳米颗粒ECL传感技术原理图[48]Fig.3 Schematic process of the ECL sensing of single TiO2 nanoparticles for visualizing local hydrogen peroxide efflux from single cells[48]
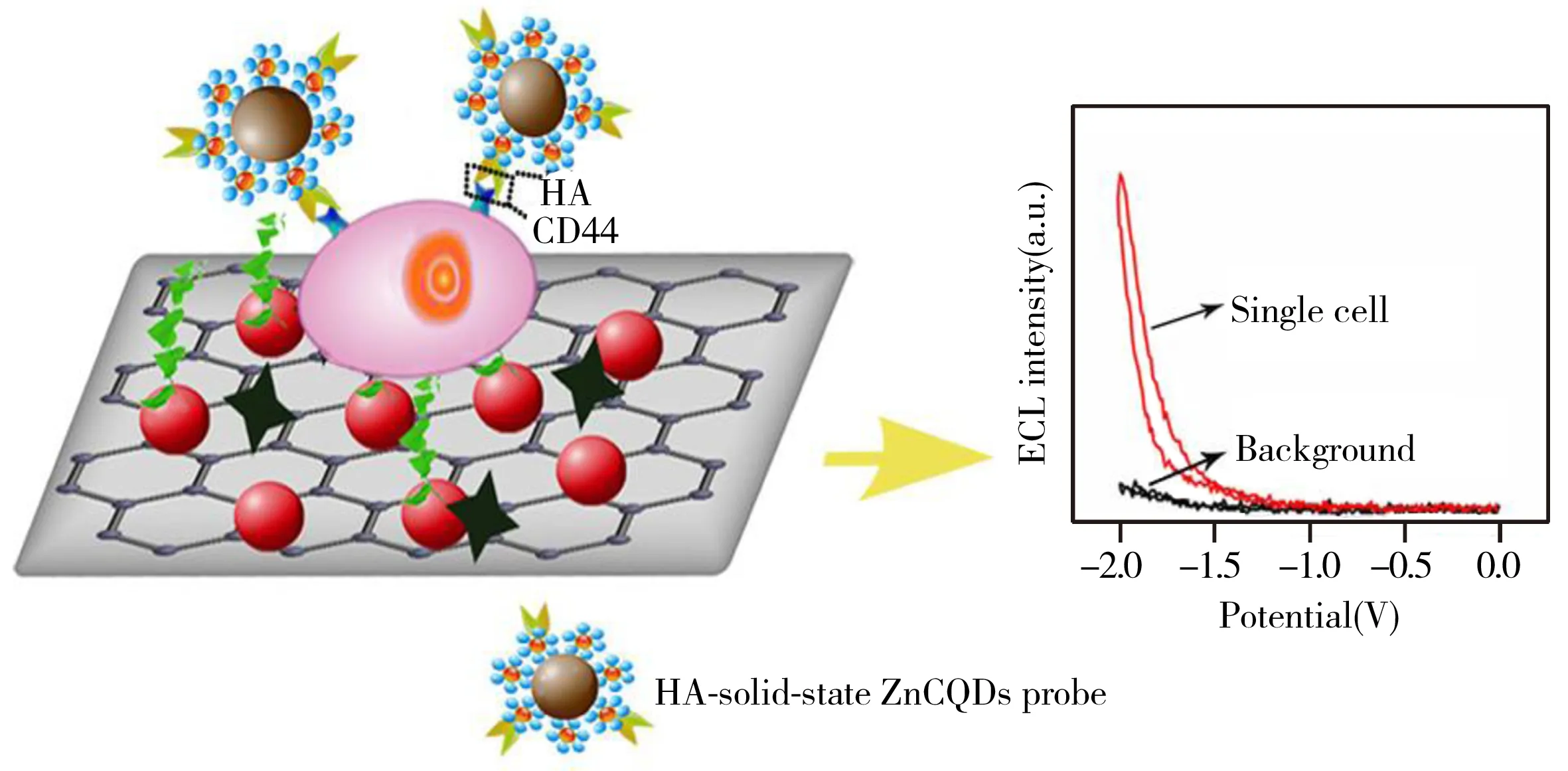
图4 单细胞分析平台示意图[52]Fig.4 Schematic illustration of the proposed single-cell analysis platform[52]
Yang等[52]报道了一种新型的单细胞传感分析平台,将锌共吸附碳量子点(ZnCQDs)附着在AuNPs上,并以磁珠负载合成MB@ZnCQDs/AuNPs多重信号放大的固态电致发光探针,其信号较水溶性CQDs放大120倍,在该探针上修饰透明质酸(HA)用于识别单个乳腺癌细胞表面CD44分子以及检测MCF-7和MDA-MB-231细胞,结果显示在1~12和1~18个细胞范围内具有较好的线性关系,MDA-MB-231细胞表面CD44分子的表达量明显比MCF-7细胞高且在同种细胞株中单个细胞表面存在差异性(如图4)。由于细胞与传感界面的接触会降低探针标记的有效空间,影响单细胞传感器的分析准确性。为此,Yang等[53]提出了悬空模式单细胞传感器,采用不同碳链长度的巯基酸(MA-Cx)来调控ITO/AuNPs/PANI电极界面与单细胞之间的距离,HA功能化的Au@Cu-PbCQDs被用作ECL和DPV(示差脉冲法)双功能探针,与MCF-7细胞表面CD44分子特异性识别,结果表明,MA-C11构建的单细胞传感器可获得最强的ECL信号,较未修饰MA的传感器提高了(37.5±3.9)%。
2.4 细胞功能分析
细胞是生命体的最小单位,是人们研究生物体内外过程的一个窗口。通常,细胞内或表面成分的改变会引起细胞本身乃至机体的变化,因此对其进行监测或检测显得尤为重要。
Liang等[54]在钌配合物与二氧化硅的复合纳米颗粒上修饰膜联蛋白V,用于标记MDA-MB-231乳癌细胞上的磷脂酰丝氨酸(PS),通过电极上负载AuNPs并连接Con A捕获细胞,研究了紫杉醇诱导细胞凋亡的效率,结果表明,ECL强度随药物浓度的增加而增加,线性范围为1~200 nmol/L,检测限为0.3 nmol/L。Wu等[55]在纤维素上生长Au@Pd纳米颗粒制备了Au@Pd纸电极,MCF-7细胞的适配体固定在纸电极上,PtNi@CNDs复合物用作ECL探针,与Con A连接后特异性识别细胞表面的甘露糖,通过监测不同药物刺激下MCF-7细胞的凋亡情况进而实现抗癌药物的原位筛选。Wang等[56]利用L012作为ECL发光探针,通过含水磷脂酶D水解膜磷脂酰丝氨酸(PS)形成丝氨酸,在L-氨基酸氧化酶作用下产生H2O2,诱导电致发光对单个细胞凋亡过程中PS的变化进行监测。Jiang等[57]将三维聚苯胺-植酸导电水凝胶(PANI-PA)固定在GCE上以粘附活细胞,AgNPs修饰的N-(氨基丁基)-N-(乙基异鲁米诺)作为发光探针附着于PANI-PA表面,在药物刺激下原位释放的H2O2增强了电致发光信号从而对其进行检测。
Yang等[58]将L-半胱氨酸包覆的 CdSQDs固定在聚苯胺纳米纤维(PANI-NF)修饰的GCE上,进一步在其表面修饰膜联蛋白V特异性识别细胞表面PS,基于早期凋亡细胞膜表面PS的含量增加导致细胞与传感器表面的相互作用增强,利用白藜芦醇诱导HepG2细胞早期凋亡,构建了用于早期凋亡特异性检测的无标签ECL细胞传感器;Yang等[59]在GCE表面固定氧化石墨烯和聚苯胺纳米复合物进而附着AuNPs包覆的磁珠用于固定一抗Ab1,以修饰二抗Ab2的CdSQDs作ECL探针,检测药物刺激下细胞分泌的干扰素IFN-γ,线性范围为0.1~500 pg/mL,最低检测限为30 fg/mL。Yang等[60]基于锌共吸附碳量子点,以AuNPs为核、AgNPs为桥梁合成了核壳双层结构纳米探针,构建单细胞传感器用于研究氧化损伤的人脐静脉内皮细胞(HUVEC)与血小板的粘附,用抗体修饰探针标记受损HUVEC过表达粘附分子E选择素,当活化血小板表面的糖蛋白与HUVEC表面的粘附分子作用,ECL信号随粘附血小板数量的增多而下降,其线性范围在1~15个血小板之间,用抑制剂处理内皮细胞,其表面粘附分子表达下调,血小板与HUVEC的粘附下降,据此建立了一种可有效动态监测血小板与内皮细胞之间粘附的新方法。
3 结论与展望
近年来,电致发光细胞传感器在生物分析领域展现了明显的优势和潜力,然而,电致发光探针的数目和种类有限,多功能传感器的构建仍面临挑战。因此,发展灵敏度高、检测信号稳定、信号可分辨、实时监测的电致发光细胞传感器在多组分检测、单细胞分析以及细胞功能研究等方面具有广阔的应用前景。电致发光细胞传感器将在生理病理研究以及药物筛选等领域发挥重要作用。
