刚果红阳性的纤维性肾小球肾炎
2019-05-22梁少姗曾彩虹
梁少姗 杨 帆 曾彩虹
现病史22岁女性患者,因“水肿、蛋白尿、血清肌酐(SCr)升高1月余”于2018-11-28入院。
患者于2018年10月上旬孕1月余无明显诱因出现颜面部水肿,血压偏高140~160/80 mmHg左右,10月24日查尿蛋白定量7.49 g/24h,尿红细胞2 500万/ml(多形型),SCr 134.0 μmol/L,血白蛋白15.6 g/L,血钾 7.15 mmol/L,二氧化碳18 mmol/L,血红蛋白(Hb) 107 g/L,双肾超声未见异常,心电图、心脏超声未见异常,予补充白蛋白、利尿、降钾等治疗,复测血钾 4.36 mmol/L,SCr 175.6 μmol/L,10月27日予终止妊娠并行清宫术,10月29日查尿蛋白+++,尿沉渣红细胞3 200万/ml,Hb 90 g/L,行肾活检示”膜增生性肾小球肾炎”,弥漫系膜细胞、内皮细胞增生,局灶节段足细胞增生,细胞性新月体(3/19),球性肾小球硬化(1/19),肾小球萎缩/间质纤维化(10%),免疫荧光示IgG+/-,IgA+,IgM++,C3++,C1q+,纤维蛋白原-,颗粒状沉积于毛细血管袢及系膜区,予甲泼尼龙(MP)500 mg×6d后续MP 40 mg×13d治疗,11月12日复查SCr 139 μmol/L。11月21日于国家肾脏疾病临床医学研究中心查尿蛋白++++,尿红细胞1 097.9/μl(非均一性),血清白蛋白18.8 g/L,SCr 168.8 μmol/L,尿素氮11.7 mmol/L,尿酸557 μmol/L,补体C3偏低0.691 g/L,C4正常,予泼尼松30 mg/d等口服。门诊拟“膜增生性肾小球肾炎”收入院。患者起病以来精神尚可,体力、食欲、睡眠正常,体重无明显变化,大小便及排尿正常,无夜尿增多,恶露已结束。
既往史、个人史无特殊。
婚育史月经史无特殊,已婚,配偶健康状况良好,足月产0-早产0-流产1-存活0。
家族史父母及1姐1弟体健,家族中无传染病及遗传病史。
体格检查体温36.3℃,脉搏88次/min,呼吸16次/min,血压158/108 mmHg,体质量指数(BMI) 30.1 kg/m2,眼睑水肿,心肺腹部查体未及明显异常,双下肢轻度水肿。
实验室检查
尿液 尿蛋白8.64 g/24h,尿量1 730 ml,尿沉渣红细胞770.5/μl(多形型);尿α2-MG 168.5 mg/L,尿C3 133 mg/L;NAG 43.8 U/(g·Cr),RBP 44.3 mg/L,尿渗量512 mOsm/(kg·H2O)。
血常规 血红蛋白96 g/L,网织红细胞计数85.9×109/L,网织红细胞百分比2.58%,白细胞8.6×109/L,血小板368×109/L。
血生化 白蛋白20.20 g/L,球蛋白13.1 g/L,肌酐182.1 μmol/L,胱抑素C 2.50 mg/L,尿素氮9.6 mmol/L,尿酸361 μmol/L,总胆固醇6.78 mmol/L,三酰甘油1.89 mmol/L,高密度脂蛋白胆固醇1.57 mmol/L,低密度脂蛋白胆固醇4.57 mmol/L,谷丙转氨酶,谷草转氨酶,直接胆红素,间接胆红素均正常,钙1.90 mmol/L,磷1.54 mmol/L,其余电解质正常,乳酸脱氢酶413 U/L、磷酸肌酸激酶101.0 U/L,铁7.00 μmol/L、总铁结合力17.0 μmol/L、不饱和铁结合力10.0 μmol/L。空腹血糖5.89 mmol/L,餐后2h血糖4.8 mmol/L。eGFR 33 ml/(min·1.73m2)(EPI公式计算)。血β2-微球蛋白7.86 mg/L(0.9~2.7 mg/L),脑利钠肽前体141.1 pmol/L(< 53.1 pmol/L)。
免疫学 ANA、A-dsDNA、ENA多肽抗体谱阴性,系统性红斑狼疮抗凝因子1.31,复查1.19(正常参考值1.20),抗心磷脂抗体、抗β2糖蛋白1抗体阴性。MPO、PR3-ANCA、抗GBM抗体阴性,冷球蛋白31.34 μg/ml。补体C3 0.574 g/L,C4 0.225 g/L,IgG 3.56 g/L,IgA、IgM正常,IgE 337 IU/ml,抗“O”、类风湿因子正常。血游离轻链κ 23.4 mg/L、λ 44.4 mg/L、κ/λ 0.53,免疫固定电泳未见明显异常单克隆免疫球蛋白条带。溶血检查:血清结合珠蛋白测定247.3 ng/L(30~702 ng/L)、血清酸化溶血试验阴性、直接及间接抗人球蛋白试验阴性、游离血红蛋白测定168.9 mg/L(0~300 mg/L)。
其他 乙型肝炎病毒表面抗体、丙型肝炎病毒IgG抗体、抗艾滋病病毒抗体、抗梅毒螺旋体抗体均阴性。
辅助检查
心电图 正常。
胸部CT 右肺上叶及两肺下叶炎症,右肺中叶及两肺下叶小结节;心包少量积液;双侧胸腔少量积液。
超声检查 左肾128 mm×62 mm×64 mm,右肾127 mm×49 mm×63 mm,双肾体积偏大,皮质回声稍增强,轮廓规则,包膜连续完整,双肾内未见肾盂肾盏扩张。肝胆胰脾、门静脉及双侧颈动脉、颈静脉、双上肢、双下肢血管超声未见明显异常。
骨髓细胞学检查 增生性贫血骨髓象。
肾活检病理
光镜 皮质肾组织2条。30个肾小球中4个球性废弃,3个纤维细胞性新月体。余正切肾小球体积增大,系膜区中~重度增宽,毛细血管袢开放尚可,增宽的系膜区及外周袢被大量HE略淡染、磨玻璃状、PAS弱阳性无定形物质占据(图1A),节段内皮细胞成对,单个核细胞浸润1~8个/球,偶见中性粒细胞浸润,囊壁节段增厚、分层。PASM-Masson:肾小球系膜区、内皮下较多不嗜银物质沉积,不嗜银的沉积物与嗜银的胶原性基质混杂导致增宽的系膜区、增厚的毛细血管壁可见“虫蚀样”改变,节段基膜分层(图1B)。肾小管间质重度急性病变(70%)及轻度慢性病变(10%),斑片状小管上皮细胞刷状缘脱落,灶性小管萎缩、基膜增厚,管腔内见蛋白管型及脱落的小管上皮细胞,间质散在单个核细胞浸润,数处灶性泡沫细胞,间质小灶性纤维化。小叶间动脉节段内膜增厚。
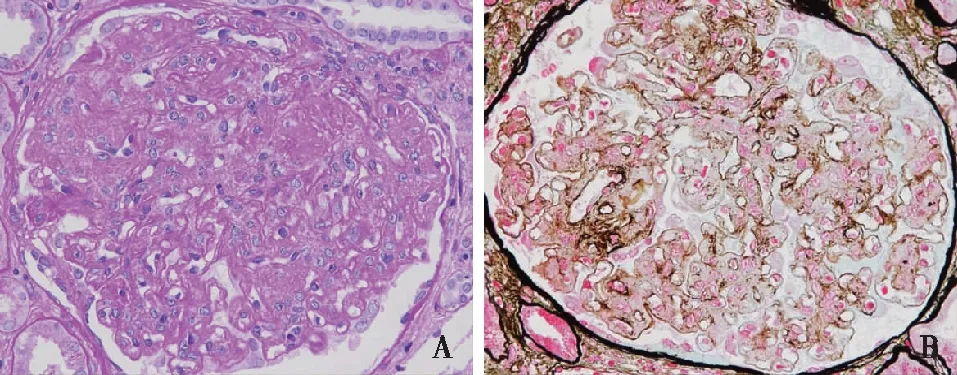
图1 A:肾小球系膜区中~重度增宽,增宽的系膜区及外周袢被大量PAS弱阳性无定形物质占据,袢腔内少量炎细胞浸润(PAS,×400);B:肾小球系膜区、内皮下较多不嗜银物质沉积,节段基膜分层(PASM-Masson,×400)
肾组织刚果红染色示肾小球系膜区及血管袢大量弱橘红染物质(图2A),偏振光下见苹果绿双折光(图2B)。

图2 肾小球系膜区及血管袢大量弱橘红染物质(A),偏振光下具有苹果绿双折光(B);AL型淀粉样变性患者:肾小球系膜区及血管袢大量、动脉壁及间质亦见橘红染物质(C),偏振光下具有苹果绿双折光(D);刚果红阴性的纤维性肾小球肾炎患者:未见橘红染物质(E),偏振光下无苹果绿双折光(F)(刚果红,×400)
免疫荧光 肾小球IgG++、IgM+、C3+++、C1q+,呈颗粒状弥漫分布于血管袢和系膜区。IgA阴性。小管基膜、血管壁未见免疫复合物、补体沉积。IgG1++(图3A)、IgG2+、IgG3 trace、IgG4++(图3B),κ轻链++(图3C)、λ轻链++(图3D),呈颗粒状弥漫分布于系膜区及血管袢。其他淀粉样物质A蛋白、载脂蛋白A(ApoA)-I、纤维蛋白原、溶菌酶(Lys)、β蛋白前体(βPP)、甲状腺激素结合蛋白(TTR),β2-微球蛋白、白细胞衍生趋化因子2(LECT2)均阴性。胶原Ⅲ及纤维连接蛋白染色阴性。ApoE+呈颗粒状弥漫分布于系膜区及血管袢(图4A)。
免疫组化 DNAJB9强阳性,弥漫分布于肾小球系膜区及血管袢,少量分布于动脉壁(图4B),AL型淀粉样变性(对照病例)阴性。
电镜 观察1个肾小球。肾小球系膜区显著增宽,基质增多,低倍镜下系膜区、系膜旁区大量电子致密物沉积(图5A),电子致密物密度不均一,高倍镜下为排列紊乱的细纤维丝,直径14~27 nm(图5B),亦少量见于血管袢基膜内皮下及上皮侧。增宽的系膜区挤压袢腔,致袢腔狭小,毛细血管袢腔内偶见中性粒细胞浸润。肾小球足细胞足突广泛融合>90%,少量微绒毛化。
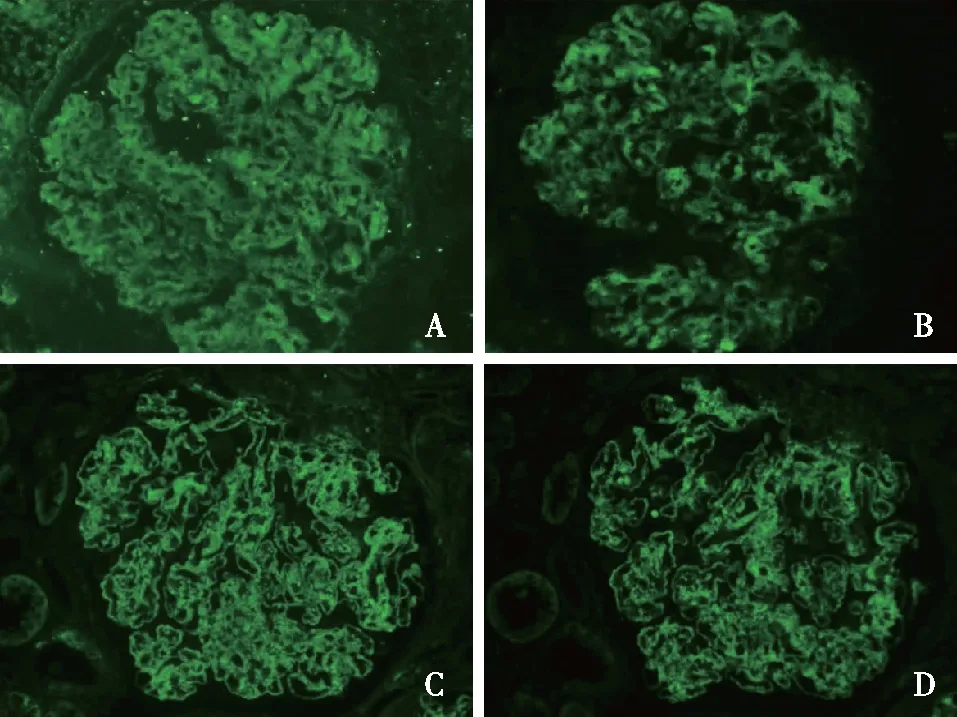
图3 免疫荧光染色IgG1++(A)、IgG4++(B),κ轻链++(C)、λ轻链++(D),呈颗粒状弥漫分布于肾小球系膜区及血管袢(IF,×400)

图4 A:ApoE+,呈颗粒状弥漫分布于肾小球系膜区及血管袢(IF,×400);B:DNAJB9强阳性,弥漫分布于肾小球系膜区及血管袢,少量分布于动脉壁(IH,×200)

图5 A:肾小球系膜区大量、基膜内皮下和上皮侧少量密度不均匀的电子致密物沉积;B:高倍镜下为排列紊乱的细纤维丝,直径14~27 nm,(EM)
初步诊断纤维性肾小球肾炎。
讨 论
青年女性,病程1月余,临床表现为颜面部及双下肢水肿,血压偏高,大量蛋白尿、大量镜下血尿,低蛋白血症,SCr升高,补体C3偏低。肾活检组织形态学显示,光镜下肾小球增宽的系膜区及外周袢被大量HE略淡染、PAS弱阳性无定形物质占据,不嗜银的沉积物与嗜银的胶原性基质混杂导致增宽的系膜区、增厚的毛细血管壁可见“虫蚀样”改变;免疫荧光肾小球IgG多克隆及κ、λ轻链阳性;超微结构观察肾小球内见排列紊乱、直径14~27 nm的纤维丝沉积,电镜下未见中空微管状结构。符合纤维性肾小球肾炎(fibrillary glomerulonephritis,FGN)的病理特点[1]。
为进一步鉴别诊断,行肾组织刚果红染色发现肾小球内沉积物呈弱阳性,而以往认为FGN刚果红染色应该是阴性,因此对该患者诊断为FGN产生质疑。众所周知,刚果红阳性是诊断淀粉样变性(amylodosis,AMY)的金标准[2]。但本例患者的纤维丝直径较淀粉丝粗,虽然肾小球沉积物不嗜银,且HE和PAS淡染,但不是淀粉样变性的均质性沉积物,明显不符合经典AMY。此外本例患者只累及肾小球,并未累及肾间质、动脉等,且肾小球为多克隆IgG、轻链κ、λ均阳性,也不符合AL、AH、AHL型淀粉样变性。为排除其他淀粉样变性,进一步行淀粉前体物质染色,包括A蛋白、遗传性AMY(ApoA-I、纤维蛋白原、Lys、βPP、TTR),β2微球蛋白、LECT2等染色均无阳性发现。
由于诊断出现冲突,查阅文献发现2018年Alexander等[3]报道了一组刚果红染色阳性,经质谱分析证实为FGN的病例。这组患者的临床病理特点:(1)以老年男性为主,平均蛋白尿定量7 g/24h,蛋白尿、肾病综合征、血尿和慢性肾功能不全分别为100%、47%、78%和83%,补体C3、C4均正常,无肾外AMY证据,随访23月,31%患者进入终末期肾病,余仍为慢性肾功能不全及持续蛋白尿。与刚果红阴性的FGN相比,刚果红阳性的FGN的男性以及合并单克隆免疫球蛋白血症比例更高。(2)肾脏病理表现为刚果红染色阳性强弱不等。光镜下表现为肾小球沉积物HE下磨玻璃状嗜伊红,PAS不同程度阳性,71%的病例不嗜银、余病例弱嗜银。肾小球表现为系膜细胞增生性病变(56%)、不伴系膜细胞增殖的系膜增生性病变(22%)及膜增生性病变(22%)。1例可见新月体形成。免疫病理IgG均阳性,除1例单一κ轻链沉积外,其余均为κ及λ沉积。电镜下肾小球系膜区(100%)、肾小球基膜(17/18)见纤维丝沉积,基膜上皮侧见毛刺状突起(4/18),纤维丝直径平均14nm(范围11~18 nm)。刚果红阳性与阴性的FGN病理表现上两者均无统计学差异。(3)采用激光微分离肾小球,比较刚果红阳性FGN、刚果红阴性FGN、肾脏AMY及正常人的质谱分析结果发现,一种新发现的FGN特异性的生物标志物——DNAJB9[4-5],刚果红阳性的FGN含量最高,略高于刚果红阴性的FGN,肾脏AMY及正常人则阴性,DNAJB9的免疫组化染色也印证了上述结果。而检测淀粉样物质标志物ApoA- 4、ApoE和血清淀粉样P物质(SAP)发现,肾小球中ApoE及SAP的含量刚果红阳性FGN略高于刚果红阴性FGN,但远低于AMY,ApoA-4的含量FGN远低于AMY,刚果红阳性与阴性FGN两者无统计学差异。
本例患者进一步染色证实肾小球内沉积物DNAJB9强阳性,同时ApoE亦呈阳性,结合光镜、免疫病理及超微结构纤维丝直径等表现,明确诊断为刚果红阳性的FGN。
此外,患者为青年女性,曾系统性红斑狼疮抗凝因子一过性增高,补体C3下降,但目前ANA、抗核抗体谱阴性,非自身免疫性溶血性贫血,需要随访观察有无自身免疫性疾病。
刚果红阳性的原理可能是染料与淀粉样纤维β-折叠片之间的疏水作用所致[6],FGN呈刚果红阳性的确切机制仍不清楚,推测可能是FGN与AMY两者纤维丝的二级结构存在相似性。质谱分析发现刚果红阳性的FGN的ApoE含量介于刚果红阴性的FGN与AMY之间,推测ApoE可能是导致刚果红阳性的原因之一。
本例患者的诊断过程提示对传统肾组织刚果红染色的解读要谨慎。FGN与AMY两者的鉴别意义重大,FGN通常局限于肾脏,无心脏受累,患者生存率远优于Ig相关的AMY[7-8]。FGN与AMY在病理表现上,如光镜表现、纤维丝直径存在一定交叉重合,尤其是当免疫病理单克隆Ig沉积时,两者鉴别存在困难。长期以来,刚果红染色阳性被认为是诊断AMY金标准,而刚果红染色阴性是诊断FGN的关键标准。但从目前来看,刚果红阳性并不能百分百确诊AMY。因此,当肾组织刚果红阳性时,仅局限于肾小球受累,电镜下沉积的纤维丝直径大小无法鉴别AMY与FGN,免疫病理无法明确异常沉积物来源或多克隆IgG、轻链沉积,推荐行质谱分析或免疫组化DNAJB9染色[9]。
此外,刚果红染色结果的判断也十分重要,偏振光下刚果红阳性的沉积物呈苹果绿、黄色、橘红色双折光[2],本例患者在光镜下仅表现为弱橘红染,通过偏振光观察进一步提高诊断的敏感性。
总之,本例是极为罕见的刚果红阳性的纤维性肾小球肾炎,光镜下肾小球内不嗜银的异常物质沉积,免疫荧光肾小球多克隆IgG及κ、λ轻链阳性,电镜下观察到肾小球直径为14~27 nm细纤维丝沉积,刚果红及DNAJB9染色均阳性。对刚果红阳性的解读要谨慎,除综合光镜、免疫病理、电镜,必要时借助质谱分析技术,DNAJB9为FGN的诊断和鉴别诊断提供新的依据。
