达拉菲尼对小鼠肾脏缺血再灌注损伤的保护作用
2019-05-22刘舒苏陈彦伊王少侠
刘舒苏 陈彦伊 王少侠 于 青
急性肾损伤(AKI)由于发病率高、死亡率高、治疗费用昂贵,已经严重威胁人类健康[1]。缺血再灌注损伤(IRI)是AKI的常见原因。IRI的发生机制复杂,有研究认为受体相互作用蛋白3(RIP3)介导的程序性坏死在IRI中发挥主要作用[2-3]。敲除RIP3可以保护缺血再灌注诱导的肾损伤[3-4]。达拉菲尼是一种由美国食品药品监督管理局(FDA)批准用于治疗携带突变的B-RAFV600E转移性黑色素瘤的抗肿瘤药物。近年来研究发现达拉菲尼还具有抑制RIP3酶活性的能力[5]。目前有研究报道过达拉菲尼对缺血再灌注诱导的脑损伤、对乙酰氨基酚诱导的肝损伤具有保护作用[6-7],而达拉菲尼在缺血再灌注诱导的AKI中的作用未见报道。本研究通过建立小鼠IRI模型,旨在探讨达拉菲尼对小鼠IRI的保护作用及其机制。
材料与方法
实验动物24只SPF级雄性C57BL/6小鼠(上海市第一人民医院动物实验中心提供),鼠龄6~8周,体质量22~25g。
试剂达拉菲尼(美国MCE公司);HPMC、Tween80(上海生工);血清肌酐(SCr)、尿素氮(BUN)检测试剂盒(南京建成); PMSF(威奥生物);RIPA、BCA试剂盒、SDS-PAGE(碧云天);ECL发光液(雅酶);PVDF膜(millipore); RIP3、pMLKL、MLKL和羊抗兔二抗(CST);NGAL、KIM-1、TNF-α和pRIP3抗体(Abcam);GAPDH抗体(上海生工),特异性引物(上海生工),免疫组化染色试剂盒(上海基因科技),TUNEL试剂盒(美国sigma)。
实验动物分组以及IRI模型的建立将24只C57BL/6小鼠随机分成4组:假手术组(sham组)、缺血再灌注组(IRI组)、达拉菲尼组(DAB组)及达拉菲尼+缺血再灌注组(DAB+IRI组),每组6只。术前12h禁食不禁水。达拉菲尼溶解于含0.5%HPMC和含0.1%Tween80的纯水中,其剂量为200 mg/kg。 DAB组以及DAB+IRI组于术前2h灌胃给予达拉菲尼200 mg/kg,sham组与IR组则在同样时间灌胃给予等量助溶剂。造模基本步骤:参照[8]构建小鼠IRI模型。小鼠经2%戊巴比妥钠(60 mg/kg)腹腔注射麻醉,固定,使用恒温板使温度保持在37℃。取腹部正中切口,小心游离双侧肾蒂,无创微血管夹夹闭双侧肾蒂,肉眼观察到肾脏颜色由鲜红色变成暗红色,30 min后松开血管夹,恢复灌注,肉眼可观察到肾脏颜色由暗红色恢复成鲜红色,逐层关腹,于24h后取材。sham组和DAB组仅游离暴露双侧肾蒂,不夹闭肾蒂。
标本采集与处理术后24h,收集小鼠右心房静脉血与肾脏标本。将静脉血3 000 r/min离心15 min后取上清,置于-80℃冰箱保存;取左肾的一半置于10%中性福尔马林固定,留作病理学检查,其余肾脏标本迅速置于液氮中,-80℃保存,留作Western Blot检测。
小鼠血清肌酐以及尿素氮检测按照所购试剂盒说明书取血清进行SCr及BUN的检测。
肾脏组织病理学肾组织经10%中性福尔马林固定24h,乙醇阶梯脱水,石蜡包埋,厚4 μm石蜡切片,常规HE和PAS染色,每张片子在光学显微镜下选取10个不重叠的视野观察各组肾脏病理学变化并且评估肾小管损伤程度。评估标准[9]如下:根据肾小管上皮细胞刷状缘脱落、管腔扩张、细胞坏死脱落以及管型形成程度分为:0分:无损伤;1分:肾组织损伤≤10%;2分:肾组织损伤11%~25%;3分:肾组织损伤26%~49%;4分:肾组织损伤50%~75%;5分:肾组织损伤>75%。
WesternBlot 取冻存肾脏组织,加入RIPA+PMSF研磨成组织匀浆,12 000 r/min离心15 min,取上清,根据BCA法测定总蛋白浓度,调整蛋白样本浓度为6 μg/μl,煮沸变性10 min;10%聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,蛋白上样量为60 μl/孔;300 mA恒流电转膜90 min;5%脱脂牛奶封闭90 min;TBS洗膜3次,每次5 min;分别加入含相应抗体的一抗中4℃摇床过夜;次日TBST洗膜3次,每次10 min;加入二抗,室温摇床孵育1H;TBST洗膜3次,每次10 min;ECL发光液显影。
qRT-PCR 取小鼠肾脏组织,用trizol法提取总RNA,逆转录试剂盒合成cDNA。以GAPDH为内参,cDNA以相应特异性引物扩增,引物序列见表1。应用PCR仪(applied Biosystems),按照SYBRGreen荧光定量试剂进行扩增,扩增条件:95℃预变性30s,95℃30s、60℃34s,热循环40次。各组mRNA的表达以GAPDH校正后的相对表达量表示。

表1 特异性引物序列
GAPDH:甘油醛-3-磷酸脱氢酶;KIM-1:肾损伤分子1;NGAL:中性粒细胞明胶酶相关脂质运载蛋白;IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α
免疫组织化学染色石蜡切片常规脱蜡复水,微波修复抗原,随后用3%H2O2室温孵育15 min,以消除内源性过氧化物酶,PBS清洗3次;10%山羊血清室温封闭30 min;滴加小鼠抗TNF-α一抗4 ℃过夜,37 ℃复温2h,PBS洗3遍;滴加生物素标记的羊抗小鼠二抗37 ℃孵育30 min;DAB显色,自来水冲洗,苏木精复染,梯度酒精脱水,二甲苯通透,封片,显微镜下观察。
TUNEL 肾组织固定包埋,切片4 μm厚,根据TUNEL试剂盒说明书操作。每张切片在400×光学显微镜(美国Leica)下随机选取10个不连续的视野观察,计数TUNEL阳性的细胞数。
统计学方法采用SPSS 22.0软件包进行统计学分析。计量资料以均数±标准差表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
达拉菲尼改善小鼠肾功能IRI组Scr、BUN明显高于sham组与DAB组(P<0.05);DAB+IRI组SCr、BUN较IRI组显著下降(P<0.05),而sham组与DAB组之间无统计学差异(图1)。

图1 各组肾功能血清肌酐(A)、尿素氮(B)的变化sham:假手术组;IRI:缺血再灌注损伤组;DAB:达拉菲尼组;DAB+IRI:达拉菲尼预处理加缺血再灌注损伤组;*:与sham组比较,P<0.05;#:与IRI组比较,P<0.05
达拉菲尼减轻小鼠肾脏损伤HE以及PAS染色结果显示(图2),sham组与DAB组肾小管上皮细胞结构正常;IRI组可见肾小管管腔扩张,部分刷状缘消失;肾小管上皮细胞肿胀、坏死,部分管腔出现管型。而DAB+IRI组较IRI组肾组织损伤减轻(P<0.05)。
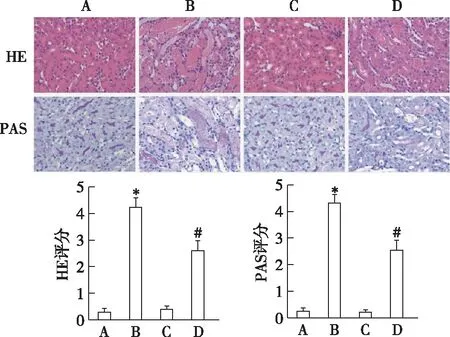
图2 达拉菲尼对肾脏组织病理学的影响(×400)A:假手术组;B:缺血再灌注损伤(IRI)组;C:达拉菲尼(DAB)组;D:DAB+IRI组;*:与假手术组比较,P<0.05;#:与IRI组比较,P<0.05
达拉菲尼减少小管损伤标志物NGAL和KIM-1的蛋白和mRNA水平Western Blot与qRT-PCR结果均显示(图3),与sham相比,IRI组NGAL和KIM-1蛋白和mRNA水平均升高(P<0.05);与IRI组比较,DAB+IRI组NGAL和KIM-1蛋白和mRNA水平均有不同程度的减少(P<0.05)。
达拉菲尼减轻炎症反应与sham组相比,IRI组IL-6和TNF-α mRNA含量明显升高(P均<0.05),小鼠肾脏免疫组织化学结果显示IRI组TNF-α阳性细胞主要分布在小管;与IRI组比较,DAB+IRI组IL-6与TNF-α mRNA水平明显下降(P均<0.05),TNF-α阳性细胞在小管中分布减少。DAB组与sham组间无统计学差异(图4)。
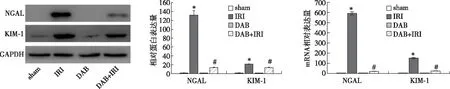
图3 肾小管损伤标志物NGAL、KIM-1蛋白和mRNA水平的变化NGAL:中性粒细胞明胶酶脂质运载蛋白;KIM-1:肾损伤分子1;GAPDH:甘油醛-3-磷酸脱氢酶;*:与sham组比较,P<0.05;#:与IRI组比较,P<0.05

图4 肾脏炎症因子IL-6和TNF-α表达情况A:PCR检测IL-6及TNF-α mRNA水平;B:免疫组化检测TNF-α分布;a:sham组;b:IRI组;c:DAB组;d:DAB+IRI组;sham:假手术组;IRI:缺血再灌注损伤;DAB:达拉菲尼;IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α;*:与sham组比较,P<0.05;#:与IRI组比较,P<0.05
达拉菲尼减少肾组织程序性坏死与sham组相比,IRI组TUNEL阳性细胞显著增加(P<0.05);与IRI组相比,DAB+IRI组TUNEL阳性细胞明显减少(P<0.05)(图5)。Western Blot结果显示(图6),IRI组RIP1、RIP3、pRIP3、MLKL和pMLKL相对蛋白含量均明显高于sham组(P<0.05);DAB+IRI组RIP3、pRIP3、pMLKL相对蛋白含量较IR组下降(P<0.05),RIP1和MLKL蛋白水平改变不明显;sham组与DAB组间各蛋白水平无统计学差异。

图5 肾脏组织TUNEL染色(×400)A:假手术组;B:缺血再灌注损伤(IRI)组;C:达拉菲尼(DAB)组;D:DAB+IRI组;与sham组比较,DAPI:4,6-二氨基-2-苯基吲哚;TUNEL:末端脱氧核苷酸转移酶介导的dUTP缺口末端标记;*:与假手术组比较,P<0.05;#:与IRI组比较,P<0.05

图6 程序性坏死通路相关蛋白水平的改变RIP1:受体相互作用蛋白1;RIP3:受体相互作用蛋白3;pRIP3:磷酸化的受体相互作用蛋白3;MLKL:混合系列蛋白激酶复合物;pMLKL:磷酸化的混合系列蛋白激酶复合物;sham:假手术组;IRI:缺血再灌注损伤;DAB:达拉菲尼;*:与sham组比较,P<0.05;#:与IRI组比较,P<0.05
讨 论
肾脏IRI是AKI的常见原因[10]。迄今为止除了肾脏替代治疗外AKI尚无有效的治疗措施。因此寻找有效的减轻AKI的治疗方案成为目前急需解决的问题。IRI的发生机制复杂,目前尚未完全阐明。近年来,有学者认为necroptosis在缺血再灌注诱导的肾损伤中发挥重要作用[11-14]。程序性坏死是一种新发现的细胞死亡方式,其与凋亡(apoptosis)不同,并不依赖于caspase通路;通常由死亡受体(如TNF,Fas等)引发,依赖于RIP3和MLKL[12]。当RIP3自身磷酸化后,RIP3迅速募集并且磷酸化其底物MLKL,MLKL随即转位至细胞膜上而后使细胞膜破裂从而启动程序性坏死。目前来说,程序性坏死仍然没有一个检测的金标准。本文中采用TUNEL染色结合Western Blot检测RIP3等标志蛋白来共同验证小鼠肾脏组织的程序性坏死。本研究中,IRI组RIP1、RIP3、pRIP3、MLKL、pMLKL蛋白表达水平明显高于sham组,同时TUNEL阳性细胞数也较sham组增多,由此可以发现程序性坏死参与了缺血再灌注诱导的AKI。
肾小管上皮细胞对IRI比较敏感,因此也是IRI后肾脏损伤的主要部位[15]。NGAL和KIM-1[16]是AKI损伤的标志物,在正常肾脏组织中,NGAL和KIM-1表达很少,而当肾脏缺血再灌注损伤后,两者表达均显著升高。本实验中,sham组与DAB组几乎检测不到NGAL和KIM-1,而在IRI组中,NGAL和KIM-1蛋白和mRNA水平较sham组均升高(P<0.05)。IRI后,肾小管上皮细胞分泌大量炎症因子,进而加重肾组织损伤,引起肾功能异常[9]。本研究结果显示,小鼠IRI后肾功能、肾脏病理学均损伤;同时,我们检测炎症因子IL-6和TNF-α mRNA水平,二者均有不同程度地升高;结合TNF-α免疫组化染色结果可以证实IRI后肾脏组织内也伴随炎症因子的释放。
达拉菲尼最早是在2013年被FDA批准用于治疗携带突变的B-RAFV600E转移性黑色素瘤患者。近年来,研究发现达拉菲尼在其他疾病模型中具有治疗作用。Li等[7]发现达拉菲尼可以减轻对乙酰氨基酚诱导的肝损伤;Kim等[17]发现在中毒性表皮溶解坏死(TEN)的体外模型中,达拉菲尼可以减少细胞的程序性坏死;Mohsen等[18]发现达拉菲尼能减轻结晶颗粒对肾小管上皮细胞的毒性;Gruz等[6]发现达拉菲尼可减少脑缺血模型的梗死面积。研究表明其机制是由于RIP3的激酶域和B-RAF激酶域相似,因此 B-RAF抑制剂达拉菲尼可以通过竞争性抑制RIP3,且其抑制RIP3的效能最高[5]。由此,我们猜测达拉菲尼能否对缺血再灌注诱导的AKI具有保护作用。本研究发现,与IRI组比较,DAB+IRI组Scr、BUN降低,肾脏组织病理学损伤有所改善,肾小管损伤标志物NGAL和KIM-1蛋白及mRNA水平均下降,炎症因子IL-6、TNF-α释放减少;此外达拉菲尼预处理能明显减少TUNEL阳性的细胞数量,降低RIP3、pRIP3、pMLKL蛋白含量;而RIP1和MLKL总蛋白水平变化不明显。
综上所述,本研究结果表明,RIP3介导的程序性坏死在缺血再灌注诱导的AKI中发挥重要作用。预处理达拉菲尼能保护肾功能,减轻肾脏病理损伤,减少肾小管损伤标志物NGAL及KIM-1的含量,抑制炎症反应;同时结合TUNEL阳性细胞数量减少及pRIP3、pMLKL的蛋白水平改变,推测达拉菲尼可能通过抑制RIP3介导的程序性坏死及后续的炎症反应从而减轻小鼠肾脏IRI。上述结果为缺血再灌注诱导的AKI的治疗提供了新的方法及理论基础。
