猪小肠微血管内皮细胞的分离培养与纯化
2019-05-21施晓杰马维超邓昱晨穆祥
施晓杰,马维超,邓昱晨,邓 伟,张 倩,冯 波,穆祥
[1.北京农学院动物科技学院兽医学(中医药)北京市重点实验室,北京 昌平 102206;2.中国农业大学动物医学院,北京 海淀 100193]
血管内皮细胞可调节机体内环境稳定,具有分泌、合成、代谢及免疫功能,可产生多种细胞因子和生物活性物质[1]。不同于大血管内皮细胞,在不同组织器官之间,微血管内皮细胞在表型和功能上均表现出差异性[2]。肠微血管内皮细胞衬附于肠绒毛血管内壁,呈网囊状,是血管内外物质交换的重要屏障和各种肠内毒素入血的必经通路。目前关于猪脑微血管内皮细胞的分离培养方法已有诸多报道,但是尚未有成熟的猪小肠微血管内皮细胞(PIMVECs)分离方法的相关研究。因此本试验尝试采用酶消化法和免疫磁珠分选法,建立一套成熟的分离PIMVECs的方法。
1 材料
1.1 实验动物 英系长白SPF新生仔猪,购自北京市SPF猪育种管理中心,实验动物生产许可证号:SCXK(京)2018—0007。
1.2 主要仪器和试剂 CO2培养箱(SANYO公司,MCO17AC);多功能酶标仪(BIOTEK公司,SYNERGY4);荧光倒置显微镜(OLYMPUS,IX71A21PH);磁珠分选仪(Thermo公司,710);澳洲胎牛血清(Gibco公司,1099141);DMEM高糖培养基(Gibco公司,1930009);青链霉素(Gibco,15140122);胰蛋白酶(Sigma公司,03126);I型胶原酶(Gibco公司,17100-017);DAPI染色液(Bioss公司,C-0033);WST-1细胞增殖及细胞毒性检测试剂盒(碧云天生物技术有限公司,C0035);抗小鼠IgG磁珠(In-vitrogen公司,11531D);小鼠抗猪CD31(Novusbio公司,10065336);FITC标记羊抗兔IgG(Abbine公司,A23220);兔抗人Ⅷ因子相关抗原多克隆抗体(CUSABIO公司,P00451)。
2 方法
2.1 细胞的分离 取新生SPF长白仔猪,麻醉后用75%酒精全身消毒,在超净台中无菌取出空肠段,将其置于含有10%青链霉素的冷D-Hank′s浸泡10 min,剔除浆膜层和肌层。将肠段剖开截成3 cm小段,用D-Hank′s清洗数次,直至洗液澄清。刮取肠绒毛,收集于15 mL离心管,加入D-Hank′s,1 200 r/min离心5 min,弃上清及粘液层。将沉淀移入50 mL离心管,按1∶1∶3的比例添加胰蛋白酶、I型胶原酶、DMEM。以上试验步骤均在冰板上操作。将离心管置于旋转摇床室温消化,期间每隔一段时间在显微镜下观察组织消化状态,防止消化过度。消化完全后加入等量含20%FBS的DMEM完全培养基终止消化。消化液过100、200目细胞筛网,1 200 r/min离心收集细胞。取部分细胞直接接种于六孔板,待细胞长满后纯化。
2.2 细胞的纯化 取25 μL磁珠,用Buffer 1(含0.1%BSA 的 PBS)吹洗3 次,加入20 μL(1∶100)小鼠抗猪CD31抗体后混匀,4℃孵育过夜。将过夜后的磁珠移入深孔板,在磁珠分选仪上用Buffer 1清洗3次,收集磁珠于EP管中。用Buffer 2(0.1%BSA和2 Mm EDTA的PBS)重悬细胞,稀释为1×107个/mL的细胞悬液,加入磁珠混匀,4℃ 孵育20 min,每隔5 min震荡。将细胞移入深孔板,用Buffer 1在磁珠分选仪上连续分选3次,将分选后的细胞收集到含Buffer 3(0.1%BSA、1 mmol/L CaCl2和 5 mmol/L MgCl2的PBS)的EP管中,加入Releasing Buffer室温孵育15 min分离目的细胞和磁珠。将孵育好的混悬液加入深孔板,用磁珠分选仪吸弃磁珠。吸取深孔板内纯化后的细胞接种于六孔板,2 h后换液,用差速贴壁的方法进一步优化细胞。此后每2 d换液1次。
2.3 细胞的鉴定 采用免疫荧光法检测所分离细胞上的Ⅷ因子。将培养的第二代细胞接种于24孔板,待细胞长满80%时,PBS洗涤3次,4%多聚甲醛(4℃)固定20 min。PBS洗涤细胞3次,滴加兔抗人Ⅷ因子相关抗原多克隆抗体(1∶200),4℃过夜孵育。阴性对照组用PBS代替Ⅷ因子。抗体孵育结束后,PBS洗涤3次,滴加FITC标记羊抗兔IgG(1∶200),室温避光孵育 1 h,加入 DAPI(1∶300)孵育5 min。孵育结束后,PBS洗涤3次,加入封片剂,于荧光倒置显微镜下观察、拍照。
2.4 WST-1试剂盒检测纯化后细胞的增殖能力
将纯化后的细胞消化后接种96孔板中,细胞密度为1×104个/孔,每个时间点接种6个复孔,同时设空白对照组。37℃、5%CO2培养箱内静置培养,每隔24 h加入WST-1,继续培养1 h后用酶标仪测定450 nm波长处OD值,未测定细胞每隔2 d换液。比色时用空白对照孔平均值调零,以培养时间为横坐标,平均光吸收度为纵坐标,以单点标示出每日细胞吸光度检测平均值,绘制细胞生长曲线。
2.5 细胞的冻存与复苏 将第5次传代后的细胞,按照梯度冻存法冻存[3]。30 d后取出冻存管复苏细胞,接种于6孔培养板,37℃、5%CO2培养箱中培养,观察复苏后细胞的形态及生长情况的变化。
2.6 统计学处理 试验结果采用Graphpad Prism6软件进行统计学处理,计量资料均以¯±s表示。
3 结果
3.1 细胞的分离 清洗后的肠黏膜表面无黏液,肠绒毛张开(见封底彩版图1A),刮取肠黏膜层收集肠绒毛(见封底彩版图1B)。经复合酶消化后肠绒毛断裂,消化液中出现大量细胞即为消化完全(见封底彩版图1C)。离心消化液,沉淀过筛后即为未纯化的PIMVECs(见封底彩版图1D)。
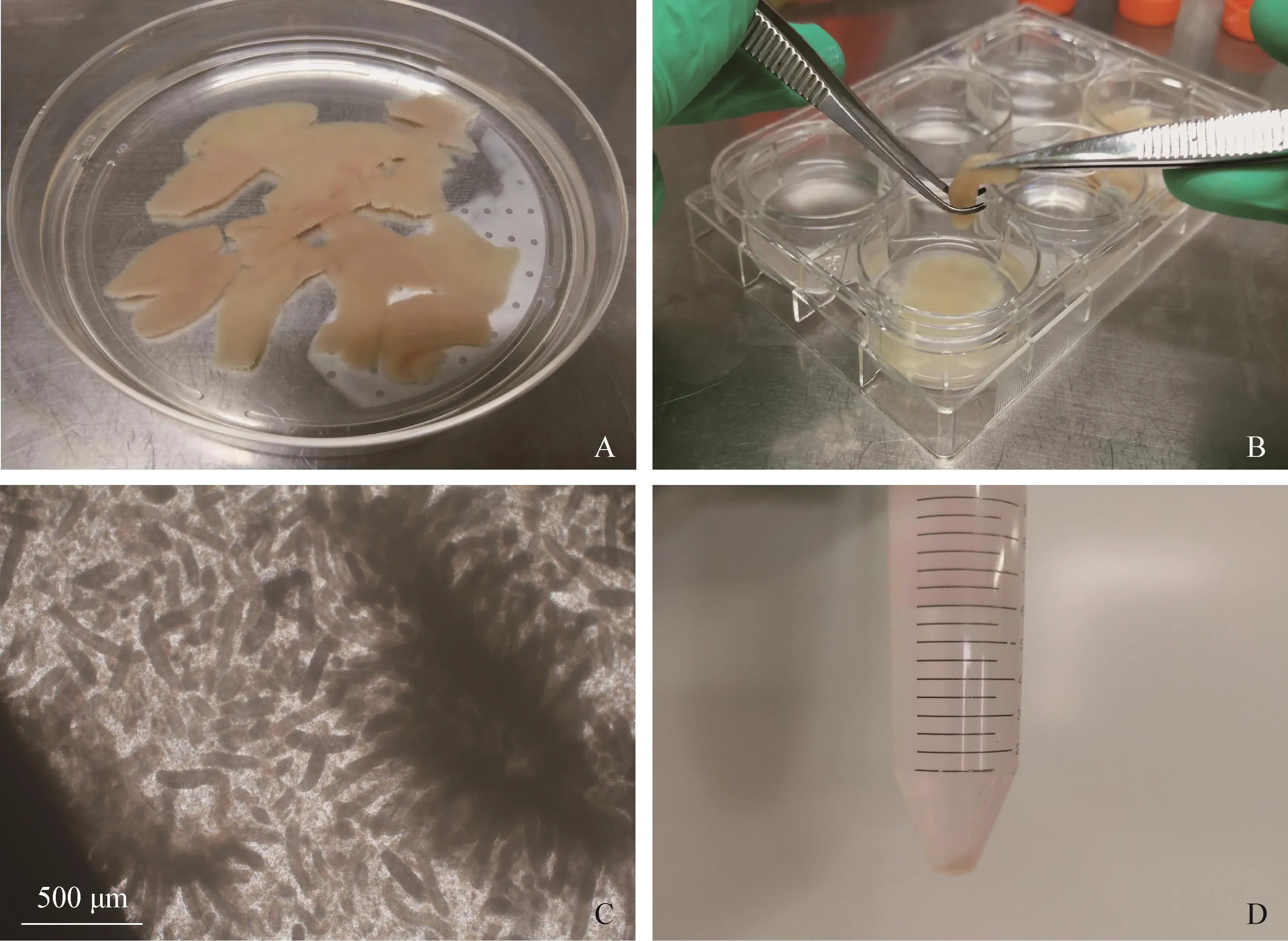
图1 PIMVECs分离
3.2 细胞形态观察 纯化的PIMVECs培养1 d后,倒置显微镜下可见贴壁细胞呈短梭形或三角形,形态清晰,大小均匀,反光较强。3 d后培养皿内贴壁细胞分裂增殖,呈单层生长。7 d后贴壁细胞长满细胞皿,呈现出较为典型的内皮细胞形态,细胞逐渐融合,形成“铺路石样”,出现接触抑制现象,视野中细胞形态匀一,未发现其他细胞形态。
未纯化的PIMVECs培养1 d后镜下可见长、短梭形和多边形细胞,形态清晰;3 d后细胞铺满培养皿,呈单层生长,细胞伸出伪足,呈多边形,未形成典型“铺路石样”;纯化时细胞吸附磁珠较少,纯化后的细胞数量稀少,死亡较多,贴壁细胞颜色加深,细胞核体积增大。
3.3 PIMVECs的鉴定 免疫荧光法检测Ⅷ因子相关抗原呈阳性,视野中细胞胞浆呈现绿色荧光(见封底彩版图2A),DAPI染色后细胞核均呈现蓝色荧光(见封底彩版图2B),阳性细胞数超过95%。对照组中细胞未呈现绿色荧光(见封底彩版图2D)。
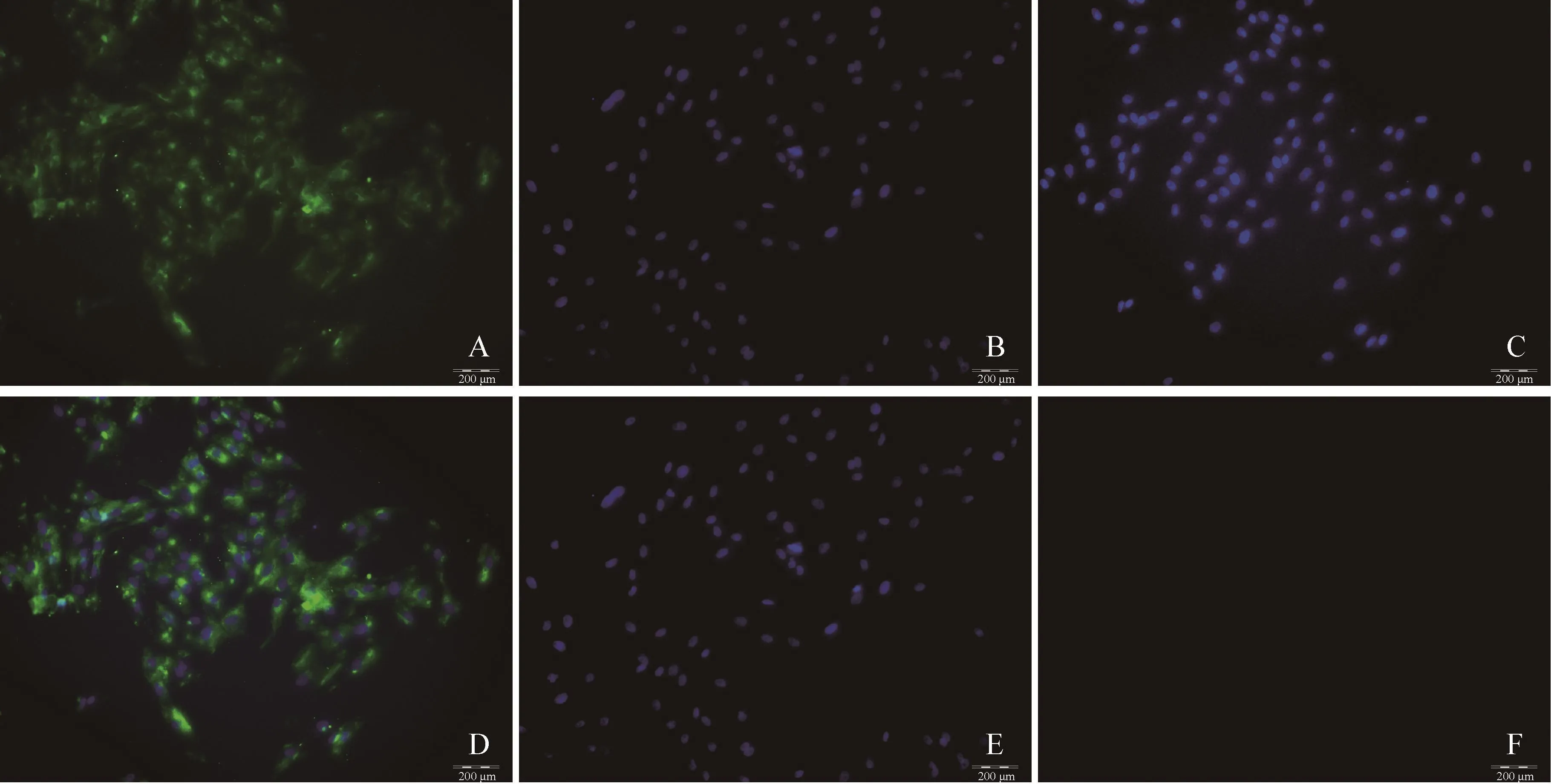
图2 Ⅷ因子相关抗原免疫荧光鉴定(40×)
3.4 WST-1试剂盒检测PIMVECs的增殖情况用WST-1试剂盒测定PIMVECs的生长状况,使用Graphpad Prism6软件绘制生长曲线,发现3 d达到对数生长期,5 d达到平台期(图3)。
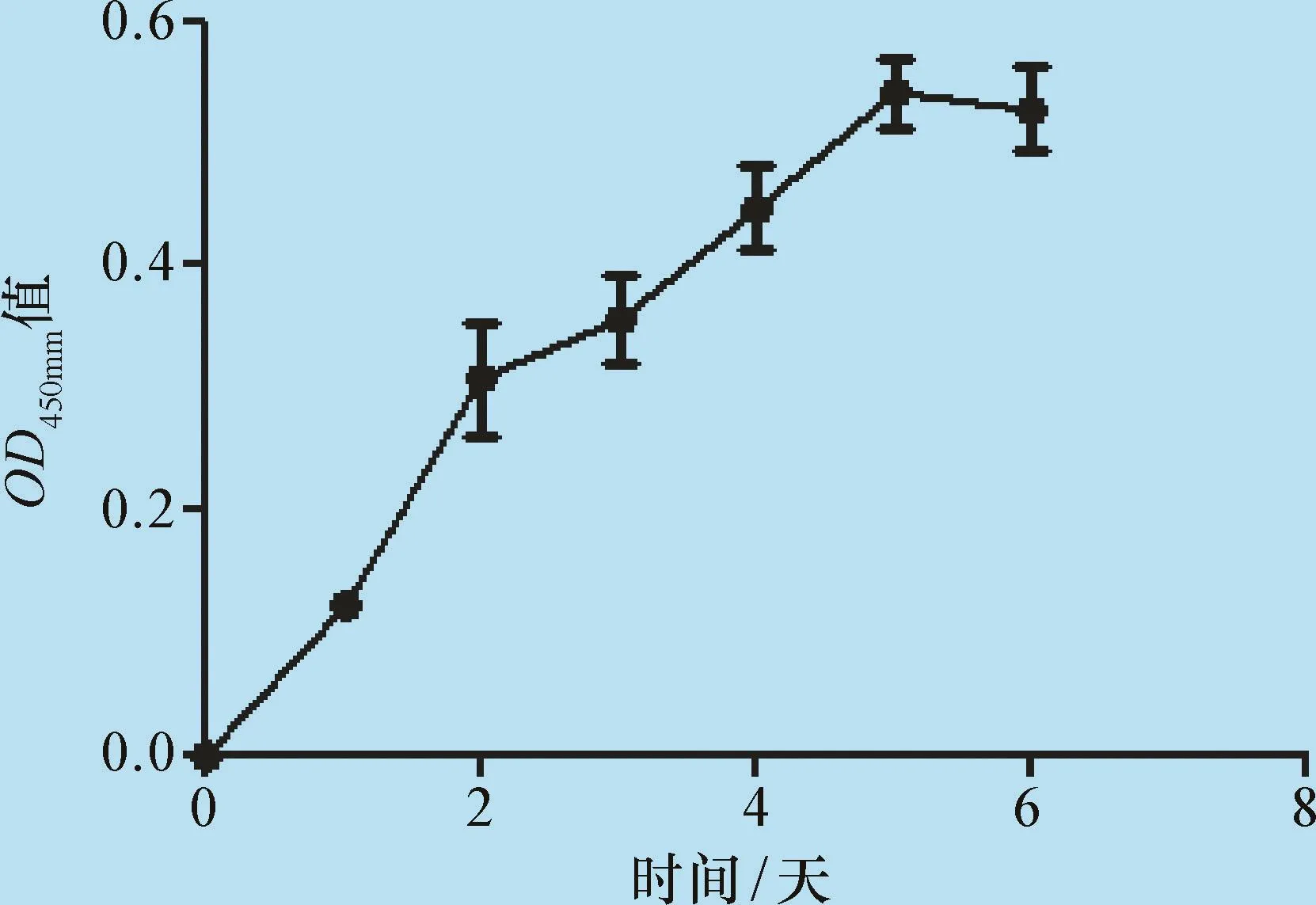
图3 PIMVECs的生长曲线
3.5 冻存对PIMVECs形态及生长的影响 复苏后的细胞在2 h内完成贴壁,6 h后细胞完全伸展,以梭形和铺路石状种状态存在,形态清晰,说明纯化后的细胞具有良好的储存能力,复苏后仍具有很强的细胞活性。
4 讨论与结论
养猪业是我国养殖业重要组成部分,而猪病在近几年给我国养猪业带来了巨大的经济损失。临床常见猪病大多伴发肠道反应,比如猪水肿病可引起肠道组织水肿,猪流行性腹泻的剖检眼观变化仅限于小肠病变。通过对引起肠道病变的肠毒素等毒力因子的研究发现,微血管内皮细胞的异常反应可能是引起肠道病变的主要原因[4]。微血管内皮细胞不仅具有物理屏障作用和生物学功能,而且具有组织器官特异性。自1980年P.M.Davison成功分离了内皮细胞(MVECs)[5]以后,不同物种不同器官的MVECs原代培养技术不断创新改进,其中人和鼠的心脏、肺脏和肠道的微血管内皮细胞培养技术已经相当成熟[6],而猪小肠微血管内细胞的分离培养鲜有报道。由此可见,基于在细胞水平上深入研究猪消化道疾病的发生机制,建造病理模型,PIMVECs的分离纯化培养显得尤为重要。
目前,国际上存在的微血管内皮细胞分离培养方法多为植块法和酶消化法,不同部位的微血管内皮细胞培养要求也不一致。相比用植块法培养肺微血管内皮细胞,肠绒毛容易夹带菌体且富含外泌细胞,组织块贴壁不牢,因此细胞爬出较慢,并且爬出细胞中成纤维细胞及其他杂细胞较多,后期传代过程中不易去除,难以维持目的细胞后期的优势生长,所以肠组织不宜使用植块法。酶消化法虽然较植块法复杂,而且消化时间和酶浓度难以把握,但可在短时间内获得大量细胞,因此适合于持续免疫磁珠纯化试验。
据报道,动物在刚出生时,其胃肠道中是无菌的,但出生后的4 h左右,微生物就能在消化道内定植和繁殖[7]。仔猪刚出生时,通过母体产道时获得了母体的微生物,之后通过生长环境接触各种微生物,并经过与宿主的相互适应和选择,逐渐形成复杂的胃肠道内菌群生态系统[8]。因此PIMVECs的原代分离培养纯化尽量选取新生仔猪,从而降低细胞污染风险。由于肠黏膜表面的黏液会降低细胞过筛率,并且容易裹挟细菌,纯化过程中粘附免疫磁珠,影响磁珠与细胞的结合效率,因此取材肠段要多次清洗至肠绒毛分散,洗液清亮。通过优化消化酶的比例搭配,将消化下来的细胞直接进行免疫磁珠纯化,可一次性短时间内获得大量高纯度PIMVECs。多次试验发现,未纯化细胞因杂细胞较多,成纤维细胞较微血管内皮细胞更易生长分裂,细胞长满时即不能形成“铺路石样”。“铺路石样”是内皮细胞有别于其他细胞的特征性细胞形态,但是在多次传代培养后的内皮细胞,形态常由“铺路石样”转变为梭形和多角形[9-10]。我们在培养过程中发现,“铺路石样”存在于细胞前2代,后期细胞形态根据培养时间、培养基中血清浓度和传代方式等因素逐渐转变。因此,细胞形态可作为鉴定微血管内皮细胞的参考指标,主要还是通过免疫细胞化学进行鉴定。
本试验选择CD31因子对目的细胞进行捕捉纯化。研究表明,内皮细胞表面标记CD31、CD102的高表达仅限于1~3代[11]。本次试验中,将组织分离的细胞进行传代增殖培养再纯化,因在传代培养过程中PIMVECs未能形成优势生长,且PIMVECs表面CD31抗原标志物表达降低,在纯化过程中磁珠较难捕捉到目的细胞,故纯化出的细胞数量稀少,活性较差,少数贴壁细胞趋于老化生长,增殖能力减弱。相比于前者,直接对组织消化后的单细胞进行阳性分离,减少了原代细胞培养周期和试剂投入,同时保持目的细胞活性和表面标志物的高表达,提升目的细胞与磁珠的结合效率,增加纯化细胞的检出量,后期结合Ⅷ因子相关抗原阳性表达,细胞纯度可达95%以上。此方法在磁珠分选过程中对目的细胞进行多次清洗,减少了细菌污染的机率。磁珠纯化仪的原理与磁性分离架相同,因此在不具备磁珠纯化仪的情况下亦可使用磁力架进行后续的细胞纯化。
WST-1是一种类似于MTT的化合物,比MTT更加稳定,线性范围更宽,灵敏度更高。WST-1在电子耦合试剂存在的情况下,可以被线粒体内的一些乳酸脱氢酶还原成橙黄色的甲臜(Formazan)。细胞增殖越多越快,则颜色越深。配合酶标仪测定的吸光度值可直观准确的反应活细胞量。
综上所述,本研究成功建立了一种快速高效分离猪小肠微血管内皮细胞的方法。通过此方法获得的猪肠微血管内皮细胞生长快,数量多,周期短。
