基于生物信息学途径探索与高原低氧心肌损伤相关微小RNA
2019-05-21施冰崔庆华冯振龙李俊峡
施冰,崔庆华,冯振龙,李俊峡
文献报道,miRNA可参与调控高原低压低氧导致的肺动脉高压,通过检测循环miRNA表达水平,协助诊断肺动脉高压[1],提示循环miRNA可能成为诊断急性高原病的新的生物标志物。30%的急性高原病可能发生心源性猝死。目前有关miRNA在急性高原低压低氧相关心肌损伤的功能及其机制研究未见报道。本研究通过低压氧舱模拟高原低压低氧环境,建立高原低氧心肌损伤大鼠模型。应用高通量测序技术,筛选与高原低压低氧心肌损伤相关的关键miRNA。基于生物信息学途径,分析关键miRNA的功能及其作用机制。为进一步从miRNA层面探索急性高原性心脏病的发生机制、早期诊断和干预策略提供理论基础。
1 材料与方法
1.1 实验动物及其分组选取6周龄SPF级SD大鼠,体重200±20 g,雄性,购自北京维通利华实验动物技术有限公司[许可证号SCXK(京)2016-0006]。所有动物实验均通过中国人民解放军总医院第七医学中心伦理委员会审核。采用随机数字表法将SD大鼠随机分为实验组(低压低氧暴露3 d、7 d、14 d、28 d)和常压常氧对照组,每组12只动物。
1.2 实验仪器及实验条件应用实验舱(贵州风雷航空军械有限责任公司)模拟高原低压低氧条件。参数设定:模拟海拔高度7000 m,升降速度10 m/s,舱内压力39.1 kPa,舱内氧气压力9.022 kPa。实验组大鼠置于实验舱内,实验舱运行时间23 h/d,昼夜比12 h:12 h。对照组大鼠置于实验舱外,处理等同于实验组大鼠。
1.3 超声心动图检查各组大鼠完成实验当日出舱后立刻行超声心动图检查。经2%丙戊酸钠溶液腹腔注射麻醉后,大鼠胸前褪毛,仰卧固定。将小动物超声仪的超声探头(频率17.5 MHZ)置于大鼠胸骨前,显示左室短轴切面。于乳头肌水平,应用M超声记录左心室运动曲线。分别测量舒张末期左室前壁厚度(LVAWD)、左室后壁厚度(LVPWD)、左室舒张末期内径(LVIDD)和收缩末期内径(LVIDS),评估左心室结构。测量PV峰值速度和PV峰值梯度,评估左心室舒张功能。计算左心室短轴缩短率(FS%)和射血分数(EF%),评估左心室收缩功能。
1.4 心肌组织病理学检查大鼠完成超声心动图检查后断颈处死。取出心脏,生理盐水冲洗干净,滤纸吸干水分后称重。10%多聚甲醛固定,常规石蜡包埋切片,厚度4 μm,HE染色,光镜下观察心肌组织病理变化。
1.5 心肌组织miRNA表达谱高通量测序根据超声心动图和心肌组织病理检查结果,进一步应用低压低氧暴露7 d组和常压常氧对照组大鼠心肌组织进行miRNA高通量测序。应用Trizol试剂提取大鼠左心室心肌组织总RNA,质检合格的RNA进行文库构建。使用HiSeq2500进行高通量测序(每组6只),检测miRNA表达谱。使用FastQC对原始序列进行检测,保留高质量的整洁序列(clean reads)。使用Cufflinks 2.0对所有转录组结果进行汇总整合,并使用Ensemble转录本数据库对获得的结果进行注释。使用Cufflinks软件筛选差异基因。差异基因的筛选标准为同时满足以下条件:①在两个样本中测序读数之和≥10的基因;②满足│log2(FC)│>1(上调2倍或下调2倍);③同时满足P<0.05和FDR(false discovery rate)<0.05。高通量测序检测由北京博奥公司协助完成。
1.6 差异表达miRNA的生物信息学分析获取差异表达miRNA后,使用DAVID在线工具进行GO功能富集和KEGG信号通路富集分析。使用cytoscape3.3进行可视化,观察差异表达基因在信号通路上的富集情况。使用两个常用靶基因预测软件TargetScan和miRanda对差异表达miRNA对应的靶基因进行预测。利用TAM(http://www.cuilab.cn/tam)软件分别对高表达miRNA和低表达miRNA进行miRNA功能、相关疾病、miRNA家族和miRNA簇富集分析。
1.7 qRT-PCR检测差异表达miRNA在心肌组织表达水平随机选取5个显著差异表达miRNA,应用荧光定量PCR方法,检测其在常压常氧对照组和低压低氧暴露7 d组大鼠心肌组织表达水平。
1.8 qRT-PCR检测差异表达miRNA在血浆表达水平随机选取5个显著差异表达miRNA,应用荧光定量PCR方法,检测其在常压常氧对照组和低压低氧暴露7 d组大鼠血浆表达水平。
1.9 统计学分析采用SPSS 20.0统计软件进行分析。计量资料以均数±标准差(±s)表示,两组间差异采用独立样本t检验,多组间差异采用方差检验,分析组间差异的显著性。以P<0.05为差异具有统计学意义。
2 结果
2.1 成功构建模拟高原低氧心肌损伤动物模型①超声心动图结果示,四组实验组大鼠PV peak velocity和PV peak gradient数值均低于对照组,其中低压低氧7 d组上述生理参数下降最为明显。与对照组比较,差异具有统计学意义(P<0.05)(表1)。②低压低氧暴露3 d组和7 d组大鼠左心室射血分数(LVEF)和FS低于对照组,低压低氧暴露14 d组和28 d组大鼠LVEF和FS高于对照组。与对照组比较,低压低氧暴露7 d组大鼠LVEF和FS下降最为明显,具有统计学意义(P<0.05)(表1)。由于进入高原后7 d大鼠左心室收缩和舒张功能受损最严重,提示进入高原后第7 d是造成大鼠心功能损伤的重要时间节点。
2.2 心肌组织病理学检查结果心肌组织HE染色病理切片光镜下所见(图1)。对照组大鼠心肌细胞界限清楚,可见肌原纤维和横纹,胞核清晰,肌浆未见变性和坏死。低压低氧3 d组可见心肌灶状变性和坏死,伴炎性细胞灶状浸润和成纤维细胞增生,肌浆凝聚,横纹不清。低压低氧7 d组可见心肌粗细不均,间质增宽,血管扩张,个别心肌细胞可见断裂、肿胀,肌浆凝聚,红染,横纹不清。低压低氧14 d组可见心肌细胞排列紊乱、稀疏,间质增宽,血管扩张,心肌可见断裂、肿胀,肌浆凝聚,红染,横纹不清。心肌间质成纤维细胞增生明显,并有胶原纤维排列,心内膜下成片炎细胞浸润,成纤维细胞和胶原纤维增生。低压低氧28 d组可见心肌细胞排列明显稀疏,间质增宽,血管扩张。部分区域心肌间质出血明显,心肌细胞胞核减少。
2.3 心肌组织高通量测序和差异表达miRNA筛选miRNA高通量测序共筛选出18个显著差异表达miRNA,其中15个miRNA表达上调,3个miRNA表达下调(图2)。选取5个差异表达miRNA(miR-144-3p、miR-144-5p、miR-132-3p、miR-212-5p、miR-672-3p),应用荧光定量PCR法进行实验验证。cel-miR-39作为内参。荧光定量PCR检测的miRNA表达趋势与miRNA高通量测序结果一致(图3)。miRNA引物由广州瑞博公司设计合成,采用茎环合成法。
2.4 差异基因的功能富集和信号通路富集分析使用GO、KEGG、DAVID等功能通路分析工具,分析差异表达miRNA富集功能和信号通路。发现很多已报道的与氧化应激、细胞凋亡、自噬、炎症等紧密相关的功能基因(如Nrf2、Sirt2、FOXO3、HO-1、SOD1、NOX4、BCl2、IL-6等)存在差异表达miRNA预测的靶基因中。推测差异表达miRNA可能通过Nrf2、mTOR等经典信号通路调控氧化应激、细胞凋亡、炎症、自噬等病理生理过程,参与低压低氧诱导的心肌损伤。研究发现,与高表达miRNA相关的前6位疾病分别为肺癌、疼痛、乳腺癌、肿瘤、炎症、心肌梗死。与高表达miRNA相关的前3位生物学功能分别为circadian clock(生物钟)、circadian rhythm(昼夜节律)、apoptosis(凋亡)。与差异表达miRNA相关的miRNA家族是miR-132家族和miR-29家族。
表1 大鼠超声心动图检查结果(±s)

表1 大鼠超声心动图检查结果(±s)
组别 例数左室舒张末期内径(m m)P V峰值梯度(m m H g)收缩末期内径(m m)舒张末期左室前壁厚度(m m)舒张末期左室后壁厚度(m m)射血分数(%)短轴缩短率(%)P V峰值速度(m m/s)对照组 6 6.2 9±0.5 0 3.2 0±0.6 6 1.8 5±0.5 1 1.5 8±0.2 5 7 8.9 1±7.9 7 4 9.4 3±7.8 0 8 7 6.8 8±2 4.8 8 3.0 9±0.7 8 3 d 7 5.6 6±0.6 1 3.0 3±0.5 6 2.2 2±0.3 9 1.7 8±0.3 6 7 6.8 4±5.0 9 4 6.8 6±5.3 2 8 1 9.7 4±7 2.5 3 2.7 2±0.4 9 7 d 8 5.5 3±0.8 3 3.0 9±0.7 9 1.8 3±0.3 9 1.8 2±0.4 2 7 3.5 2±7.9 0 4 3.8 6+7.8 7 3 6 7.8 5±1 3 2 0.6 1±0.6 2 1 4 d 8 5.8 9±0.6 1 2.6 7±0.3 9 2.0 7±0.6 0 2.5 1±0.3 3 8 3.9 7±5.7 0 5 4.4 4±6.1 5 7 8 7.4 8±6 6.8 2 2.5 1±0.4 4 2 8 d 7 5.3 5±0.5 8 2.3 2±0.4 0 3.0 5±0.4 6 2.8 9±0.5 3 8 6.3 1±3.1 3 5 6.9 0±3.8 5 7 8 4.1 9±2 7.4 6 2.4 7±0.1 7
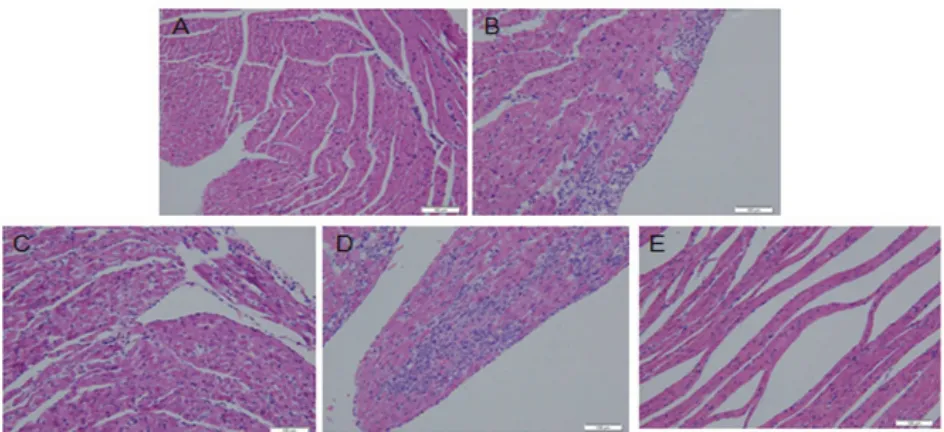
图1 大鼠心肌组织HE染色病理结果(光镜,×100)
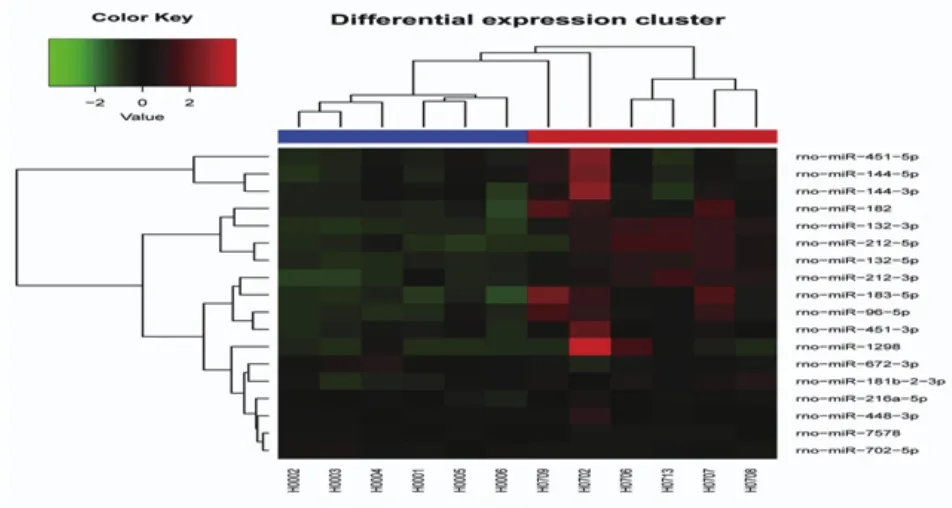
图2 大鼠心肌组织差异表达miRNA热图

图3 低压低氧暴露7 d大鼠心肌miRNA表达
与差异表达miRNA相关的miRNA簇分别为miR-182簇,miR-29a簇和miR-132簇。与表达显著下调的miRNA相关的前六位疾病分别为心脏扩大、腺皮质肿瘤、腺皮质腺瘤、肌源性萎缩、冠状动脉疾病、鼻咽癌。与表达显著下调的miRNA相关的生物学功能主要为胆固醇生物合成。与表达显著下调的miRNA相关的miRNA家族为miR-208家族和miR-199家族。与表达显著下调的miRNA相关的miRNA簇为miR-489簇、miR-208a簇和miR-193b簇。对于差异表达miRNA的生物信息学分析结果提示,生物钟基因、昼夜节律基因、凋亡基因等可能是造成低压低氧心肌损伤的主要功能基因。
2.5 低压低氧7 d大鼠血浆miRNA表达应用荧光定量PCR法分别检测常压常氧对照组、低压低氧7 d组大鼠血浆中5个miRNA(miR-144-3p、miR-144-5p、miR-132-3p、miR-212-5p、miR-672-3p)的表达水平(图4),应用cel-miR-39作为内参。miRNA引物由广州瑞博公司设计合成,采用茎环合成法。图4示,低压低氧7 d组大鼠血浆中miR-144-3p表达丰度较对照组显著升高,与心肌组织miR-144-3p的表达趋势一致。心肌组织中表达显著升高的其余4个miRNA(miR-144-5p,miR-212-5p,miR-132-3p),其在血浆中的表达丰度与对照组比较无显著差异。
2.6 低压低氧不同时间血浆中miR-144-3p表达水平检测应用荧光定量PCR法分别检测对照组、D3组、D7组、D14组和D28组大鼠血浆中miR-144-3p表达水平(图5)。PCR结果发现,随着低压低氧暴露时间延长,血浆miR-144-3p表达水平逐渐升高。综合高通量测序、心肌组织和血浆miRNA的PCR检测结果,我们预测血浆miR-144-3p可能成为评估高原低压低氧心肌损伤的潜在生物标志物。

图4 低压低氧暴露7 d大鼠血浆miRNA表达

图5 低压低氧暴露不同时间点大鼠血浆miR-144-3p表达
3 讨论
本课题组根据既往实验经验,参考国内外文献报道,应用低压氧舱模拟高原环境,构建了急性高原低压低氧心肌损伤大鼠模型。根据超声心动图和大鼠心肌组织病理,我们选择低压低氧暴露7 d大鼠心肌组织进行了miRNA表达谱高通量测序,并对差异基因进行了生物信息学分析。生物信息学分析结果提示,低压低氧可导致大鼠心肌组织miRNA表达谱发生显著变化。差异表达miRNA主要为miR-144/451基因簇、miR-132/212基因簇。心肌组织和血浆miRNA检测结果提示,miR-144-3p与高原低氧心肌损伤密切相关。
近年来国内外研究发现,miR-144既是红系分化的重要调节因子,也参与了肿瘤、心脑血管病的发生、发展。miR-144可参与红细胞表型转变,调节早期红细胞成熟和增生[2]。miR-144敲除协同氧化应激可导致斑马鱼胚胎发生严重贫血[3]。miR-144高表达时,镰状红细胞贫血更加严重[4]。其机制可能为miR-144靶向下调核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,NRF2),从而降低谷胱甘肽产生,降低红细胞抗氧化能力。miR-144除了参与红细胞氧化应激,还可通过调控靶基因细胞周期调节蛋白参与多种肿瘤的发生、发展和转移[5]。此外,miR-144可通过调控编码死亡受体、Caspases和其他凋亡相关基因来影响Caspase级联反应[6]。将miR-144类似物转染大鼠H9C2心肌细胞,可见心肌细胞增生显著降低、Caspases-3活性升高、细胞凋亡率升高,提示miR-144是促进心肌细胞凋亡的基因[7]。
国内外多个临床实验也提示miR-144-3p与心肌梗死、心律失常等心血管疾病相关。Hu等[8]发现,miR-144-3p类似物可抑制ABCA1基因,提高炎症因子白细胞介素-1β(IL-1β),白细胞介素-6(IL-6)和肿瘤坏死因子(TNF-α)表达。急性心梗患者循环miR-144-3p表达丰度与血清肌酸激酶(CK),肌酸激酶同工酶(CK-MB),乳酸脱氢酶(LDH)和谷草转氨酶(AST)表达呈正相关。提示miR-144-3p是调节胆固醇稳定性和炎性反应的基础,可能成为治疗动脉粥样硬化的潜在靶点和有前景的诊断急性心肌梗死的生物标志物。Bye等在HUNT研究发现[9],联合检测miR-144-3p等5个循环miRNA和Framingham危险评分,可将健康人群发生急性心肌梗死的风险预测阳性率自0.72提升至0.91(P<0.01)。Yamada等[10]检测了致心律失常性右室心肌病合并室性心律失常患者血浆miRNA表达水平,发现血浆miR-144-3p和其他三个miRNAs(miR-145-5p,miR-185-5p,miR-494)表达丰度升高。我国Li等[11]研究发现,miR-144-3p过表达能够显著降低细胞活性,促进细胞凋亡,提高氧化应激反应。下调miR-144-3p能够提高靶基因NRF2表达及ARE的活性。上述临床研究均提示miR-144-3p可能通过调控氧化应激、炎性反应、离子通道等参与心肌损伤的病理生理过程。
本研究发现,高原低压低氧导致的受损心肌组织中,miR-144-3p和miR-144-5p的表达水平都上调。随着高原低氧暴露时间延长,血浆中miR-144-3p表达水平升高,血浆miR-144-3p可能是反应高原低压低氧心肌损伤的潜在的生物标志物。通过本研究,将深化有关高原低压低氧心肌损伤发病机制的认识,为探索防治高原心脏病的新策略提供理论依据和实验基础。
