基于细胞自噬机制探讨祛风生脉颗粒保护血管内皮的研究
2019-05-20马培泽孙正新2姜月华3
马培泽,孙正新2,杨 春,姜月华3,吕 娟
细胞在应激状态下,适度的自噬能够促进细胞自我吞食,保护细胞抵抗不利环境,促进细胞存活,而过度自噬则诱导细胞走向程序性死亡[1-4]。心肌缺血时,自噬活性的改变很可能影响血管内皮的结构和功能,而血管内皮细胞功能改变与心血管疾病的发生发展密切相关,因此,研究自噬在缺血心肌微血管内皮细胞(CMECs)缺血损伤中的作用,将有助于发现新的方法应用于缺血性疾病的治疗。过去的研究多集中于对心肌细胞的保护,而忽视了对CMECs缺血损伤的关注。迄今为止,自噬在缺血CMECs的作用尚未明确,基于细胞自噬探讨中医药保护血管内皮的作用,鲜见报道。鉴于此,本课题在原有研究基础上,建立缺血CMECs模型,基于细胞自噬探讨中医药保护血管内皮的干预效应。
1 材料与方法
1.1 实验动物 选用SPF级6周龄雄性SD大鼠,体重220~280 g,45只,由山东鲁抗医药股份有限公司提供。所有大鼠均采用笼养,生存在明暗各12 h饲养环境中。
1.2 主要仪器 流式细胞仪(德国Beckman公司),酶标仪(美国Thermo Scientific公司),低温高速离心机(美国Thermo Scientific公司),透射电镜(日本JEOL公司),CO2培养箱(美国Heraeus公司),心电图机(北京福田电子医疗仪器有限公司),呼吸机(美国BIRD公司),BIO-RAD电泳仪(美国BIO-RAD公司),Axiovert 40C倒置相差显微镜(德国Zeiss公司),BIO-RAD半干转膜仪(美国BIO-RAD公司),LAS-4000型化学发光及荧光影像分析仪(日本FUJIFILM公司)。
1.3 药品与试剂 Annexin V-FITC细胞凋亡检测试剂盒(杭州联科生物有限公司),3甲基腺嘌呤(3-MA,美国Sigma-Aldrich),雷帕霉素(美国Cell Signal Technology),祛风生脉颗粒(北京康仁堂药业有限公司),DMEM高糖培养基(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),PBS平衡液(上海碧云天生物技术有限公司),0.25%胰蛋白酶(北京Solarbio公司),Western-blot所用试剂(北京Solarbio公司)。
1.4 实验方法
1.4.1 动物灌胃及血清制备 选取雄性SD大鼠(220~280 g)5只。祛风生脉颗粒2 g/(kg·d),每只大鼠每日上午灌胃1 次,每次4 mL,连续5 d。于第5日末次灌胃3 h 后打开腹腔,在大鼠腹主动脉插管,无菌取血,置无菌不抗凝管中,室温下静置3~4 h,1 500 r/min离心20 min,吸上清液,无菌分离血清并混合,过滤后置于无菌试管中,制备成祛风生脉颗粒大鼠含药血清,于-20 ℃冰箱保存。
1.4.2 大鼠急性心肌梗死模型建立 选取雄性SD大鼠(220~280 g)32只,采用结扎法制作大鼠急性心肌梗死模型[5]。记录心电图出现Q波、ST段抬高、T波高耸或倒置,证实结扎成功。术后存活24 h即为造模成功。
1.4.3 培养大鼠缺血/正常CMECs 选取造模成功的急性心肌梗死模型大鼠32只及正常SD大鼠8只,采用组织块法分别培养大鼠缺血/正常CMECs[5]。组织块周围培养出大量细胞,去除组织块,继续培养,3 d换液1次,直到细胞生长至近融合时进行传代,实验均选取二代细胞进行。
1.4.4 分组及药物干预 将成功培养的大鼠缺血CMECs随机分为4组:缺血组(QX组)、缺血+雷帕霉素组(QX+RAPA组)、缺血+3-甲基腺嘌呤组(QX+3-MA组)和缺血+祛风生脉颗粒组(QX+QF组)。并将正常大鼠CMECs作为正常组(ZC组)。QX组和ZC组细胞均给予含20%胎牛血清的DMEM高糖培养基培养,QX+RAPA组在上述培养基基础上,加入浓度为10 nmol/L的自噬促进剂雷帕霉素,QX+3-MA组加入浓度为5 mmol/L的自噬抑制剂3-MA,QX+QF组给予祛风生脉颗粒大鼠含药血清,与缺血CMECs共孵育,培养24 h。
1.5 观察指标及测定方法
1.5.1 透射电镜观察自噬小体 取各组处于对数生长期的细胞,倒置相差显微镜下观察细胞长满培养瓶底的80%,消化、离心,小心吸取上清液,向细胞团块中缓缓加入1.5 mL 3%戊二醛固定液进行固定,4 ℃保存,后进行双固定、脱水、浸透、包埋、切片,调试电镜,观察自噬小体以及细胞超微结构变化。
1.5.2 Western-blot分析LC3-Ⅱ/Ⅰ比值及P62蛋白表达 与上述分组一样,分别取5组生长至对数生长期的细胞,弃培养液,PBS洗涤后加入细胞裂解液,提取总蛋白,BCA法测定蛋白浓度[3],根据总上样量和各组样本蛋白浓度计算各组样本所需样本量。将样品液和预染蛋白标记分别上样,电泳分离蛋白,参照半干转膜仪说明组装滤纸凝胶纤维素夹层,转印蛋白,于5%脱脂奶粉溶液中室温孵育1 h以封闭膜上的非特异结合,封闭过的膜加入合适浓度一抗,抗原抗体结合,4 ℃孵育过夜,加入HRP标记的二抗以结合一抗,室温孵育1 h,加入显色剂,膜与化学发光底物孵育,应用LAS-4000型化学发光及荧光影像分析仪曝光显影,图片扫描。应用Gel-Pro软件分析数字化图像上每个特异条带的灰度值。各组样本目的蛋白的灰度值除以内参的灰度值以校正误差,所得数值为各组样本目的蛋白的相对含量。
1.5.3 流式细胞仪检测细胞凋亡 0.25%胰酶消化细胞,将每个样本细胞数调整为1×106~5×106个,1000r/min离心5min,弃上清,PBS洗涤2次,1000 r/min离心5 min,弃上清,每个样本用约500 μL的1×Binding Buffer重悬细胞;每个样本中分别加入5 μL的Annexin V-FITC和106的PI;避光摇匀后黑暗中室温孵育5 min;1 h内通过流式细胞仪检测分析结果。
1.5.4 酶联免疫吸附法检测一氧化氮(NO)、内皮素-1(ET-1) 加药干预后用无菌EP管收集各组细胞培养上清液,按照酶联免疫试剂盒说明书稀释标准品。取5支干净的EP管,并于每管中加入150 μL的标准品稀释液,分别设空白孔(不加样,只加显色剂A、B和终止液)、标准孔、待测样品孔和零孔(将其作为标曲的最后一个点),并做记录。标准品孔:每孔加入制备好的标准品50 μL,后加入生物素抗原工作液50 μL。样品孔:先加入相应大鼠血清样品50 μL,后加入生物素抗原工作液50 μL。零孔:先加入标准品/样品稀释液50 μL,后加入生物素抗原工作液50 μL。以上各孔均做好相应记录,轻轻摇晃后贴上封板膜,置于37 ℃恒温箱中60 min。轻轻揭掉封板膜,弃去液体,甩干,放入洗板机内洗板,洗板5次后取出酶标板,拍干。每孔中先后分别加入显色剂A 50 μL、显色剂B 50 μL,小心摇晃,置于37 ℃保温箱中避光10 min。取出酶标板,每孔加入终止液50 μL以终止反应(蓝色立即转为黄色)。将酶标板放入酶标仪中,以空白孔调零,波长为450 nm测量各孔的吸光度值(此步骤应于10 min内进行)。根据标准品的浓度和吸光度值计算出标准曲线回归方程,在此基础上根据样品的吸光度值计算出不同样品所对应的浓度。
2 结 果
2.1 透射电镜观察各组细胞自噬小体及超微结构变化 透射电镜下,ZC组细胞质均匀,细胞内空泡少,核染色质均匀分布;QX组细胞质内可以见到大小不等的双层膜或多层膜自噬体结构,线粒体形态肿胀变形;QX+RAPA组自噬体的聚集趋于增多,自噬体中包含部分细胞质成分,QX+3-MA组自噬体数目明显减少。QX+QF组自噬小体聚集更加明显,同时还观察到数目较多的自噬溶酶体,自噬溶酶体中包含部分胞质成分以及尚未消化的细胞器。详见图1。
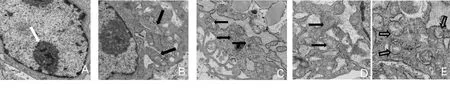
A为ZC组;B为QX组;C为QX+RAPA组;D为QX+3-MA组;E为QX+QF组。图中白色箭头所示为核仁,黑色实心箭头所示为自噬小体,黑色空心箭头所示为自噬溶酶体
2.2 各组细胞LC3-Ⅱ/Ⅰ比值情况比较 Western blot 结果表明:QX组LC3-Ⅱ/Ⅰ比值高于ZC组和QX+3-MA组(P<0.05);与QX组和QX+3-MA组比较,QX+RAPA组LC3-Ⅱ/Ⅰ比值进一步升高(P均 <0.05),与QX组相比,QX+QF组LC3-Ⅱ/Ⅰ比值显著升高(P<0.01)。详见表1。
表1各组细胞LC3-Ⅱ/Ⅰ比值情况(±s)
与ZC组比较,1)P<0.05;与QX组比较,2)P<0.05;与QX+3-MA组比较,3)P<0.05,4)P<0.01
2.3 各组细胞凋亡情况比较 QX组总凋亡率高于ZC组(P<0.05);与QX组和QX+3-MA组比较,QX+RAPA组总凋亡率明显降低(P均<0.05),与QX组相比,QX+QF组总凋亡率显著降低(P<0.01)。详见图2、表2。
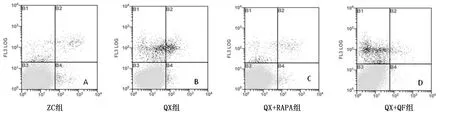
图2流式细胞仪检测细胞凋亡情况
表2各组CMECs凋亡情况比较(±s) %
与ZC组比较,1)P<0.05; 与QX组比较,2)P<0.05;与QX+3-MA组比较,3)P<0.05,4)P<0.01
2.4 各组细胞内皮功能变化 QX组ET-1水平比ZC组升高(P<0.01);QX+RAPA组ET-1水平比QX组降低,差异有统计学意义(P<0.05);QX+3-MA组ET-1水平比QX组升高(P<0.05);QX+QF组ET-1水平比QX组明显降低,差异有统计学意义(P<0.01)。QX组NO水平比ZC组升高(P<0.01);QX+RAPA组NO水平比QX组降低(P<0.05);QX+3-MA组NO水平比QX组升高(P<0.05);QX+QF组NO水平比QX组明显降低,差异有统计学意义(P<0.01)。详见表3。
表3各组细胞内皮功能变化比较(±s)
与ZC组比较,1)P<0.01;与QX组比较,2)P<0.05;3)P<0.01
3 讨 论
“损伤反应”学说认为,血管内皮细胞损伤是冠心病心肌缺血发生的始动环节。然而,目前对于CMECs缺血损伤的关注远远少于心肌细胞本身。
自噬作为细胞应对损伤的一种保护性反应,对维持细胞内环境的稳定及生理功能有着非常重要的作用[6-9]。推测自噬可能是防止血管内皮缺血损伤的一种潜在机制,有可能成为心血管疾病治疗的新靶点和新策略。Xie等[10]用AGEs修饰的牛血清白蛋白AGEs-BSA培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),发现AGEs-BSA 在作用早期可以提高 HUVECs 的自噬水平而抵抗损伤。Han等[11]发现预孵育姜黄素能诱导HUVECs自噬,显著增加过氧化氢处理HUVECs的生存能力。张艳林等[12]用氧化型低密度脂蛋白(ox-LDL)刺激内皮细胞后发现ox-LDL可诱导细胞自噬,同时乳酸脱氢酶(LDH)和ET-1的分泌增加说明细胞受到损伤,而这种损伤可被自噬诱导剂雷帕霉素所降低,被自噬抑制剂3-MA所增强,提示自噬在ox-LDL导致的内皮细胞损伤中起保护作用。本研究发现,缺血CMECs能够发生自噬,但是细胞凋亡增加,内皮功能受到损伤,雷帕霉素干预后的缺血CMECs,电镜下观察到自噬小体数目增多,细胞凋亡减少,内皮功能得到改善,缺血CMECs的自噬流是受到抑制的,整个自噬过程是存在障碍的,这种障碍很有可能发生在自噬溶酶体的环节。
根据冠心病“本虚标实”的基本病机,结合戴国华教授提出的冠心病“风病”学说,认为心肾阳虚、气血失调是冠心病发病的基础,风邪是冠心病重要的致病因素,脉滞风阻是冠心病发作的关键病理环节。确立了祛风活血通络、补肾益气生脉的治疗方法,研制成中药祛风生脉颗粒,从风邪论治冠心病有着丰富的临床经验,且对安全性的顾虑较少。用祛风生脉颗粒大鼠含药血清,与缺血CMECs共孵育,电镜下观察到自噬小体数目明显增多,同时观察到较多的自噬溶酶体,LC3-Ⅱ/Ⅰ比值显著升高,细胞总凋亡率明显减少,ET-1水平降低(P<0.01),提示祛风生脉颗粒干预后不仅促进了自噬小体的生成,而且促进了整个自噬流,包括自噬溶酶体的生成,达到减少细胞凋亡,改善内皮功能的干预效应。至于祛风生脉颗粒调控自噬的分子机制,尚需要进一步深入研究。
