齿瓣石豆兰化学成分的分离及其抗肿瘤活性研究
2019-05-18陈小兵黄丽芸凌志杰潘建萍
陈小兵,黄丽芸,许 军,凌志杰,潘建萍,彭 红
(1.赣南卫生健康职业学院,江西 赣州 341000;2.江西中医药大学 药学院,江西 南昌 330004)
石豆兰属(Bulbophyllum)是兰科(Orchidaceae)树兰族(Trib.Epidendreae)石豆兰亚族(Subtrrib.Bulbophyllinae)下属之一,大多生长在石灰岩上。其性味甘辛,具有养胃生津、祛风除湿、消肿止痛、清热化痰、舒筋骨、凉血活血的功效[1-2],可用于治疗高热惊风、风湿痹痛、四肢麻木、痈肿、咽痛[3]。药用石豆兰属有15种,主要分布于江西、广西、湖北、广东、江苏、安徽和云南,其中云南省分布最多,有12种之多。江西齿瓣石豆兰(Bulbophyllum.levineiSchltr)主要分布于遂川、井冈山、庐山等山区。本研究对赣南地区产的齿瓣石豆兰药材进行了分离纯化,共得到9个化合物,经波谱分析鉴定为化合物1:7-羟基-3-(4’-羟苯基)异黄酮;化合物2:槲皮素;化合物3:2-甲氧基-1-羟基苯甲醛;化合物4:6-甲氧基-7羟基-异黄酮;化合物5:邻羟基苯甲酸;化合物6:6-甲氧基-2-(4’-甲氧基苯基)-3-羟黄酮;化合物7:棕榈酸乙酯;化合物8:3-甲氧基-4’-羟黄酮;化合物9:4’-甲氧基-2-甲基-7-羟异黄酮。
本研究丰富了齿瓣石豆兰的黄酮类化学成分及其抗肿瘤活性的有效成分,为进一步研究齿瓣石豆兰的抗肿瘤活性及有效成分提供了科学依据。
1 材料
1.1 仪器
Nicolet 5700型傅里叶变换红外光谱仪;Inova 500型核磁共振仪(TMS为内标);Agilent 1100 Series LC/MSD 质谱仪;制备液相色谱仪为 Shimadzu LC-6AD (制备柱,YMC-Pack ODS-A);大孔吸附树脂HP-20(日本三菱公司);LH-20型葡聚糖凝胶(Sephadex LH-20Amersham Pharmacia Biotech 公司);反相硅胶柱(日本YMC公司);ACSCalibur流式细胞仪(美国BD公司)。
1.2 药材
齿瓣石豆兰全草于2018年6月采自江西赣州,标本的性状特征依照有关文献[4]的描述,并由江西古汉精制中药饮片有限公司总经理颜干明(国家二级技师)鉴定为齿瓣石豆兰(Bulbophyllum.levineiSchltr)。凭证样品保存于赣南卫生健康职业学院中药标本室。
人结肠癌HT-29细胞株、人慢性白血病K562细胞株和人乳腺癌MCF-7细胞株(美国ATCC公司)。
1.3 其他试验用品
硅胶GF254;柱色谱硅胶G(青岛海洋化工有限公司,200~300目);LH-20型葡聚糖凝胶(Sephadex LH-20)柱色谱(Amersham Pharmacia Biotech)。实验中所涉及的化学试剂均为色谱纯或分析纯级别。
2 方法与结果
2.1 提取与分离
取齿瓣石豆兰全草10 kg,将其粉碎后过40目筛,用10倍量70%乙醇依照浸渍的方法依次提取3次(每次浸4 h),然后合并3次乙醇提取液,减压蒸发浓缩后得到浓缩提取物2.6 kg。取提取物1.0 kg,再将10倍的95%乙醇加热回流提取3次(每次4 h)。乙醇提取液减压蒸发浓缩后,得到的棕色浸膏用水再次分散搅拌,用氯仿、甲醇、乙酸乙酯、正丁醇萃取,各萃取液减压浓缩回收溶剂后得浸膏,得到浸膏460 g棕色物,水溶解后用Diaion HP-20型大孔吸附树脂吸附,分别用水、15%乙醇溶液、45%乙醇溶液及75%乙醇溶液洗脱进行层析分离经TLC检测合并相同流分,得到4个部分(Fr.1~4)。Fr.1(5.8 g)经反相硅胶色谱柱,氯仿-甲醇(20∶1~5∶1)系统梯度洗脱,目标成分再经结晶得到化合物1(21 mg)、化合物2(9 mg)。Fr.2(6.4 g)再经反相硅胶柱色谱,石油醚-乙酸乙酯(20∶1~10∶1)混合溶剂梯度洗脱得到化合物3(11 mg)、化合物4(6 mg)和化合物5(15 mg)。Fr.3(7.6 g)经LH-20型葡聚糖凝胶(Sephadex LH-20)柱色谱分离,石油醚-乙酸乙酯(5∶1~1∶10)混合溶剂甲醇洗脱,反复重结晶后得到化合物6(13 mg)和化合物7(9 mg)。Fr.4(4.5 g)经反相硅胶柱色谱,氯仿-丙酮(20∶1~5∶1)系统梯度洗脱,收集到了化合物8(16 mg)、化合物9(5 mg)。
2.2 结构鉴定
确认化合物结构主要是根据化合物特有的物理和化学性质以及化合物的波谱数据。化合物的物理和化学性质包含化合物的形状、熔点及化学特征反应等。化合物的波谱数据主要包括红外光谱(IR)数据、紫外光谱(UV)数据、核磁共振碳谱和氢谱(13C-NMR和1H-NMR)数据、电子轰击离子源-质谱联用(EI-MS)数据。从齿瓣石豆兰中乙醇提取物分离得到的化合物依据实验测试结果,鉴定其结构如下。
化合物1:淡黄色针状结晶,分子式为C15H10O4,mp:317~318 ℃。化合物通过盐酸-镁粉的试验,试验结果为阳性,提示此化合物为黄酮类成分。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。红外光谱(IR)(KBr)提示:羟基的最大吸收在3 265 cm-1处,C=O的吸收峰:1 709 cm-1处。1 627、1 586、1 511、1 456、1 289、1 249、1 209、856 cm-1几处峰提示为此结构为苯环。UV(乙醇)nm:219,295。EI-MS:m/z 254.7[M]+。1H-NMR(CD3OD,400 MHz)δ:6.75(d,2H,J=8.2 Hz,H-6,8),6.89(d,2H,J=2.0 Hz,H-3’,-5’),7.41(d,2H,H-2’,-6’),7.9(d,1H,H-5),8.21(s,1H,H-1),9.7(s,1H,OH),10.81(s,1H,OH)。13C-NMR(CD3OD,100 MHz)δ:102.1(C-3’,5’),116.1(C-6,8),122.4(C-4),123.5(C-2),125.7(C-1’),128.2(C-2’,6’),131.1(C-5),153.2(C-1),156.9(C-7,4’),175.3(C-3,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[5]报道基本一致,故鉴定为7-羟基-3-(4’-羟苯基)异黄酮。
化合物2:淡黄色针状,分子式为C15H10O7,mp:311~313 ℃。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示在3 442cm-1处有羟基的最大吸收峰。C=O的吸收峰在1 612 cm-1和1 660 cm-1处。苯环吸收:1 625、1 581、1 511、1 428、1 145、1 119、1 011、821cm-1。EI-MS:m/z 302[M]+。1H-NMR(CD3OD,400MHz)δ:6.01(d,1H,J=2.3Hz,H-6),6.21(d,1H,J=2.4Hz,H-8),6.61(d,1H,J=8 Hz,H-5’),6.75(d,1H,J=8.5 Hz,H-6’),6.61(d,1H,J=8 Hz,H-5’),7.13(d,1H,J=8,2.5 Hz,H--2’),9.23(s,1H,3’-OH),9.33(s,1H,4’-OH),9.23(d,1H,4’-OH),10.21(s,1H,7-OH),12.23(s,1H,5-OH),13.02(s,1H,3-OH).13C-NMR(CD3OD,100MHz)δ:95.5(C-8),98.3(C-6),104.9(C-4),112.8(C-6’),118.1(C-3’),120.8(C-2’),125.8(C-1’),138.2(C-2),146.9(C-4’),147.9(C-5’),160.5(C-1),164.2(C-5),166.2(C-7),179.1(C-3,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[6]报道基本一致,故鉴定为槲皮素。
化合物3:白色粉末状,分子式为C8H8O3,mp:81~82 ℃。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示:在3 268 cm-1有羟基的吸收峰。1 627、1 589、1 514、1 458 cm-1显示为苯环。1H-NMR(DMSO,300 MHz)谱芳香区中δ7.11(1H,d,J=1.9 Hz),7.32(1H,d,J=8.0 Hz)和7.38(1H,d,J=2.0Hz)为一典型的1,2,4三取代苯环的特征吸收。13C-NMR(DMSO,400MHz)中所显示的δ55.4说明该分子中有-OCH3的存在。1H-NMR(DMSO,300 MHz)δ:9.79(1H,s,CHO),7.41(1H,d,J=2.0 Hz),7.34(1H,d,J=2.3 Hz),7.01(1H,d,J=2.3 Hz),3.87(3H,s,-OCH3),4.95(1H,s,OH)。13C-NMR(DMSO,400 MHz)δ:189.9(-CHO),148.5(C-4),153.4(C-3),128.7(C-1),126.4(C-6),116.5(C-5),113.7(C-2),55.8(-OCH3)。以上化合物的物理和化学性质以及光谱数据与文献[7]报道基本一致,故鉴定为2-甲氧基-1-羟基苯甲醛,又名香兰素。
化合物4:淡黄色油状,分子式为C16H12O4,mp:291~293 ℃。化合物通过盐酸-镁粉的试验,试验结果为阳性,提示此化合物为黄酮类成分。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示,在3 601cm-1处有羟基的最大吸收峰。C=O的吸收峰在1 615 cm-1和1 685 cm-1处。苯环吸收:1 597、1 601、1 572、1 467、1 136、1 120、1 108、838 cm-1。MS(ESI)m/z=268.01[M]+。1H-NMR(DMSO,300MHz)δ:3.81(s,3H,-OCH3),6.21(s,1H,H-8),7.11(s,1H,H-5),7.15(dd,1H,J=2.2Hz,H-4’),7.22(d,2H,J=8.0Hz,H-3’,5’),7.43(d,2H,J=8.0Hz,H-2’,6’),8.03(s,1H),8.36(s,1H,7-OH)。13C-NMR(DMSO,400 MHz)δ:56.3(6-OCH3),107.2(C-8),117.3(C-5),118.6(C-10),122.8(C-3),126.9(C-2’,6’),128.4(C-4’),130.8(C-3’,5’),123.2(C-3),131.9(C-1’),152.1(C-9),157.5(C-7),158.2(C-2),180.8(C-4,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[8]报道基本一致,故鉴定为6-甲氧基-7羟基-异黄酮。
化合物5:无色针状粉末,分子式为C7H6O3,mp:158~159 ℃。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示在3 642cm-1处有羟基的最大吸收峰。1H-NMR(CD3OD,400MHz)δ11.19(s,1H,-COOH)显示有活泼氢。1H-NMR(CD3OD,400 MHz)谱芳香区中信号中在低场区有4组芳香氢质子信号:δ7.79(dd,1H,J=8.0Hz,H-6),7.51(d,1H,J=7.9,7.5Hz,H-4),7.01(d,1H,J=8.0Hz,H-3),6.89(d,1H,J=7.9,7.2Hz,H-5)提示分子中存在苯环的1,2-二取代。EI-MS:m/z 137.1[M]+。13C-NMR(CD3OD,100MHz)δ:113.5(C-1),118.2(C-3),132.1(C-6),135.9(C-4),162.5(C-2),173.1(-COOH)。以上化合物的物理和化学性质以及光谱数据与文献[9]报道基本一致,故鉴定为邻羟基苯甲酸,又名水杨酸。
化合物6:淡黄色针状,分子式为C17H14O5,mp:138~139 ℃。化合物通过盐酸-镁粉的试验,试验结果为阳性,提示此化合物为黄酮类成分。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示在3 510cm-1处有羟基的最大吸收,在1 728 cm-1有羰基吸收峰。苯环吸收:1 637、1 598、1 511、1 453 cm-1。EI-MS:m/z 299.1[M+H]+。1H-NMR(CD3OD,400MHz)δ:3.75(s,3H,-OCH3),3.8(s,3H,-OCH3),6.76(d,2H,H-3’,-5’),6.81(d,1H,H-8),6.84(d,1H,H-7),7.22(d,2H,H-2’,-6’),7.25(s,1H,H-5),14.1(s,1H,-OH)。在较高场中出现的强单峰结合化学位移和碳谱13C-NMR(DMSO-d6,100MHz)中所显示的δ55.8两峰,说明该分子中有两个-OCH3,其质子信为δ3.80(s,6H)。13C-NMR(DMSO-d6,100MHz)δ:55.8(2-OCH3),116.3(C-3’,5’),117.3(C-5),118.9(C-8),128.4(C-2’,6’),121.7(C-7),125.6(C-4),137.3(C-2),150.1(C-9),155.4(C-6),159.4(C-4’),161.1(C-1),179.5(C-3,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[10-11]报道基本一致,故鉴定为6-甲氧基-2-(4’-甲氧基苯基)-3-羟黄酮。
化合物7:白色蜡状固体,分子式为C18H36O2,mp:23~24 ℃,薄层色谱法显示:在碘蒸气下有一单红色斑点,固体化合物可溶于石油醚、乙酸乙酯中。MS(ESI)m/z=284[M]+。1H-NMR(DMSO,300MHz)δ:1.04(3H,t,J=8.0 Hz,-CH3),1.28(3H,t,J=8.0 Hz,-CH3),1.31(24H,t,J=7.8 Hz,-CH2),2.34(2H,t,J=8.3 Hz,-CH2COO),4.28(2H,t,J=8.0 Hz,-COOCH2)。13C-NMR(DMSO,400 MHz)δ:179.5(C=O),64.31(C-2’,CH2),34.21(C-2,CH2),26.54~30.04,26.54,29.15,29.87(C-3-15,CH2),15.21(C-16,-CH3)。以上化合物的物理和化学性质以及光谱数据与文献[12]报道基本一致,故鉴定为棕榈酸乙酯。
化合物8:淡黄色针状,分子式为C16H12O4,mp:280~282 ℃。化合物通过盐酸-镁粉的试验,试验结果为阳性,提示此化合物为黄酮类成分。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示,在3 615 cm-1处有羟基最大吸收。C=O的吸收峰在1 619 cm-1和1 688 cm-1处。苯环吸收:1 592、1 602、1 578、1 460、1 123、1 118、1 103、821 cm-1(苯环C=C伸缩振动);MS(ESI)m/z=268.03[M]+。1H-NMR(DMSO,300 MHz)谱中芳香区有4个氢信号显示为δ:6.75(d,2H,J=2.0 Hz,H-3’,5’)、7.21(d,2H,J=2.0 Hz,H-2’,6’),是典型的AA’BB’系统,说明该结构为对位取代的苯环,对应的碳信号在13C-NMR(DMSO,400MHz)谱中显示为δ:115.6(C-3’,5’)、127.7(C-2’,6’)。1H-NMR(DMSO,300 MHz)δ:3.86(s,3H,-OCH3),6.75(d,2H,J=2.0Hz,H-3’,5’),6.90(d,1H,J=8.0Hz,H-8),7.13(dd,1H,J=2.3 Hz,H-6),7.21(d,2H,J=2.0 Hz,H-2’,6’),7.43(d,1H,J=8.0 Hz,H-7),7.79(d,1H,J=8.0 Hz,H-5),8.56(s,1H,4’-OH)。13C-NMR(DMSO,400 MHz)δ:58.3(3-OCH3),115.6(C-3’,5’),119.5(C-8),122.8(C-6),123.8(C-1’),125.1(C-10),127.7(C-2’,6’),131.4(C-5),140.2(C-7),141.9(C-3),156.7(C-2),157.5(C-9),158.4(C-4’),179.2(C-4,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[13]报道基本一致,故鉴定为3-甲氧基-4’-羟黄酮。
化合物9:黄色针状结晶,分子式为C17H14O4,mp:228~230 ℃。化合物通过盐酸-镁粉的试验,试验结果为阳性,提示此化合物为黄酮类成分。薄层色谱法:用5%FeCl3溶液为显色剂,试验结果显示蓝黑色,提示此化合物含有酚羟基。IR(KBr)光谱显示在3 158 cm-1处有羟基的最大吸收峰,1 725 cm-1有羰基吸收峰。在较高场中出现了强单峰,通过化学位移和碳谱13C-NMR(DMSO,400MHz)数据显示的δ58.6说明该结构中存在-OCH3,其质子的信号为:3.80(s,3H,-OCH3)。苯环吸收:1 701、1 619、1 543、1 427、1 301、1 257、1 229、849 cm-1。UV(乙醇)nm:219,295。MS(ESI)m/z:283.07[M+1]。1H-NMR(DMSO,300 MHz)谱中芳香区有4个氢信号显示为δ:6.81(d,2H,J=2.2 Hz,H-3’,-5’)、7.25(d,2H,J=8.2 Hz,H-2’,-6’),是典型的AA’BB’系统,说明该结构为对位取代的苯环,其对应的碳信号于13C-NMR(DMSO,400MHz)谱中显示为δ:128.3(C-2’,6’)、115.7(C-3’,5’)。1H-NMR(DMSO,300MHz)δ:2.31(s,3H,H-2),3.80(s,3H,H-4’),6.05(s,1H,OH),6.85(s,1H,H-8),6.81(d,2H,J=2.2 Hz,H-3’,-5’),6.97(d,1H,J=8.0 Hz,H-6),7.25(d,2H,J=8.2 Hz,H-2’,-6’),7.81(d,1H,J=7.8 Hz,H-5)。13C-NMR(DMSO,400 MHz)δ:20.1(C-CH3),58.6(4’-OCH3),107.2(C-8),110.1(C-6),113.5(C-3),115.7(C-3’,5’),118.2(C-10),125.1(C-1’),128.3(C-2’,6’),131.9(C-5),155.3(C-2),158.2(C-9),159.8(C-4’),168.3(C-7),179.5(C-4,C=O)。以上化合物的物理和化学性质以及光谱数据与文献[14]报道基本一致,故鉴定为4’-甲氧基-2-甲基-7-羟异黄酮。
2.3 齿瓣石豆兰乙醇提物对人慢性白血病K562细胞、人结肠癌HT-29细胞和人乳腺癌MCF-7细胞株的抑瘤活性的影响
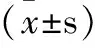
由表1可见,齿瓣石豆兰醇提物给药后小鼠体重正常,与阴性对照组比较无统计学差异(P=0.75,0.36,0.39,均>0.05),给DDP(1 mg·kg-1)后小鼠体重明显减轻,为(17.73±1.63)g,与阴性对照组比较差异具有统计学意义(P<0.01)。各实验组分别给予齿瓣石豆兰醇提物10 mg·kg-1、20 mg·kg-1、40 mg·kg-1三种浓度后,瘤重分别为(1.55±0.680)、(1.97±0.34)、(0.17±0.38)g,与阴性对照组比较差异具有统计学意义(P=0.018,0.002,0.001,均<0.01)。K562、HT-29、MCF-7三种肿瘤细胞生长明显受到抑制,且呈现出较好的剂量依赖性。
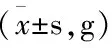
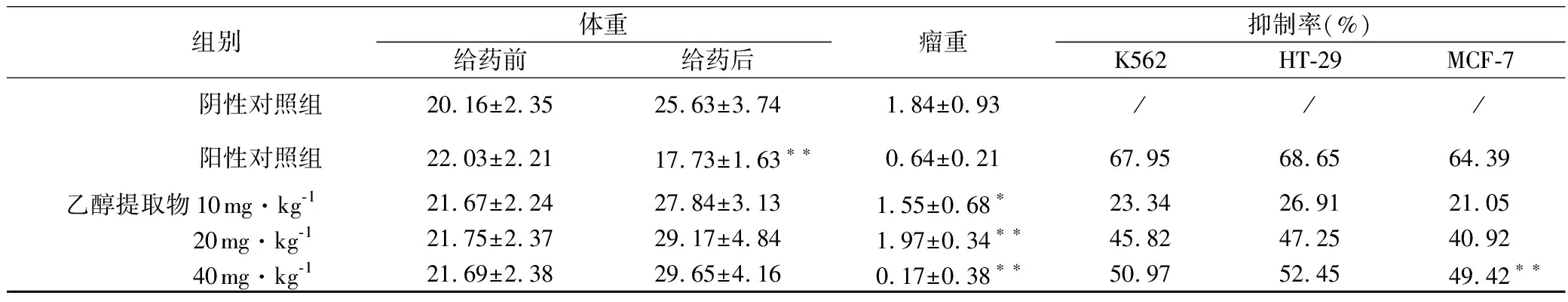
组别体重给药前给药后瘤重抑制率(%)K562HT-29MCF-7 阴性对照组20.16±2.3525.63±3.741.84±0.93/// 阳性对照组22.03±2.2117.73±1.63∗∗0.64±0.2167.9568.6564.39乙醇提取物10mg·kg-121.67±2.2427.84±3.131.55±0.68∗23.3426.9121.05 20mg·kg-121.75±2.3729.17±4.841.97±0.34∗∗45.8247.2540.92 40mg·kg-121.69±2.3829.65±4.160.17±0.38∗∗50.9752.4549.42∗∗
注:与阴性对照组比较,**P<0.01;与阴性对照组比较,*P<0.05。
2.4 抗肿瘤活性研究
采用MTT法[16],以化合物1~9(4个不同浓度)为供试药物对K562、MCF-7进行体外抗肿瘤试验,结果见表2。表2显示:化合物7抗肿瘤活性较弱,化合物2、3、5几乎没有抑制K562、MCF-7细胞生长的作用,对K562、MCF-7的抑制率较低。化合物5、7在低浓度下甚至可刺激两种细胞的生长。化合物1、4、6、8、9能明显抑制K562、MCF-7细胞的生长,抗肿瘤活性较好,且同一化合物在相同浓度下对MCF-7抑制作用更好,可能是由于黄酮类化合物可明显抑制K562、MCF-7生长,作用机制有待进一步研究。
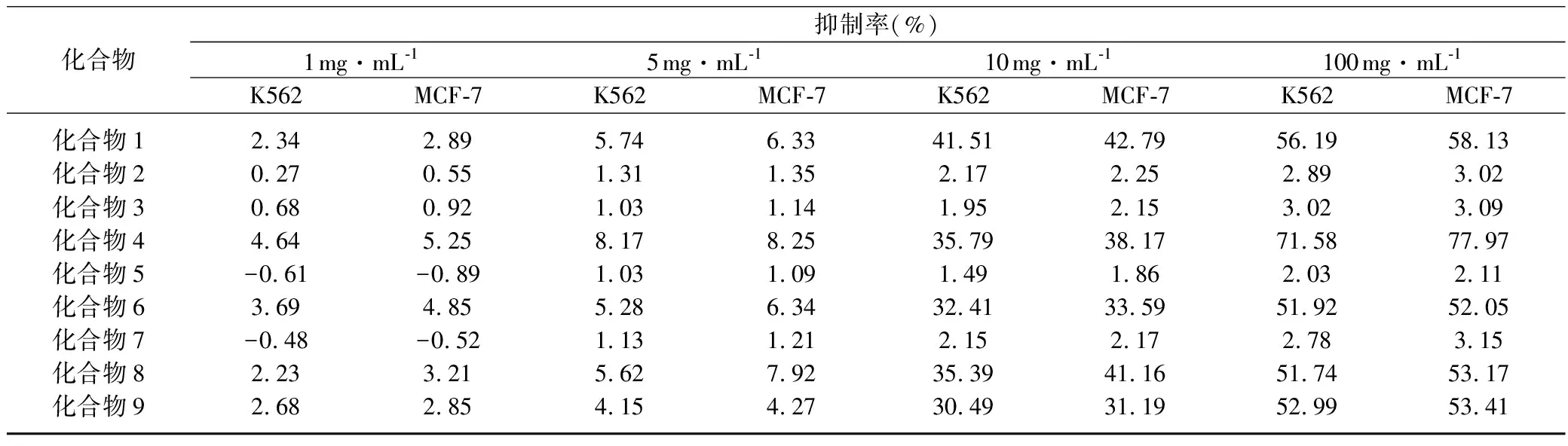
表2 化合物1-9对K562、MCF-7细胞的抑制作用
3 讨论
齿瓣石豆兰全草具有较高的药用价值,具有养胃生津、祛风除湿、消肿止痛、清热化痰、舒筋骨、凉血活血的功效。本研究对齿瓣石豆兰的乙醇提取部分进行了分离及鉴定,将乙醇提取物经硅胶柱层析、薄层层析、LH-20型葡聚糖凝胶(Sephadex LH-20)柱色谱分离和重结晶等方法进行分离纯化后得到9个单体化合物,并根据化合物的特有物理和化学性质以及化合物的波谱数据,鉴定其结构分别为化合物1:7-羟基-3-(4’-羟苯基)异黄酮;化合物2:槲皮素;化合物3:2-甲氧基-1-羟基苯甲醛;化合物4:6-甲氧基-7羟基-异黄酮;化合物5:邻羟基苯甲酸;化合物6:6-甲氧基-2-(4’-甲氧基苯基)-3-羟黄酮;化合物7:棕榈酸乙酯;化合物8:3-甲氧基-4’-羟黄酮;化合物9:4’-甲氧基-2-甲基-7-羟异黄酮。所有化合物均为首次从齿瓣石豆兰全草中分离得到。其中化合物1、8、9为首次报道。采用MTT方法筛选具有明显抗肿瘤活性的化合物,结果显示化合物1、4、6、8、9具有较好的抗肿瘤活性,对K562、HT-29、MCF-7三种肿瘤细胞生长有明显的抑制作用,并呈现出较好的剂量依赖性。
本研究结果丰富了传统中药齿瓣石豆兰的活性成分以及抗肿瘤活性研究,并对黄酮类化合物抗肿瘤的作用机制研究具有一定的参考价值,为今后齿瓣石豆兰化学成分的药理活性研究提供了理论依据。
