低温胁迫肌原纤维蛋白结构和热稳定性的变化
2019-05-18李芳菲邓思杨夏秀芳
李芳菲 王 博 石 硕 潘 男 邓思杨 夏秀芳
(东北农业大学食品学院 哈尔滨150030)
肉品的保藏方法很多,目前应用最广泛、效果最好、最安全的是低温处理,即肉的冷冻[1]。冷冻能抑制微生物生长繁殖、抑制酶的活性,以延长食品的货架期,然而冻藏温度和时间直接影响食品中的冰晶大小、分布,进而影响解冻过程渗出物的多少和最终食品的质量[2]。
冻藏虽然是比较有效的保藏肉类食品的方法,但是冻藏过程中肉类质量也会变坏,如脱水、质量损失、汁液流失、变硬、微生物污染和自溶等[3]。在此过程中最主要的变化是肌原纤维蛋白的变性以及由此引起蛋白质结构特性和功能性的下降[4]。Benjakl[5]研究了蟹冻藏在-20 ℃条件下的物理和化学变化:ATPase 活性、表面疏水性、蛋白质溶解性、pH 值均不断降低,疏基含量减少、二硫键和甲醛的含量不断增加。Benjkl[6]发现冰藏过程中蛇鳍肌肉蛋白的Ca2+-ATPase 酶的活性逐渐降低,Mg2+-EGAT-ATPase 酶活性逐渐提高。Subramanian[7]用差式热量扫描仪研究了快速冻结、缓慢冻结对虾肌肉蛋白热稳定性没有明显的影响;Thanonkaew[8]发现乌贼肉糜-18 ℃肌球蛋白不断变性使蛋白质的保水性明显降低。目前大多数研究冻藏方式对肌肉质量的影响多集中在水产品 (各类鱼、虾)上,而对红肉(如猪肉)质量影响的研究相对较少,尤其对肌肉的结构特性和热稳定性的影响。当今的食品工业需要大量的冻结肉作为原料,为了保证肉制品加工业稳定并获得高质量的原料肉,使质量好的冻结肉在解冻后仍然保持良好的品质,就必须选择适当的冻藏温度和冻藏时间[9]。
本文以猪肉为研究对像,通过测定猪肉肌原纤维蛋白巯基含量、ATPase 活性和DSC 随冻藏温度和冻藏时间的变化情况,探讨低温胁迫下对肌原纤维蛋白结构和热稳定性的影响情况,为实际生产提供依据。
1 材料与方法
1.1 材料与试剂
原料肉是来自北大荒肉业宰后冷却24 h 的长白猪背最长肌,放入2 倍体积的冰中运到东北农业大学食品学院实验室。试验所用试剂均为分析纯,购于哈尔滨市万太生物药品公司。
1.2 仪器与设备
AL-104 型精密电子天平,常州万泰天平仪器有限公司;DK-8B 型电热恒温水浴锅,西化仪科技有限公司;pHS-25 型pH 计,上海精科雷磁仪器厂;TGL-16C 型高速离心机,上海安亭科学仪器厂;TU-1800 紫外可见光分光光度计,济南博鑫生物技术有限公司;T18 高速匀浆机,德国IKA 公司;PE Pyris 6 差示量热仪DSC,美国生产;VE-180 垂直电泳槽,上海天能科技有限公司;BIORAD 电泳仪,美国生产;凝胶成像系统,上海天能科技有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取 选取猪背部最长肌,去除可见脂肪和结蹄组织后,将瘦肉切成小块绞碎备用。提取参照Liu 等人[10]的方法并略加修改,将肉糜放入预冷的烧杯中称重,加入4 倍体积的提取液 (10 mmol/L 磷酸盐、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EGTA,pH 7.0)匀浆60 s,在4 ℃、3 500 r/min 条件下冷冻离心15min,取沉淀,以同样方法再提取两次,将沉淀中加入4 倍体积洗液(0.1 mol/L NaCl)匀浆60 s,在4 ℃、3 500 r/min 条件下冷冻离心15 min,去上清液,重复洗1 次,去上清液后再加4 倍体积洗液,匀浆60 s,4 层纱布过滤,用0.1 mol/L HCl 调pH 值至6.0,冷冻离心15 min(3 500 r/min,4 ℃),得到沉淀即为肌原纤维蛋白,在4 ℃储存备用,存储时间不得超过48 h。用双缩脲法测定其蛋白含量。整个提取过程需在4 ℃条件下完成。
1.3.2 蛋白质ATPase 酶活性的测定 肌原纤维蛋白ATPase 酶活性按Wells 等[11]和Katoh 等[12]的方法进行测定,肌原纤维蛋白配制成3.0 mg/mL 的溶液,酶活性用μmolPi/mg Pro 来表示。不同浓度的磷酸二氢钠(0.0~1.0 mmol/L)做标准曲线计算磷酸盐含量。
①标准曲线 磷酸盐的标准曲线见图1。
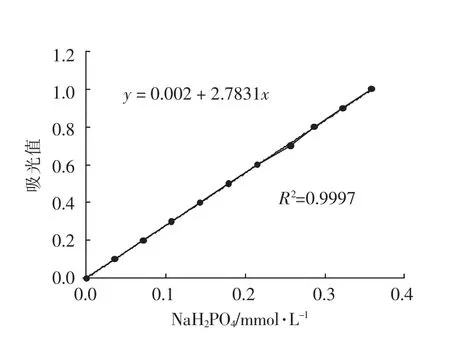
图1 磷酸盐的标准曲线Fig.1 Standard curve of phosphate
②Ca2+-ATPase 酶活性的测定
0.2 mL 肌原纤维蛋白的溶液 (3.0 mg/mL)加入2 mL Ca2+-ATPase 反应液 (7.6 mmol/L ATP,15 mmol/L CaCl2·2H2O,150 mmol/L KCl,180 mmol/L Tris-HCl,pH 7.4,25 ℃)反应10 min,加入1.0 mL 10%三氯乙酸使反应停止,然后2 500 g离心5 min 去除沉淀,取1.0 mL 上清液加入3.0 mL 0.66%的钼酸铵(溶解在0.75 N 硫酸中),混合后加入0.5 mL 新配制的10% FeSO4溶液,反应2 min 后在700 nm 处测定吸光值。
将Ca2+-ATPase 反应液中150 mmol/L KCl 和15 mmol/L CaCl2分别用0.3 mol/L KCl 和5.0 mmol/L EDTA 代替配制成K+-ATPase 反应液,步骤同Ca2+-ATPase 酶活性的测定。
1.3.3 活性巯基和总巯基含量的测定 蛋白质发生氧化可使巯基 (SH-)形成二硫键 (-S-S-),所以活性巯基和总巯基含量可以作为蛋白氧化的一个重要指标。
①活性巯基含量的测定 取1 mL 质量分数为2%的MPI 溶液用8 mL Tris-甘氨酸溶液处理(pH=8,含有10.4 g Tris,6.9 g 甘氨酸,1.2 g EDTA/L)然后经均质和10 000 r/min 离心15 min,除去不溶性蛋白。上清液中取4.5 mL 和0.5 mL 10 mmol/L Ellman 试剂反应(此试剂制备含有4 mg/mL 的2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DTNB),用pH=8.0 Tris-甘氨酸缓冲液),空白中含有4.5 mL Tris-甘氨酸和0.5 mL 10 mmol/L Ellman 试剂,反应30 min 后利用UV 分光光度计分别在412 nm 和540 nm 处测量吸光值。
活性巯基含量由下式估算:
μmoL SH/g WPI=73.53×(AB412-1.6934×AB540+0.009923)/mg MPI
②总巯基含量的测定 蛋白质的总巯基基团含量的测定,是参考Simplicio 等[13]描述的Ellman 方法,使用DTNB 进行测定,方法如下:取1 mL 质量分数为2%的MPI 溶液用8 mL Tris-甘氨酸溶液处理(pH 8,每升该溶液中含有10.4 g Tris,6.9 g 甘氨酸,1.2 g EDTA,8 moL 尿素),然后经均质和10 000 r/min 离心15 min,除去不溶性蛋白。上清液中总巯基含量按照Ellman 方法测定。4.5 mL 上述样品和0.5 mL 10 mmol/L Ellman 试剂反应,30 min 后利用UV 分光光度计在412 nm 处测定吸光值,巯基浓度计算使用摩尔消光系数13 600(mol/L)-1·cm-1,被溶解的蛋白含量使用双缩脲法测定。对照组不加蛋白溶液,其它处理方法相同。
1.3.4 肌原纤维蛋白质的聚合和小片化 肌原纤维蛋白质氧化后可能发生聚合和小片化,可以采用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)来分析氧化前后蛋白质的变化。SDS-PAGE:参照Laemml[14]电泳方法,分离胶质量分数10%,浓缩胶质量分数5%,电极缓冲液含 0.05 mol/L Tris,0.384 mol/L 甘氨酸,0.1%SDS(pH 8.3),电泳样品用样品溶解液(内含 4%SDS,10%的β-巯基乙醇或50 mmol/L N-乙基顺丁烯二酰亚胺(NEMI),20%甘油,0.02%溴酚蓝,0.125 mol/L Tris-HCl 缓冲液,pH 6.8)配制成最终蛋白质量浓度为1 mg/mL,振动混合1 min,100 ℃水浴3 min。电泳采用1 mm 凝胶板;上样量12 μL;开始电泳时电流20 mA,待样品进入分离胶后改为40 mA;取出胶片用考玛斯亮蓝染色3 h(染色液含有50%的甲醇,6.8%的冰醋酸和1 mg/mL的考马斯亮蓝),用甲醇/冰醋酸脱色液脱至透明(脱色液中含有5%的甲醇和7.5%的冰醋酸)。电泳胶片置于天能凝胶成像仪摄像,结合Tanon 软件进行分析和处理。SDS-PAGE 标准分子质量蛋白由中科院上海生物化学研究所提供。标准分子质量蛋白如下:肌球蛋白(猪),分子质量(MW)为200 ku;β-半乳糖苷酶、大肠杆菌,分子质量为116 ku;磷酸酶b(兔子肌肉),分子质量为97.2 ku;牛血清白蛋白,分子质量为66.4 ku;卵清蛋白(鸡蛋白),分子质量为44.3 ku;碳酸苷酶(牛),分子质量为29.0 ku;胰蛋白酶抑制剂(大豆),分子质量为20.1 ku;溶菌酶 (鸡蛋白),分子质量为14.3 ku;抑制肽(牛),分子质量为6.5 ku。
1.3.5 蛋白质热稳定性的测定 经过冻结后肉中蛋白的结构稳定性会发生变化,通过示差扫描热量计(differential scanning calorimeter,DSC)测定蛋白结构稳定性的变化情况。精确称量肌原纤维蛋白15 mg 放入样品池,放置DSC 仪器的样品支持器上,调整好仪器,用空盒做对照。试验采用的测定温度范围为30~90 ℃,加热速度为10 ℃/min。采用pyris6.0 软件进行数据记录和处理得到DSC曲线,峰值点温度为变性温度,曲线形成的峰包括的面积理论上为蛋白质变性所吸收热量。每个样品重复3 次取平均结果。
1.4 数据分析
每个试验重复3 次。数据统计分析采用Statistix 8.1 (分析软件,St Paul,MN)软件进行,使用Tukey HSD 程序进行差异显著性(P<0.05)分析,采用Sigmaplot 10.0 软件作图。
2 结果与分析
2.1 肌原纤维蛋白ATPase 活性的变化
猪肉肌原纤维蛋白ATPase 活性变化如图2所示。随着冻藏时间的延长肌原纤维蛋白质的Ca2+-ATPase 和K+-ATPase 活性明显降低,其中K+-ATPase 的降低速度比Ca2+-ATPase 快,说明K+-ATPase 对冻藏条件更敏感。
Ca2+-ATPase 在不同冻结温度下均随冻藏时间的延长而下降,且变化趋势基本相似。-5和-18 ℃冻藏1 个月后,Ca2+-ATPase 下降非常明显,分别下降了30.2%和17.2%;-18 ℃冻藏3 个月Ca2+-ATPase 下降不明显,而-5 ℃冻藏明显下降,两个冻藏温度下12 个月时Ca2+-ATPase 分别为0.1256 μmol/mg MPI 和0.1632 μmol/mg MPI,仅为新鲜肉中肌原纤维蛋白Ca2+-ATPase 活性的34.1%和44.4%。这说明猪肉在较高温度下长时间冻藏明显降低肌肉蛋白结构稳定性;-26 和-35℃整个冻藏期内Ca2+-ATPase 活性下降趋势相似,到12 个月时Ca2+-ATPase 活性为0.2025 μmol/mg MPI 和0.2035 μmol/mg MPI,二者差异不显著(P>0.05);-70 ℃冻藏Ca2+-ATPase 活性在前6 个月变化下降了9.6%,贮藏到12 个月时下降了31.2%,与-5 ℃冻藏条件下1 个月(30.2%)相当,且与其它冻藏温度之间存在显著性差异(P<0.05)。
-5 ℃条件下贮藏时K+-ATPase 活性随着时间的增加而明显降低,从新鲜肉的0.2526 μmol/mg MPI 下 降 到0.0568 μmol/mg MPI,下 降 了77.5%;-18,-26,-35 和-70 ℃条件下贮藏时K+-ATPase 活性前3 个月降低较明显,分别下降了42.0%,39.6%,30.0%和25.3%,后期下降较慢,K+-ATPase 下降了60.1%,60.9%,59.2%和50.3%,各温度间差异显著(P<0.05)。这说明K+-ATPase 活性变化与冻藏温度和时间直接相关,冻结温度越高下降得越快、冻藏时间越长下降得越多。
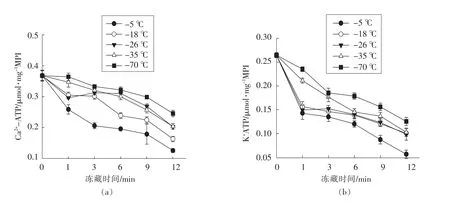
图2 冷冻温度、贮藏时间对猪肉肌原纤维蛋白质ATPase 活性的影响Fig.2 Influence of freezing temperature and times on the ATPase activity of porcine myofibrillar proteins
冻藏过程中肌原纤维蛋白ATPase 活性下降的原因有很多:Ca2+-ATPase 活性的降低是由于肌球蛋白球状头部构象变化和交联引起的。冻结过程由于冰结晶的机械作用使肌球蛋白头部变性,引起ATPase 活性的降低,另外冻藏引起巯基氧化(图3)形成二硫键也会使ATPase 活性下降。曾名湧[15]认为在-10 和-20 ℃下冻藏时罗非鱼肌球蛋白ATPase 活性下降是由于巯基氧化和pH 下降两个因素作用的结果,而在-30 和-40 ℃下冻藏时主要是由于巯基氧化引起的。ATPase 活性下降可能是由于肌球蛋白球状头部发生交联而改变蛋白质的构象[16],也可能是由于冻融过程使蛋白质分子间相互作用面发生重排引起的[17]。Wagner 和Anon[18]发现冻藏中牛肉中肌原纤维蛋白的ATPase活性下降。蛋白质分子间相互交联使蛋白质发生重排也会降低ATPase 活性[19]。
2.2 肌原纤维蛋白巯基含量的变化
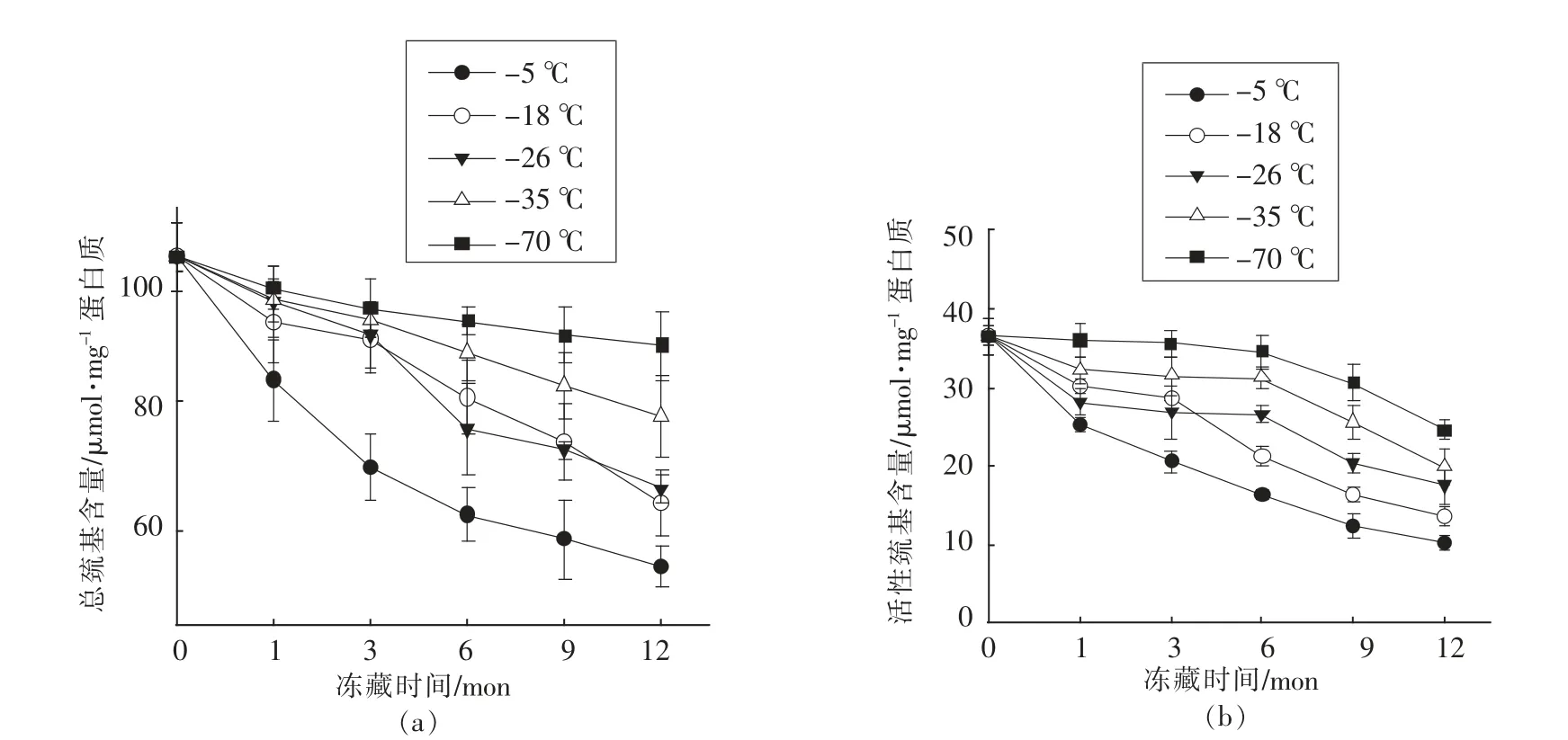
图3 冷冻温度、贮藏时间对猪肉肌原纤维蛋白巯基含量的影响Fig.3 Influence of freezing temperature and times on the sulfhydryl of porcine myofibrillar protein
从图3可以看出冻藏温度和时间对肌原纤维蛋白的巯基含量有显著的影响,随着时间的延长巯基含量降低、冻结温度越高巯基含量下降越快。-5 ℃条件下冻藏1,3,6,9,12 个月时巯基含量随着时间的增加而明显降低,从新鲜肉的102.36 μmol/mg 分 别 下 降 到83.3,69.64,62.36,58.46 和54.23 μmol/mg,其中前3 个月下降更为明显,下降32.0%,贮藏后期下降较缓慢;-18 和-26 ℃两个贮藏温度下总的巯基含量变化差异不显著,分别下降了37.2%和35.2%,只在下降速度上有些差异如在-18 ℃贮藏第1 个月和第3 到6 个月下降较快;-35 和-70 ℃条件下贮藏时巯基含量的变化趋势相似,分别下降了24.1%,13.4%。冻藏-70 ℃条件巯基含量总损失相当于贮藏在-5,-18,-26 和-35℃条件下的1 个月(15.3%)、3 个月(13.7%)、3 个月(12.9%)、6 个月(14.1%)。这说明低温冻藏可减缓巯基含量的变化。总的巯基含量随着时间的延长而降低,这与Sompongse 等[20]研究结果一致,在冰中贮藏的鲤鱼肌动球蛋白总巯基含量降低。总巯基含量减少可能是由于SH 氧化形成二硫化物[21]。在冻藏过程中肌原纤维蛋白巯基含量的下降可能是由于水形成冰结晶后,破坏肌原纤维蛋白的空间结构,使巯基暴露出来,进而被氧化成二硫键使巯基含量下降。Hamre 等[22]研究表明,大眼海鱼在-18 ℃冷藏时,总巯基含量随冷藏时间延长而下降,而二硫键含量却上升。表明二硫键的形成是导致大眼海鱼肉蛋白冷冻变性的重要原因。乌贼冻藏16 周后肌球蛋白的巯基含量随着二硫键增加(从13.10 mol/g 蛋白质增加到15.75 mol/g 蛋白质)而减少 (从5.40 mol/g 蛋白质下降到3.81 mol/g 蛋白质)[23]。
冻藏时间延长、 温度升高活性巯基含量也明显降低,在同一贮藏期各贮藏温度间活性巯基含量变化差异显著(P<0.05),如在第6 个月-5,-18,-26,-35 和-70 ℃的活性巯基含量分别是16.3,21.4,26.7,31.3,34.6 μmol/mg。特别在-70 ℃冻藏3 个月活性巯基含量变化很小,从新鲜肉的36.54到35.63 μmol/mg。Lin 等[24]研究鲭鱼活性巯基含量随着冻藏时间的延长而降低,-20 ℃条件下冻藏0,2,4,6,8 个月后活性巯基的含量分别是30.8,27.5,26.3,24 和22.5 mol/g,即冻藏时间延长肌肉蛋白的活性巯基含量明显降低。
巯基氧化形成二硫键使总的巯基含量降低,肌球蛋白巯基的氧化也会降低ATP 活性,降低肌球蛋白和肌动蛋白的稳定性[25]。肌球蛋白分子中含有活性琉基,这些疏基可分为三类,SH1、SH2、SHa。其中SH1、SH2分布在肌球蛋白的头部,与肌球蛋白的Ca2+-ATPase 活性密切相关。而SHa 位于轻酶解肌球蛋白部分(lightmeromyosin,LMM),与肌球蛋白重链(Myosinheavychain,MHC)的氧化及二聚物的形成密切相关。此外,尚有一些巯基隐藏在肌球蛋白分子内部,总巯基即包括活性巯基和隐藏巯基。Thanonkaew 等[26]研究表明,在冻藏过程中,肌原纤维蛋白的活性巯基被氧化形成二硫键,因此蛋白质的冷冻变性会使其活性巯基或总巯基的含量减少,而二硫键的含量增加,新鲜蓝鳍鱼肉中每105 g 肌动蛋白约含有4 个活性巯基、0.5~1 个隐藏在分子内的巯基和一个二硫键,但在-10 ℃冻藏10 d 后,活性巯基只剩下两个,而二硫键增加了一个,隐藏的巯基含量不变,表明在冻藏中活性巯基氧化成了二硫键。在冻藏过程中蛋白质分子构象变化伴随着活性巯基的暴露,而且活性巯基非常容易氧化形成二硫键。蛋白质变性的实质是巯基和二硫键的变化[27]。
巯基含量下降可能是由于冻藏过程中肌原纤维蛋白空间结构发生改变,分子内部的巯基暴露出来,进而被氧化成二硫键所致,巯基含量快速下降的原因可能与Ca2+-ATPase 活性有关,同时巯基的氧化尤其是位于肌球蛋白头部区域巯基的氧化进一步导致了Ca2+-ATPase 活性的下降[28]。
2.3 肌原纤维蛋白热稳定性的变化
肌原纤维蛋白热稳定性变化如表1所示,Tmax1、Tmax2、Tmax3是肌原纤维蛋白热变性的3个峰值,分别代表肌球蛋白重链、肌球蛋白氢链和肌动蛋白热变性温度;ΔH 表示肌原纤维蛋白的热焓值。冻藏引起肌肉蛋白质热稳定性变化趋势是冻结温度越高热稳定性越差,焓值降低越多;冻结时间越长变性温度下降得越多,焓值降低越快。
冻藏1个月后Tmax1和Tmax3除-5 ℃与新鲜肉相比明显降低(从54.8 ℃下降到53.7 ℃;从76.2℃下降到74.9 ℃),其它温度下变化不明显,这说明肌球蛋白重链和肌动蛋白对-5 ℃条件比较敏感,热稳定性降低;Tmax2只有贮藏在-70 ℃变化较小,其它温度均与新鲜肉相比差异显著(P<0.05),-18~-35 ℃之间无显著性差异 (P>0.05);-35和-70 ℃下焓值变化与新鲜肉无显著性差异(P>0.05),-5,-18 和-26 ℃下焓值变化与新鲜肉显著性差异(P<0.05),分别降低了7.1%,6.8%和8.7%,三者间无显著性差异(P>0.05)。
冻藏6 个月后Tmax1、Tmax2、Tmax3和ΔH 在各冻藏温度下与新鲜肉相比均明显降低,且差异显著(P<0.05)。冻结温度从高到低Tmax1分别是52.5,53.1,52.9,53.6 和54.1 ℃,它们之间存在着显著性差异(P<0.05)。在-5 和-18 ℃条件下贮藏的Tmax2间无差异,-26,-35 和-70 ℃条件下贮藏的Tmax2间也无明显差异,但两组间差异显著;各贮藏温度下的Tmax3差异显著(P<0.05),它们分别是73.7,74.6°,74.2,74.9 和75.3 ℃;-5,-18 和-26 ℃,-35 ℃和-70 ℃的焓值也存在显著性差异(P<0.05),这说明肌原纤维中各种蛋白对冻藏温度和时间的敏感性不一致。
冻藏12 个月后Tmax1、Tmax2、Tmax3和ΔH 在各冻藏温度下与新鲜肉相比也明显降低。冻结温度从高 到 低Tmax1分 别 下 降 了4,2.9,3.1,2 和1.2 ℃,Tmax2分别下降了4.5,3.1,2,2.6 和1.2 ℃,Tmax3分别下降了2.4,2.3,2,2.3 和1.4 ℃,它们之间存在着显著性差异(P<0.05)。冻结温度越低,蛋白质的热稳定性下降得越小,表明蛋白质热稳定越高。ΔH在-5,-18,-26,-35 和-70 ℃条件下贮藏分别下降了69.5%,52.2%,36.5%,34.8%和12.2%,彼此间存在显著性差异(P<0.05),在-5,-18,-26 ℃,冻藏12 个月的肉类,其焓值变化下降分别是-70 ℃的5.71,4.27,2.99 和2.85 倍。
冻结肉的热力学特性主要是由于冰晶能在很广的温度范围内(0~-40 ℃)形成所引起的。DSC提供了一个测量整体组织中所含蛋白质的热稳定,也就是说不需要提取蛋白就能测定其稳定性,因为蛋白质的分离和提取过程也会影响蛋白质的稳定性。Tmax表示蛋白质在加热过程中开始变性的温度,Tmax越小蛋白质的热稳定性越低。Benjakul和Bauer[29]指出冻结也会降低蛋白质的稳定性。
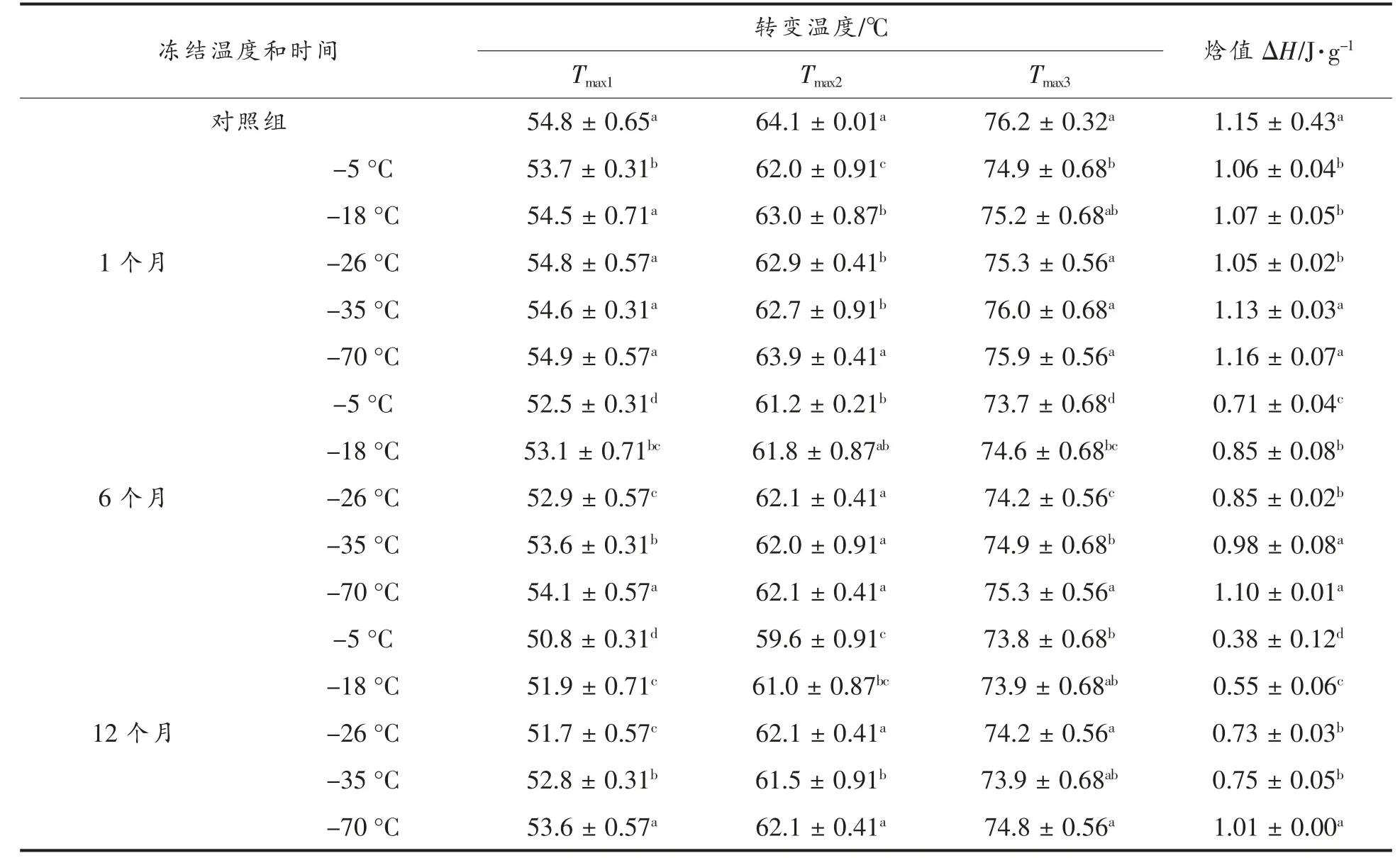
表1 冷冻温度、冻藏时间对猪肉肌原纤维蛋白最大转变温度(Tmax)和焓值(ΔH)的影响Table 1 Influence of freezing temperature and times on maximum transition temperatures (Tmax)and ehthalpy (ΔH)of porcine myofibrillar protein
2.4 SDS-PAGE
从图4和图5可以看出猪肉肌原纤维蛋白在10%的电泳凝胶中的蛋白质条带,它们可能分别是条带a 分子质量为200 ku 肌球蛋白重链(Myosin heavy chain,MHC),条带b 分子质量97.2 ku 的副肌球蛋白(Paparamyosin),条带c 分子质量45 ku 肌动蛋白(Actin),条带d 分子质量40 ku 为原肌球蛋白(Tropomyosin)和条带e 分子质量为36 ku 肌钙蛋白(Troponin)。为了更清楚了解不同的冻结温度和时间对肌原纤维蛋白质的影响,图5是相同的冻藏时间内不同冻结温度进行对比,图4是同一温度下不同贮藏时间蛋白质变化的情况。
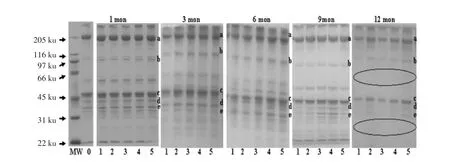
图4 冷冻温度、冻藏时间对猪肉肌原纤维蛋白SDS-PAGE 的影响Fig.4 Influence of freezing temperature and times on the SDS-PAGE pattern of porcine myofibrillar proteins
从图4可以看出,在冻藏1 个月时,不同的冻结温度下肌球蛋白、肌动蛋白、肌钙蛋白条带变化不是很明显,特别是在-70 ℃条件下冻藏与新鲜肉非常相似,而副肌球蛋白、原肌球蛋白条带变淡,冻结温度越高,减少的越明显。冻藏3 个月后,肌球蛋白、肌动蛋白、肌钙蛋白条带、副肌球蛋白、原肌球蛋白条带均变淡,特别是条带e 肌钙蛋白变得非常淡,在-5 ℃条件下冻藏所有条带均明显变淡。冻藏6 个月时,在所有冻藏温度下肌球蛋白、肌动蛋白、肌钙蛋白条带、副肌球蛋白、原肌球蛋白条带也明显变淡,尤其是-5 和-18 ℃条件下的肌球蛋白、肌动蛋白、原肌球蛋白变化十分明显;-5,-18 和-26 ℃冻藏时条带d 原肌球蛋白已消失。冻藏9 个月时,各条带也变淡。冻藏12 个月时,所有冻藏温度下(除-70 ℃)只有肌球蛋白、副肌球蛋白、肌动蛋白3 条条带,肌钙蛋白、原肌球蛋白条带消失,同时出现2 个空白区域,这说明冻藏时间对肌肉蛋白质有明显的影响。在同一贮藏时间下,蛋白质条带随着冻结温度的升高而变淡,条带变淡说明蛋白质发生了降解。
从图5主要说明了同一冻结温度下不同时间对蛋白质含量的影响。在-5 ℃条件下冻结,肌球蛋白、副肌球蛋白、肌动蛋白、肌钙蛋白和原肌球蛋白条带随冻藏时间的延长而明显变淡,冻结到12个月时只剩下了条带a 和c,副肌球蛋白、原肌球蛋白和肌钙蛋白消失;冻结时间越长,变淡的趋势越明显。在-18 ℃冻结,贮藏3 个月时蛋白质条带变化不明显;到第6 个月时条带e 消失,说明肉中已不含原肌球蛋白;从6 个月到12 个月条带a、b、c、d 开始明显变淡,说明肌球蛋白、副肌球蛋白、肌动蛋白、肌钙蛋白在冻藏过程中逐渐降解。在-26 ℃冻结,贮藏6 个月各条带变化不是很明显,并开始变淡,冻藏到12 个月时a、b、c、d 明显变淡,e 条带消失,说明在这个温度下冻藏6 个月对蛋白质含量影响不大,冻藏时间再延长肌肉的品质就会受到影响。在-35 ℃冻藏,蛋白质条带变化情况与-26 ℃冻结相似,6 个月内各条带变化不是很明显,贮藏第9 个月时所有条带明显变淡。在-70 ℃冻结,冻藏到12 个月时,e 条带消失,a 和c 变化较慢,条带b 和d 明显变淡,说明在这个温度下冻藏肌原纤维蛋白中主要的两种蛋白肌球蛋白和肌动蛋白变化不是很明显,这也与其它指标的测定相一致,即冻藏过程中蛋白质损失少保证了蛋白质结构的完整性,蛋白质的功能特性变化也小。
从图4和图5可知,猪肉中所含蛋白对冻结温度和时间的敏感程度不同。一般来讲冻藏温度越高(-5 ℃)、冻藏时间越长(12 个月),对肌原纤维蛋白中所含的蛋白含量影响越大。但对于不同的蛋白影响程度还有差异,对于温度和时间最敏感的是条带e 肌钙蛋白,冻结在-5 ℃条件下3 个月明显变淡,9 个月时消失;冻结在-18 ℃条件6个月时消失,-26 和-35 ℃时9 个月消失。肌钙蛋白 (Troponin,TN),它是原肌球蛋白和肌钙蛋白的结合位点,肌动蛋白、原肌球蛋白和肌钙蛋白有规律的结合决定肌肉收缩和舒张,它的损失引起肌肉结构松散,增加蛋白与氧的接触机会,使蛋白质分子发生氧化变性,热稳定性降低。在加工和冻藏教程中肌原纤维蛋白中肌球蛋白比肌动蛋白和肌钙蛋白更容易氧化[27]。通常当二硫键形成时蛋白质开始变性和交联,随后疏水基团和氢键在分子内外发生重排[30]。

图5 冷冻温度、冻藏时间对猪肉肌原纤维蛋白SDS-PAGE 的影响Fig.5 Influence of freezing temperature and times on the SDS-PAGE pattern of porcine myofibrillar proteins
3 结论
通过研究不同冻藏温度和冻藏时间下猪肉肌原纤维蛋白的ATPase 酶活性、巯基含量、SDS-聚丙烯酰氨凝胶电泳和蛋白质的热稳定性,进一步确定蛋白质的变性机制。结果显示,冻藏过程中,肌肉蛋白质结构明显改变,随着冻结温度升高、冻藏的时间越长,蛋白质的总巯基含量、活性巯基含量和ATP 酶活性降低;通过DSC 测定蛋白的热稳定性的结果可知,冻藏过程中肌肉蛋白的热转变温度和焓值均降低,冻结温度越高、 冻藏时间越长,降低得越明显,表明蛋白质热稳定性越差;肌原纤维蛋白SDS-PAGE 电泳图谱结果显示,冻藏过程使蛋白质发生不同程度的降解,冻藏时间越长、冻藏温度越高,蛋白质分子降解越明显。因此冻藏过程破坏了肌肉蛋白质的结构,降低了蛋白的功能特性。所以在运输、贮藏、消费过程中应健全冷藏链技术,防止冻藏过程中温度波动,进而减少肌肉品质的劣变,防止肌肉蛋白质结构和功能特性的改变。
