单中心100例经导管主动脉瓣置换(TAVR)结果分析
2019-05-16杨力凡潘文志张晓春陈莎莎金沁纯尹恩知周达新葛均波
杨力凡 潘文志 张晓春 陈莎莎 金沁纯 尹恩知 周达新 葛均波
(复旦大学附属中山医院心内科-上海市心血管病研究所 上海 200032)
随着我国人口老龄化加重,主动脉瓣退行性病变越来越常见。长期以来,外科主动脉瓣置换术是治疗该病的唯一选择,但是由于手术风险大,一些高龄、心功能差的患者丧失了手术机会。经导管主动脉瓣置换(transcatheter aortic valve replacement,TAVR)是治疗主动脉瓣病变的新手段。自2002年Cribier等[1]行首例人体经导管置换人工主动脉瓣膜以来,TAVR逐渐被更多的人接受且适应症越来越广。TAVR在国外已广泛开展,成为一线治疗手段,然而在国内TAVR推广相对缓慢,相关经验相对缺乏。我国主动脉瓣狭窄患者相对西方患者有不同病变特点[2],TAVR在我国缺乏安全性及有效性相关研究。本研究对我中心(复旦大学附属中山医院心内科)前100例TAVR的短期结果进行分析和总结,探讨TAVR对我国患者的安全性及有效性,并总结相关经验。
资料和方法
病例入选连续入选2010年10月至2018年3月在我中心行TAVR的100例主动脉瓣狭窄患者。入选标准:(1)有效瓣口面积≤1.0 cm2和/或平均跨瓣压差≥40 mm Hg(1 mmHg=0.133 kPa,全文同)的重度主动脉瓣狭窄;(2)纽约心脏病协会(New York Heart Association,NYHA)心功能分级≥Ⅱ级;(3)冠脉计算机断层显像显示解剖主动脉根部合适;(4)被拒绝外科手术或者患者不愿意行外科手术。排除标准:(1)未治疗的严重冠脉狭窄;(2)患者一般情况差,预期寿命<12个月;(3)常规心导管手术禁忌,如心脏内血栓、感染、流出道梗阻肥厚型心肌病等。所有患者术前予药物治疗积极改善心功能,完善超声心动图、冠脉计算机断层显像等检查,并签署知情同意书。
手术步骤患者于杂交手术或导管室完成手术。所有患者均采取全身静脉复合麻醉,经食管超声心动图监测下完成手术。首选股动脉入路,次选颈动脉入路。若外周血管入路不满足,则选择经升主动脉途径。穿刺左侧股静脉置入临时起搏器,穿刺左侧股动脉置6F导管用于血液动力学监测及协助定位;使用6F Amplatz-L左冠导管、超滑导丝进入左心室,送入塑为圆圈状的超硬导丝以支撑扩张球囊及瓣膜输送系统。再使用球囊对狭窄的主动脉瓣膜进行球囊预扩张,以猪尾导管最低点作为瓣环参考线,在快速起搏及主动脉根部造影指导下释放自膨胀瓣膜。若瓣膜释放后仍有轻中度及以上瓣周漏或跨瓣峰值压差大于20 mmHg,再使用球囊进行后扩张,术后由经胸及经食道超声心动图评估瓣周漏、瓣膜功能等,具体手术步骤见我中心既往发表文献[3]。术前及术后3天应用抗生素预防感染,术中予适量肝素,使活化凝血时间维持250~350 s,术毕注射鱼精蛋白中和肝素,送至心内科重症监护病房,由TAVR医护小组管理。
观察指标与统计方法术前观察患者年龄、瓣膜形态及直径等;术中观察植入瓣膜直径、前扩张及后扩张球囊大小、瓣膜植入深度;术后观察平均跨瓣压差(mean pressure gradient,MPG)、瓣口面积以及并发症情况;随访指标包括死亡率、起搏器植入人数等。随访30天,先排除术前已植入起搏器患者,根据TAVR术后植入永久性起搏器情况将患者分为起搏器组与非起搏器组,分析两组差异。
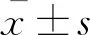
结 果
术前基线特征100例患者,年龄58~90岁,平均(78.1±6.8)岁,其中男性68例,胸外科协会(Society of Thoracic Surgeons,STS)平均分数9.9±6.0,12例患者经颈动脉,87例经股动脉,1例经升主动脉。所有患者均使用自膨胀瓣膜:CoreVale(美国Metroinc公司)8例、VitaFlow瓣膜(上海微创医疗器械有限公司)37例、Venus-A瓣膜(杭州启明医疗器械有限公司)55例。二叶式瓣膜47例,三叶式52例,生物瓣1例。
患者心功能Ⅱ级36例,Ⅲ级47例,Ⅳ级15例,平均左心室射血分数(left ventricular ejection fraction,LVEF)为55.8%±11.4%,主动脉瓣跨瓣压差范围20~109 mmHg,MPG为(51.3±19.7)mmgHg,平均瓣口面积为(0.6±0.2)cm2。术前CTA测量主动脉瓣瓣环直径的平均值为(25.3±2.7)mm。
术中情况手术成功率为97%,2例患者因瓣膜释放位置过高出现瓣膜移位脱落转入外科,1例术中抢救无效死亡。术中发生心脏骤停4例,均予心外按压,经快速球囊扩张或释放瓣膜后抢救成功,并植入瓣膜。1例患者因植入瓣膜压迫冠状动脉出现冠脉阻塞,术中紧急行冠脉搭桥术。术中有90例患者采用球囊预扩张,球囊平均直径(19.6±2.0)mm,其中69例球囊直径≤20 mm。39例患者采用球囊后扩张,球囊平均直径(21.4±2.2)mm。1例患者植入1个瓣膜后仍有严重瓣周漏,再次植入1个瓣膜(瓣中瓣),其余患者均植入1个瓣膜。植入人工主动脉瓣瓣环平均直径为(26.5±2.1)mm,平均植入深度为瓣环下(4.3±3.4)mm。
住院期间随访术后患者跨瓣压差为3~32 mmHg,术前、术后平均跨主动脉瓣压分别为(51.3±19.7)mmHg和(11.7±6.1)mmHg,术前、术后瓣口面积分别为(0.6±0.2)cm2和(1.7±0.5)cm2,差异均有统计学意义(P<0.001)。肺动脉压力显著下降[(46.4±13.9)mmHgvs.(38.4±9.7)mmHg,P<0.001],LVEF显著增加(55.8%±11.4%vs.59.8%±9.5%,P=0.008)。术后即刻中度瓣周漏(perivalvular leakage,PVL)1例,轻中度PVL 3例,轻度PVL 12例,轻微PVL 84例,无重度PVL。出现快速性心律失常5例(5%),束支及房室传导阻滞18例(18%)。大量心包积液1例(1%),脑卒中1例(1%),静脉血栓2例(2%),发热及肺部感染18例(18%),急性肾损伤1例(1%),消化道出血3例(3%),胸腔积液、皮疹、尿路损伤等并发症9例。其中1例因主动脉夹层,术后第5天抢救无效死亡,其余患者治疗后均康复出院。
术后30天随访死亡率为2%,包括上述1例术中死亡、1例住院期间死亡。术后30天中度PVL 1例,轻中度PVL 11例,轻度PVL 41例,轻微PVL 47例,无重度PVL。主动脉MPG、肺动脉压力与术后即刻相比无明显变化(P均>0.05)。永久心脏起搏器植入9例(9%)。术后起搏器组9例,非起搏器组86例;两组瓣膜植入深度分别为(7.2±3.1)mm和(4.2±3.3)mm,差异有统计学意义(P=0.011);术前预扩张球囊直径分别为(20.7±2.0)mm和(19.4±2.0)mm,差异无统计学意义(P=0.076)。
二叶式与三叶式主动脉瓣膜的比较将患者分为二叶式主动脉瓣膜组与三叶式主动脉瓣膜组,并进行对比分析。二叶式主动脉瓣膜组年龄更轻[(76.2±6.5)岁vs.(79.7±6.6)岁,P=0.012],瓣口面积更小[(0.6±0.2)cm2vs.(0.7±0.2)cm2,P=0.007],余基线特征无差异(表1)。两组在MPG [(11.3±5.9)mmHgvs.(11.8±6.1)mmHg,P=0.664]、瓣口面积[(1.8±0.4)cm2vs.(1.8±0.3)cm2,P=0.29]等血流动力学方面,以及起搏器植入率(6.4%vs.11.5%,P=0.373)等并发症方面的差异均无统计学意义(表2)。
讨 论
中国主动脉瓣狭窄患者病理特点与国外患者有明显不同,我国的TAVR患者瓣膜钙化程度较西方人群严重,且主动脉瓣膜的二叶式形态比三叶式更多[4],所以国外TAVR数据及经验不能直接完全运用到国内患者。我中心100例TAVR数据结果提示二叶式患者为47%。随着TAVR手术适应证逐渐年轻化,二叶式患者可能越来越多。国内一项研究纳入215名主动脉狭窄患者,在TAVR患者中,二叶式主动脉瓣狭窄所占比例为44%[4]。
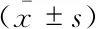
表1 二叶式主动脉瓣组与三叶式主动脉瓣组患者术前基本特征比较Tab 1 The comparison of bicuspid aortic valve and tricuspid aortic valve
LVEF:Left ventricular ejection fraction;MPG:Mean pressure gradient;STS:Society of Thoracic Surgeons’s.
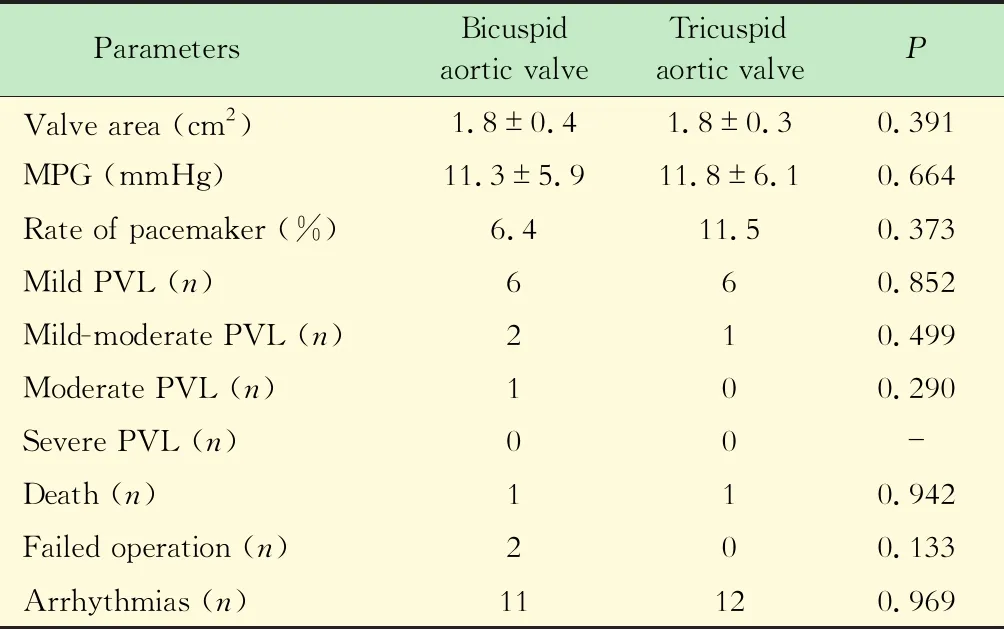
表2 二叶式主动脉瓣组与三叶式主动脉瓣组患者术后血流动力学及主要并发证比较Tab 2 The comparison of hemodynamics and complications between bicuspid aortic valve and tricuspid aortic valve in post-operation
MPG:Mean pressure gradient;PVL:Perivalvular leakage.
二叶式主动脉瓣狭窄通常合并瓣环扩大,主动脉迂曲畸形,增加了手术难度和术后血管并发症,TAVR术前评估主动脉钙化程度、动脉粥样硬化、主动脉扩张、血管迂曲、STS评分等,是手术成功的关键[2]。本研究显示,虽然二叶式主动脉瓣膜患者平均年龄和瓣膜面积比三叶式患者小,但是两种瓣膜的钙化程度、MPG、瓣环直径、STS评分、LVEF、术后死亡率以及各种并发症并无显著性差异。国内其他中心的研究也显示二叶瓣患者TAVR疗效不劣于三叶瓣,因此,《经导管主动脉瓣置换术中国专家共识》建议:二叶式主动脉瓣伴重度狭窄、外科手术禁忌、存在主动脉瓣狭窄相关性症状、预期术后寿命超过1年、解剖上适合TAVR的患者均可于有经验的中心尝试TAVR[5]。
本研究纳入100例患者,手术成功率97%,TAVR术后主动脉瓣膜MPG由51.3 mmHg显著下降至11.7 mmHg,LVEF和肺动脉压力均有显著改善。术后即刻中度PVL 1例,轻中度PVL 6例,轻度PVL 48例,轻微PVL 33例,无重度PVL,说明本中心TAVR有很好效果。本研究入组患者平均年龄78.1岁,平均STS评分9.9±6.0,说明患者大部分是外科手术高危患者。相比于国外类似人群、使用自膨胀瓣膜的大型临床研究,本研究中术后30天死亡率(2%)及脑卒中发生率(1%)较低。美国CoreValve极高危队列研究中STS评分10.3±5.5,30天死亡率8.4%,中风4.0%[6]。美国CoreValve高危人群随机对照研究中STS评分7.3±3.0,30天死亡率3.3%,中风4.9%[7]。我们的结果与更低危、最新的SURTAVI研究结果相近,该研究STS 4.4±1.5分,30天死亡率2.0%,中风3.4%[8]。本研究患者30天死亡率较低,可能与入组患者年龄相对年轻、严重PVL发生率较低有关。
术后传导异常导致永久起搏器植入是TAVR常见的并发症。我中心永久起搏器植入率为9.0%,明显低于国内外自膨胀瓣膜研究的结果,包括CoreValve极高危队列研究(21.6%)[6]、CoreValve高危人群随机对照研究(19.8%)[7]、SURTAVI研究(25.9%)[8]、NOTION研究(34.1%)[9]、国内Venus A上市前研究(18.8%)[10]以及VitaFlow上市前研究(16.4%)。
瓣膜释放时精准定位以及释放深度是植入起搏器的原因[11]。大量研究认为瓣膜目标深度为6 mm[12],最新REPRESE Ⅱ研究认为起搏器植入深度<5 mm比≥5 mm的发生率低[13]。我中心的TAVR瓣膜平均释放深度为瓣环下(4.3±3.4)mm,术后起搏器组与非起搏器组的瓣膜植入深度分别为(7.2±3.1)mm和(4.2±3.3)mm(P=0.011)。然而,在本研究100例TAVR患者中,有19例患者瓣膜植入深度大于6 mm,并未发生严重的传导阻滞,我们推测起搏器植入和选用较小球囊扩张有关。
球囊预扩张也是引起起搏器植入的因素之一[11],一半左右传导阻滞发生在主动脉瓣球囊扩张时[14]。本研究术中球囊预扩张为90%,术后30天起搏器植入率仅为9%。患者术前CTA测量瓣环平均直径为(25.3±2.7)mm,术中预张球囊平均直径为(19.6±2.0)mm,其中69例球囊直径≤20 mm,后扩张球囊直径为(21.4±2.2)mm。相对于目前国内其他中心经常使用的20~25 mm球囊预扩张,本中心预扩张及后扩张球囊直径较小,这可能是引起起搏器植入率偏低的原因之一。同时,小球囊还可减少冠脉堵塞和主动脉瓣环破裂风险[15]。本文术后起搏器组预扩张球囊较非起搏器组的球囊直径有增大的趋势[(20.7±2.0)mmvs.(19.4±2.0)mm,P=0.076],也提示预扩张球囊尺寸可能是TAVR起搏器植入并发症的因素。采用小尺寸球囊预扩张减少永久性起搏器植入的机制:(1)自身瓣膜未充分扩开,人工瓣膜释放后展开相对不充分,瓣膜支架对流出道压迫较小;(2)自身瓣膜扩张不充分,瓣膜交界或者脊未被撕开,选择较小号的瓣膜也可以达到很好的固定效果,故可选择小型号瓣膜植入减少永久性起搏器植入。
作为目前国内报道的单中心大样本量的研究之一,本研究发现TAVR手术对我国患者具有较好的安全性及有效性。我中心TAVR手术有较高的安全性,术后并发症较少,尤其是起搏器植入率低,这与植入深度密切相关,也可能与较小球囊扩张有关。TAVR对二叶式与三叶式主动脉瓣膜患者具有相似的安全性及有效性。
