甲亢患者肠道微生态的特征
2019-05-16宋影春吕中伟
宋影春 李 丹 吕中伟
(1安徽医科大学上海临床学院核医学科 上海 200072; 2同济大学附属第十人民医院核医学科 上海 200072)
肠道菌群的数量众多,以至于被人们称为人类第二大基因库,其分布、产物及功能代谢通过调节宿主的营养吸收、生化指标甚至免疫系统而对宿主产生深远的影响[1],故被当做一个潜在的机体内环境的影响因子,成为近年来全世界研究的热点。肠-脑轴、肠-肺轴等系统性联系的建立证明了肠道菌群可以作用于全身各大系统,包括免疫系统[2-10]。肠道菌群调节机体自身免疫性疾病状态的作用,在系统性红斑狼疮、类风湿性关节炎、1型糖尿病以及炎症性肠病的研究中均有证实[11-13]。
众所周知,甲亢作为一种自身免疫性疾病,是由调节性T细胞(regulatory T cell,Treg)功能降低或数量减少所引起,导致T淋巴细胞致敏,使B淋巴细胞产生甲状腺自身和相关受体抗体,刺激甲状腺异常合成和分泌过量的甲状腺激素到人体内环境,通过体液作用于人体各组织器官,造成机体代谢亢进和交感神经兴奋,引起多种器官功能的异常与损伤。甲亢的病因除了与基因易感性及碘摄入过多、药物等外环境相关之外,更受患者内环境如免疫细胞及其因子和自身抗体的异常等因素影响[14]。有文献报道肠道菌群可以通过其组成和分布的变化及其代谢产物影响免疫细胞和细胞因子,从而调节甲状腺的免疫状态[15]。另外,甲状腺由原始消化管的前肠部分分化而来,提供了肠道菌群微生态失衡关联相似同源结构的可能病理结构基础。说明肠道菌群可以作为一个内环境的影响因子,在甲亢的发病机制以及病程中有着不可小觑的作用。
虽然国内外有关肠道菌群和甲状腺的研究较多,但大部分是研究肠道菌群与自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD),特别是桥本氏甲状腺炎(Hashimoto’s thyroiditis)之间的关系。少数有关甲亢与肠道菌群的研究只局限于甲亢患者的肠道菌群中数个菌种的丰度变化,并没有更深层次的研究[13]。本文观察甲亢患者肠道菌群的变化,并对变化的肠道菌群与甲亢患者的临床因子及甲亢相关的代谢功能进行相关性分析,可能为该病的发病机制提供进一步佐证,并可为治疗策略的制定及预后评估提供参考。
资料和方法
研究设计本研究旨在采集甲亢患者的粪便样本,采用Illumina高通量测序技术分析甲亢患者肠道菌群物种丰度、多样性和构成的变化趋势,通过成组设计探讨甲亢患者与健康人肠道菌群组成、功能和代谢通路上的差异,以期找出可用于判断甲亢患者的标记微生物。
样本来源经同济大学附属第十人民医院伦理委员会同意,患者及家属、志愿者签署知情同意书,收集本院2017年1月至6月15例首次入住核医学科病房的甲亢患者(男性1例,女性14例,年龄18~53岁,中位年龄35岁)作为甲亢(hyperthy-roidism,HT)组,同时收集15例健康志愿者(男性4例,女性11例,年龄22~43岁,中位年龄25岁)作为对照(healthy control,HC)组。所有患者均按照《甲状腺机能亢进和其他甲状腺中毒原因诊断和管理指南》[16]初次诊断为甲亢。所有志愿者的病史查阅结果显示,检测当年及以往每年的健康体检均没有内分泌系统以及甲状腺激素的异常结果,故认为可以排除对照组内分泌系统的疾病。所有受试者均排除肠道疾病,取样前1个月内未服用抗生素、益生菌等。
样本采集在无菌条件下获取研究对象自然排出的新鲜粪便,用无菌棉签避开表面,挑取中心部分粪便,约黄豆粒大小,放入无菌冻存管后立即速冻,采样程序符合医院伦理要求。粪便样本送至实验室提取DNA,余粪便样本-80 ℃保存备用。
DNA抽提和PCR扩增根据E.Z.N.A®soil试剂盒(美国Omega Bio-tek公司)说明书进行总DNA抽提,DNA纯度和浓度利用Nanodrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5’-ACTCCTACGGGAGGCAGCA-G-3’)和806R(5’-GGACTACHVGGGTWTCTA-AT-3’)引物对V3-V4可变区进行PCR扩增,扩增程序为95 ℃预变性5 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min,10 ℃保持(PCR仪:ABI GeneAmp®9700型)。扩增体系为20 μL,4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol dNTPs,各0.8 μL的引物(5 μmol),0.4 μL FastPfu聚合酶,0.2 μL BSA以及10 ng DNA模板,补ddH2O至20 μL。
Illumina Miseq测序使用2%的琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Extraction Kit(美国Axygen Biosciences公司)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(美国Promega公司)进行检测定量。根据Illumina Miseq平台(美国Illumina Sandiego公司)标准操作规程将纯化后的扩增片段构建双端(paired-end,PE)测序的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI数据库中。
数据处理Miseq测序得到的PE reads首先根据overlap的关系进行拼接,同时对序列质量进行质控和过滤,区分样本后,使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,对比Silva数据库(Silva 128),设置比对阈值为70%。将甲亢组和对照组的数据分成两组,基于OUT进行α、β多样性指数分析,基于OUT聚类分析结果,对OUT进行α、β多样性指数分析,并检测测序深度;基于分类学信息,在OUT、门、属等各个分类水平上进行群落结构的统计学分析。在上述分析的基础上,对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析,包括肠道菌群之间以及两组之间的差异菌与患者的临床因子之间的相关性分析。
宏基因组分析通过PICRUSt(Phylogenetic Investagation of Communities by Reconstruction of Unobserved States)平台对15例HT样品的OTU丰度表进行标准化,即去除16S marker gene在物种基因组中的拷贝数目的影响;然后将15例HT样品区别于正常人的差异菌测序数据输入KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库进行比对,根据KEGG数据库的信息,获得代谢通路信息并进行分析,并根据OTU丰度计算各功能类别的丰度以及差异菌,与筛选出的代谢通路进行相关性分析。
统计学处理采用R语言包(V.3.4.3)对数据进行处理,用Mann-Whitney U检验进行两组间基本特征的差异分析,用成组资料的t检验进行两组指数间及物种间差异分析,应用Spearman秩检验进行相关性分析,P<0.05为差异有统计学意义。
结 果
一般情况我们共招募15例甲亢患者和15个健康志愿者,通过问卷调查发现,甲亢组和对照组的年龄、性别、饮食及生活习惯差异无统计学意义,具体见表1。
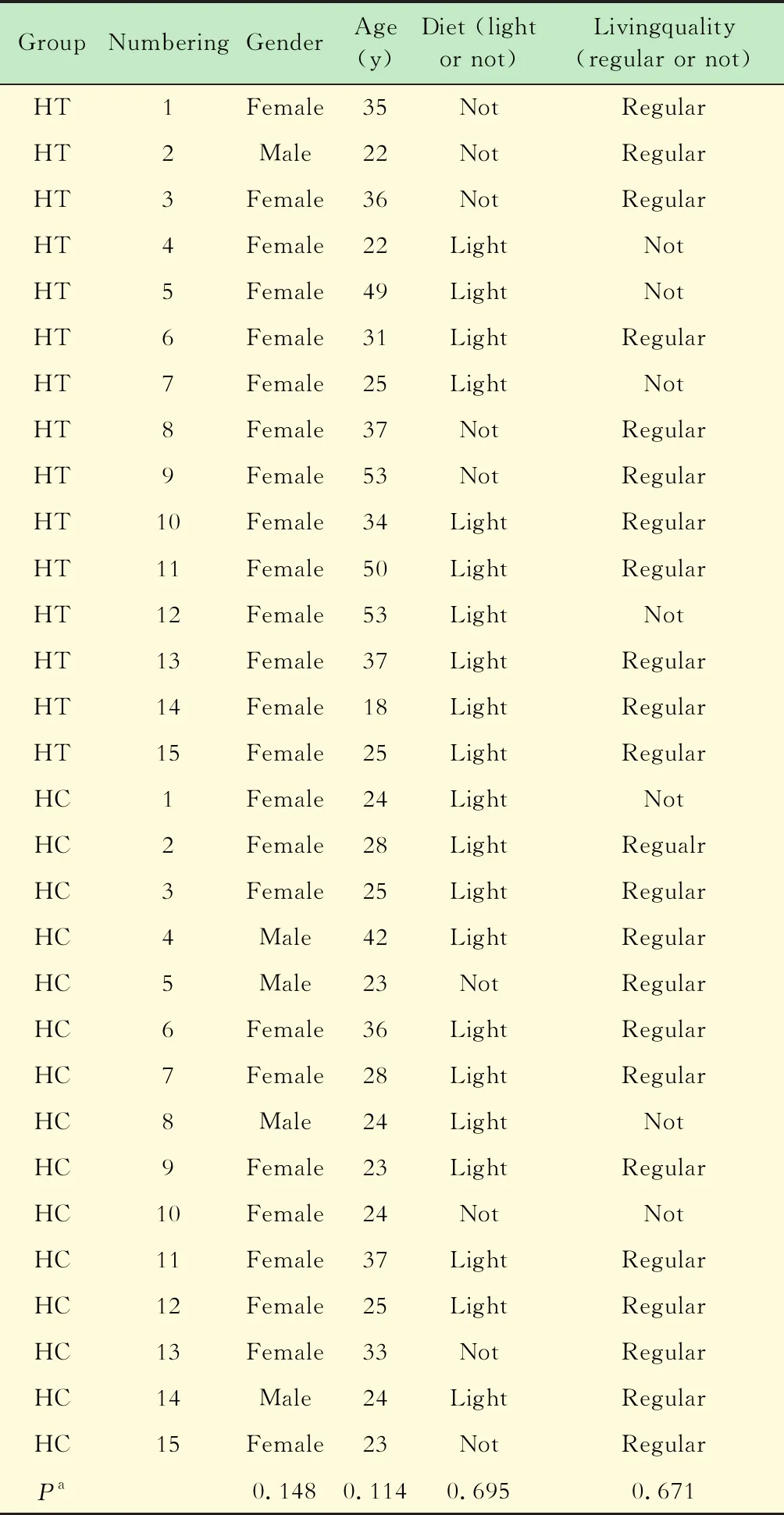
表1 研究对象的基本特征Tab 1 Basic characteristics of study subjects
HT:Hyperthyroidism;HC:Healthy control.aHTvs.HC.
样本分析甲亢患者的粪便样本全部收集于本次入院后服用131I之前。将15例甲亢患者及15例健康对照分别纳入HT组和HC组。HT组的甲亢相关临床指标见表2,HC组检测当年及以往每年的健康体检结果显示没有甲状腺激素异常,认为可以排除甲状腺疾病,且实验同时间段未重复进行甲状腺激素检测,故未给出健康对照的甲状腺检测结果。样本稀释曲线用来比较测序数据量不同的研究样本的物种数目及丰富度。本研究样本的稀释曲线见图1A、B,随着样本读数的增加,在序列数低于5 000时,样本稀释指数随序列数增加而迅速增加,在序列数大于10 000时,稀释曲线逐渐趋于平缓,说明测序数据量足够大,数据量合理,可以反映样本中绝大多数肠道菌群的物种信息,能够进行后续分析。在属的水平上进行相似性分析(analysis of similarities,ANOSIM)以及Adonis分析,即非参数多因素方差分析,可知两组的组间差异是高于各自的组内个体差异的(t=3.67,P=0.001),所以可以对数据进行组间差异分析(图2)。

表2 甲亢患者的基本特征和临床指标Tab 2 The basic features and clinical indicators of patients with hyperthyroidism
FT3:Free triiodothyronine;FT4:Free thyroxine;TT3:Total triiodothyronine;TT4:Total thyroxine;TSH:Thyroid-stimulating hormone;TGAB:Anti-thyroglobulin antibody;TRAB:Thyroid stimulating hormone receptor antibody;TMAB:Thyroid microsome antibody;TG:Thyroglobulin;TPOAB:Thyroid peroxidase antibody;r-T3:Reverse triiodothyronine;RAIU:Radioactive iodine uptake.
肠道菌群丰度及多样性分析通过16s rRNA-V3区的深度测序,在属水平,HT组中反映物种丰富度的指数均低于HC组,其中包括sobs指数(t=2.75,P=0.010,25)、ace指数(t=2.67,P=0.015,37)、chao指数(t=2.99,P=0.007,101);两组反映肠道菌群物种丰富度和均一性的指数相比,HT组的shannon指数(t=2.64,P=0.01,472)、coverage指数(t=2.71,P=0.016,72)低于HC组,而simpson指数(t=2.37,P=0.022,58)高于HC组,这些差异均具有统计学意义(图1D),反映了HT组的菌群丰富度及多样性的降低。HT组物种丰富度降低的情况也出现在门水平,虽然结果差异无统计学意义(图1C)。
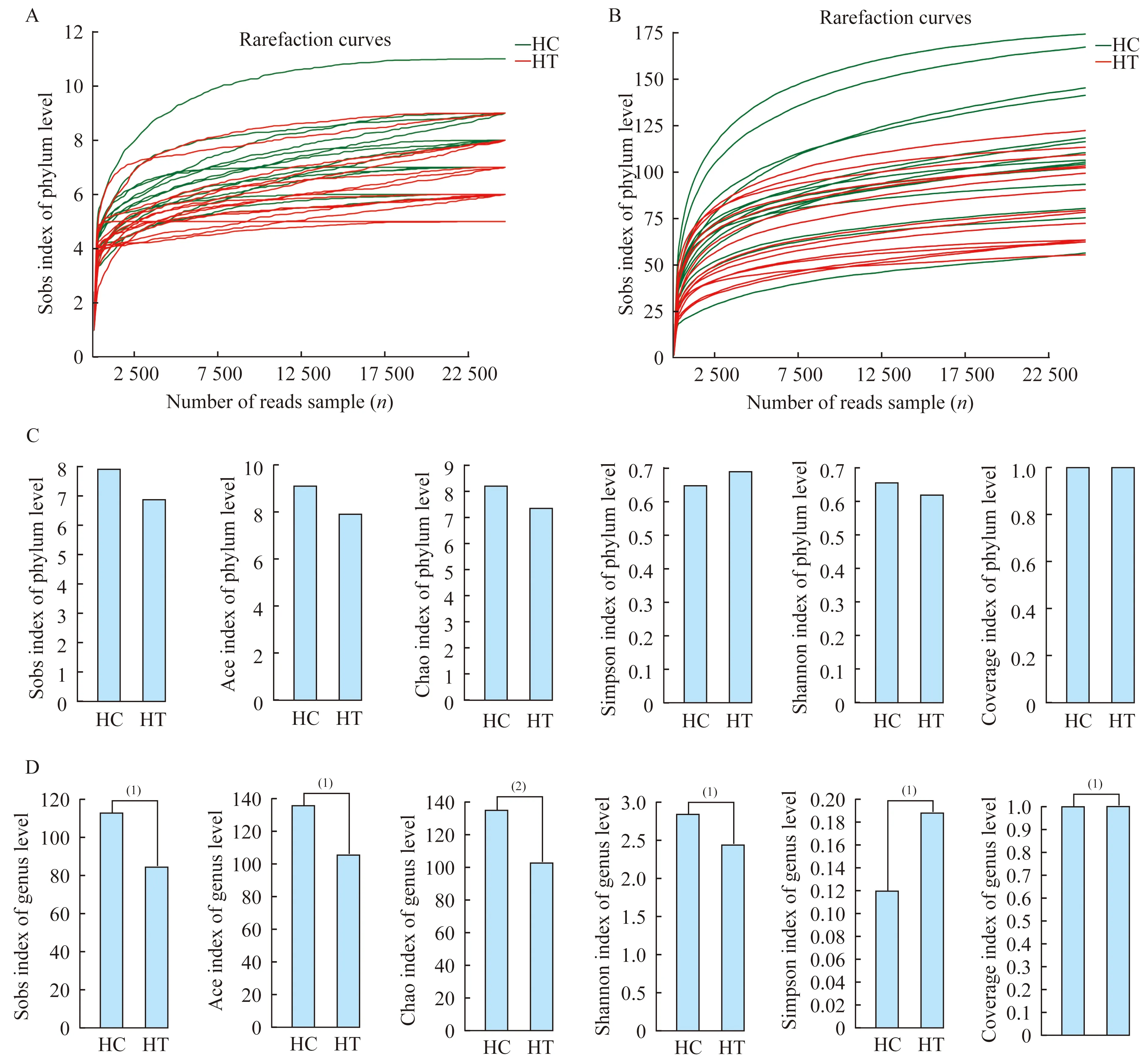
A:Rarefaction curves of the gut microbiota at Phylum level.B:Rarefaction curves of the gut microbiota at Genus level.Sobs,ace,chao index reflect the abundance of microbial communities.The higher the indices,the more rich the communities are.Shannon,simpson and coverage index reflect the diversity of microbial communities.The high shannon index and coverage index as well as low simpson index indicate the species of the community is rich.C:The comparison of these six indices between HT group and HC group on Phylum level.Sobs index,ace index,chao index of HT group are lower than HC group’s.D:The comparison of these six indices between HT group and HC group on Genus level.Sobs index,ace index,chao index,Shannon index and coverage index of HT group are lower than HC group’s,meanwhile simpson index of HT group is higher than HC group’s.(1)P<0.05;(2)P<0.01.
图1 肠道菌群稀释曲线及丰富度和多样性指数的组间差异
Fig 1 Rarefaction curves of the gut microbiota and difference in abundance and diversity
为了观察肠道菌群的直观变化,我们对这两组的肠道菌群进行物种组成分析。Venn图显示30份样品共检测到13个菌门(图3C),均以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)占优势。虽然两组总的微生物组成差异无统计学意义,但是在门水平,通过直观观察Venn图显示,HT组的变形菌门和拟杆菌门的比例较HC组有所上升,而放线菌门与厚壁菌门相对下降(图3A)。在属水平,Venn图显示共检测到246种菌群,两组共有188种菌群,对照组含有51种特有菌群,而甲亢肠道菌群种类显著减少,仅含有7种特有肠道菌图(图3D)。其中,通过直观观察,HT组的直肠真杆菌(Eubacteriumrectalegroup)与双歧杆菌(Bifidobacterium)在总的物种组成中所占丰度的比例均少于HC组,而拟杆菌(Bacteroides)、柔嫩梭菌(Faecalibacterium)与大肠杆菌志贺菌(EscherichiaShigella)的比例升高(图3B)。HT组直肠真杆菌的丰度低于HC组(t=2.11,P=0.044),差异具有统计学意义(图4A),而HT组双歧杆菌的丰度较HC组低,HT组肠道内的优势菌群拟杆菌、柔嫩梭菌以及大肠杆菌志贺菌的丰度高于HC组,这些差异均在两倍以上,但可能因为组内的个体差异或样本量的关系,导致结果差异无统计学意义。
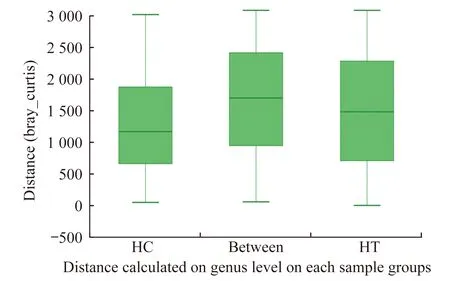
Between represents the groups,HC and HT represent the respective groups,and the ordinate represents the corresponding rank between groups and within the group.The median line in the Between box plots is higher than the median line in the box plots of other groups,indicating that the difference between the groups is greater than the difference within the group.
图2 组间距离箱式图
Fig 2 Distances box plot
差异菌功能分析HT组直肠真杆菌的丰度显著低于HC组,经过随机森林分析,所得到的ROC曲线的AUC为0.72(图4B),说明直肠真杆菌可以用来区分正常人和甲亢患者。探索直肠真杆菌与HT患者的临床因子之间的关联性,甲亢相关临床因子包括年龄、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、甲状腺原氨酸(TT3)、甲状腺素(TT4)、促甲状腺素(TSH)、TSH受体抗体(TRAB)、甲状腺球蛋白(TG)、甲状腺球蛋白抗体(TGAB)、甲状腺微粒体(TMAB)、甲状腺过氧化物酶抗体(TPOAB)、反三碘甲状腺原氨酸(r-T3)、2小时摄碘率(2 h)、24小时摄碘率(24 h)等,未发现明显的相关性,但发现双歧杆菌与TRAB呈正相关(r=0.054 8,P=0.035,t=2.24,图4C),这可能与样本量不大有关。对直肠真杆菌和免疫相关的功能代谢进行相关性分析,发现直肠真杆菌与上皮细胞的细菌侵入这一代谢通路呈负相关(r=-0.367,P=0.046,t=2.11,图4D)。
讨 论
甲亢作为一种器官特异性自身免疫病,是由调节性T细胞(regulatory T cell,Treg)功能降低或数量减少,导致T淋巴细胞致敏,使B淋巴细胞产生甲状腺自身和相关受体抗体引起。甲亢患者体内存在针对甲状腺自身抗原的致敏性T淋巴细胞,被植物血凝素(phytohaemagglutinin,PHA)激活后可产生大量的类似于促甲状腺激素(thyroid stimulating hormone,TSH)的长效甲状腺刺激素(long-acting thyroid stimulator,LATS),LATS作为一种针对甲状腺的抗体,可激活甲状腺滤泡上皮细胞分泌甲状腺激素而引起甲亢;PHA激活T淋巴细胞以后再刺激B淋巴细胞,致其产生大量的TSH受体抗体(thyroid stimulating hormone receptor antibody,TRAB),与TSH受体相结合,进一步激活cAMP,兴奋甲状腺分泌甲状腺激素从而引起甲亢[17]。在现有的调查中,60%~90%的甲亢患者LATS增高,90%的患者TRAB为阳性。这些都证明了免疫细胞和细胞因子可以作为调节免疫机制的微环境来作用于甲状腺。
近年来的研究已确定肠道菌群参与免疫细胞表观遗传基因组的重塑机制,凸显了肠道菌群以及肠道微生物来源的信号对宿主免疫机制的环境作用。在这个过程中,表观遗传机制受循环与环境的影响,决定了T淋巴细胞的分化与功能,促成了多种慢性病的全身效应,例如哮喘、炎症性肠病和糖尿病等[18],对于这些具有很多复杂病因的慢性疾病,肠道菌群在其发生发展中的作用不可小觑。微生物及其代谢产物通过激活肠壁细胞表面的Toll样受体(Toll-like receptors,TLR),使其释放参与炎症过程的TNF-β,IL-1或IL-6以及抗炎细胞因子IL-10,此外还释放决定T淋巴细胞表型的细胞因子IL-17和IL-23。初始CD4+ T细胞由TNF-β、IL-1、IL-23[19]等细胞因子和微生物及其代谢产物诱导分化为Tregs,Tregs可以通过调节树突细胞对效应细胞的抑制作用,分泌IL-10、IL-35和TGF-β等细胞因子,诱导靶细胞溶解来维持机体对自身抗原的耐受性并防止炎症和过敏反应[20]。近年来国内外的研究证明了多种肠道细菌的代谢产物短链脂肪酸(short-chain fatty acids,SCFAs),尤其是丁酸盐,可以在结肠环境中诱导Tregs[21-23],对肠道菌群在IBD的研究表明丁酸盐的腔内浓度与结肠中Tregs的数量呈正比;而且丁酸盐通过减少丁酸介导的核因子—κB和抑制组蛋白脱乙酰酶(histone deacetylase,HDAC)调节免疫力并发挥抗炎作用[24-25]。
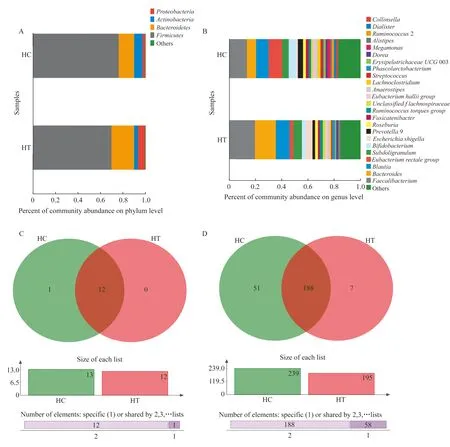
A:The species composition of the gut microbiota at phylum level.B:The species composition of the gut microbiota at genus level.C:The species Venn diagram at phylum level.D:The species Venn diagram at genus level.
图3 甲亢及对照组肠道菌群的物种组成与物种Venn图
Fig 3 The species composition of the gut microbiota and the species Venn diagram of HT group and HC group
已知肠道有固有的淋巴系统,肠道附着的淋巴细胞在机体异常状态的刺激下,释放出大量的炎症因子,包括各种细胞因子;此外,肠道一些变化的定植菌及其代谢产物如丁酸盐等,均可以传至肠系膜淋巴结后直接通过淋巴系统回流,进入胸导管;同时淋巴液也可以经过淋巴通道进入循环系统,从而波及全身[26],这在Anjiria的出血性休克大鼠模型中已被证实[27]。而甲状腺也同样被淋巴结包围,并且血流丰富,所以肠道菌群的代谢产物、淋巴细胞以及其产生的细胞因子可以通过淋巴及血运途径来作用于甲状腺。
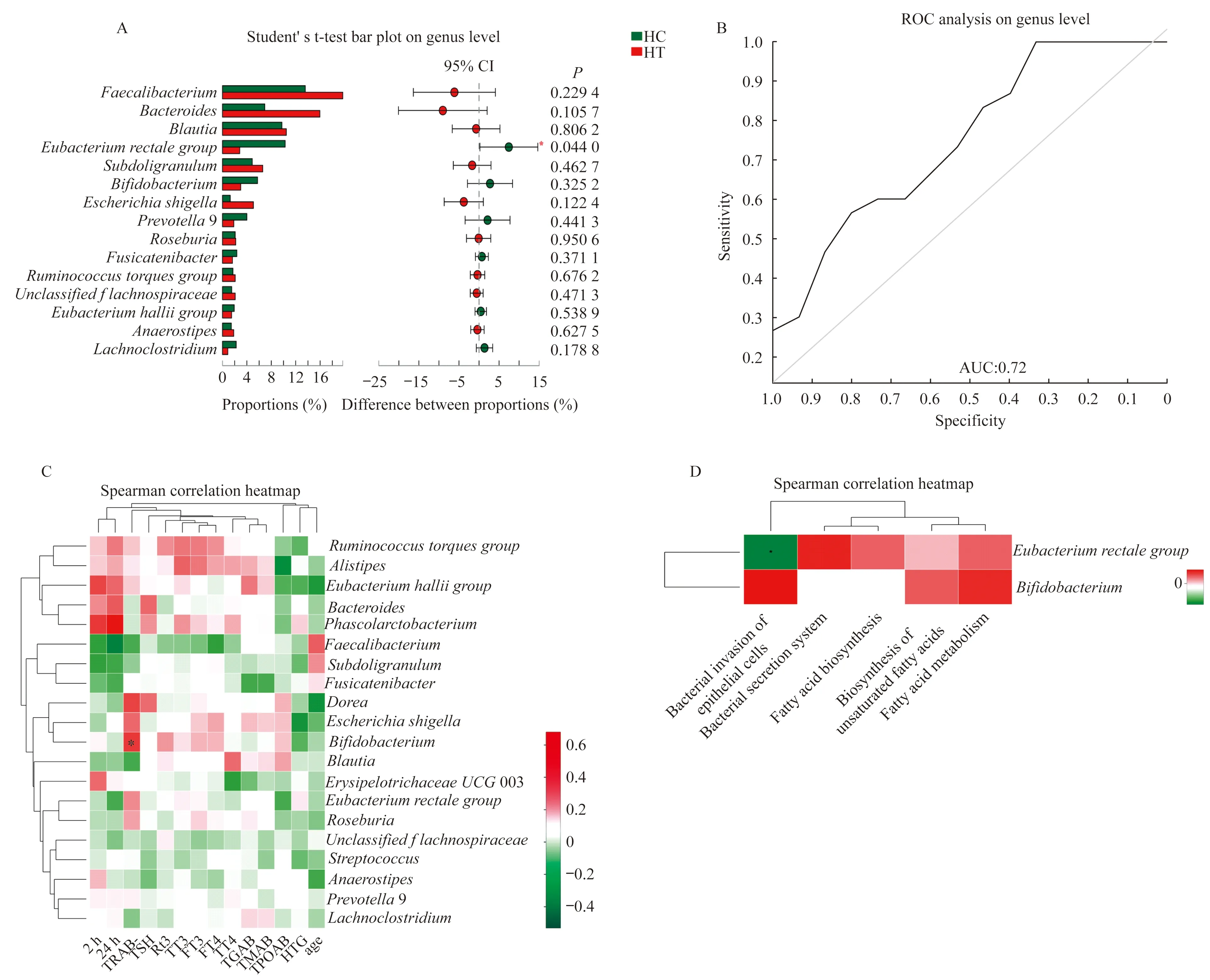
A:The picture shows the difference of species between HT group and HC group.The names on the left side of the picture are the names of the gut microbiota,and the numbers on the right side of the picture arePvalue.Green represents HC group,and red represents HT group.In the plot of difference between proportions,the left deviation of the color point in the box plot indicates that the proportion of the gut microbiota in HT group is higher than that in HC group,similarly,the right devication indicates that the proportion is higher in HC group.B:Receiver operating characteristic curve.C:The bottom of the picture represents the clinical factors associated with hyperthyroidism,and the right side represents the names of the gut microbiota.Red represents positive correlation and green represents negative correlation.D:The bottom of the picture is the metabolic function’s name,and the right side is the gut microbiota’s name.Red represents positive correlation and green represents negative correlation.*representsP<0.05.
图4 属水平的Wilcoxon rank-sum T柱形图、受试者工作曲线、肠道菌群与甲亢相关临床指标相关性分析及肠道菌群与代谢功能相关性Heatmap图
Fig 4 Wilcoxon rank-sum T column chart on genus level,receiver operating characteristic curve,correlative analysis between related indicators in hyperthyroidism and the gut microbiota and heatmap of the correlation between the gut microbiota and metabolic function
本研究发现甲亢患者的肠道菌群丰度降低,多样性也发生显著降低。现有基础研究及临床数据证明,甲状腺激素对于胃肠道有一定影响。甲亢状态下过量的甲状腺激素刺激小肠蠕动亢奋,小肠运动模式的改变加强了肠能动性,并影响消化功能,导致腹泻,肠道菌群的结构也因此发生改变。另外有研究证实,放射性标记的T3和T4在正常大鼠的粪便和盲肠内容物中的可逆结合在取自抗生素治疗的大鼠的样品中减少,表明肠道可能作为碘甲状腺原氨酸交换池的储存器发挥相关作用,此外,脱碘酶的活性在肠内容物中被常驻微生物群抑制,当肠道菌群的组成结构发生改变的时候,其对于脱碘酶活性的抑制作用解除,使得更多的T4在脱碘酶的作用下向T3转化[28],引起或加重甲亢。
在门水平,甲亢患者的变形菌与拟杆菌的比例升高,其中变形菌门包括很多病原菌,例如大肠埃希菌、沙门氏菌、霍乱弧菌及幽门螺杆菌等,变形菌门在甲亢患者的比例升高明确说明了甲亢患者肠道菌群的失调。另外,甲亢患者的放线菌与厚壁菌所占比例有所下降,而已知56%的抗菌素,如链霉素、庆大霉素等均由放线菌产生,放线菌的丰度降低导致抗菌素的释放减少,则对于有害菌群的抑制作用减弱。有文献报道称厚壁菌门是导致肥胖的主要菌群[29],有趣的是,甲亢导致患者消瘦,除了甲状腺激素加速新陈代谢以外,推测厚壁菌门的降低对患者消瘦也起到了一定的辅助作用。
在属水平上,甲亢患者的直肠真杆菌的丰度相比于健康正常人减低,结果有统计学意义。直肠真杆菌作为人体肠道菌群中常见的成员,已经在体内外被证明其主要发酵产物是丁酸盐[30],直肠真杆菌的丰度在甲亢患者中显著降低,进而推测其产生的丁酸盐的量显著下降,可能诱导分化产生的Tregs也相应减少,随之释放的抗炎性的细胞因子也减少,因而通过淋巴和血运途径而对甲状腺相应抑制炎症的机制作用变弱。这种变化在克罗恩病(Crohn’s disease)、2型糖尿病和结直肠癌中均观察到[31]。另外值得一提的是,在机体与免疫相关的代谢功能的相关性分析中,直肠真杆菌与上皮细胞的细菌侵入呈负相关。肠道上皮细胞是肠道病原体侵入人体的第一站,经肠道病原体刺激后,释放可以激活多个核细胞的趋化因子白细胞介素-8(interleukin-8,IL-8),且感染病原体90 min后,肠道上皮细胞内可以检测到IL-8 mRNA的水平升高[32],这些都说明上皮细胞可以作为早期信号系统,细菌进入后在宿主黏膜中容纳免疫和炎性细胞。直肠真杆菌丰度明显降低,导致肠道上皮细胞的防御功能降低,有助于有害细菌侵入。
本研究同样观察到与正常人相比,甲亢患者的双歧杆菌丰度降低。有文献发现双歧杆菌有利于甲基的供体叶酸产生,可能通过表观遗传机制促进Tregs的存活,在疾病和健康预防中有着积极的功效[33]。另外,甲亢患者柔嫩梭菌的比例相应升高,由于柔嫩梭菌可以诱导抗炎因子分泌来调节免疫,我们推测这与对抗甲亢而产生的应激反应有关。大肠杆菌志贺菌的比例在甲亢患者中也明显升高,已知该菌是痢疾的致病菌,传染性高且危害严重[34],也提示甲亢患者免疫能力下降以及肠道生态的失调。
本研究具有一定的局限性,一是由于甲亢患者的数量较少,二是粪便中的菌群并不能完全反映在肠道黏膜定植的肠道菌群。在今后的工作中,除了加大样本量以外,还需要建立动物模型验证实验结果,并对相关差异菌导致的分子机制进行深入探讨。
本研究揭示了甲亢患者的肠道菌群失调,其肠道微生物的丰富度和多样性均减低,说明在疾病状态下肠道菌群的数量、种类和分布均存在异常,且在甲亢患者中丰度显著降低的直肠真杆菌与肠道及甲亢的免疫机制和免疫相关代谢功能密切相关,启发我们思考是否可以通过改善患者的肠道菌群结构来缓解甲亢的病情,为甲亢的辅助治疗提供新的视角。
致谢本次实验由上海美吉生物医药科技有限公司提供技术支持与分析平台。
