慢性失眠患者中脑小血管病临床特征分析
2019-05-16王继辉李冠英阮恒芳李莉莉陈小东门雪娇卢婷婷陆正齐
王继辉 李冠英 阮恒芳 李莉莉 陈小东 门雪娇 卢婷婷 陆正齐
失眠是中老年人常见的睡眠障碍之一,约有50%的中老年人有失眠主诉,12%~20%的中老年人达到失眠标准[1]。失眠和心脑血管疾病共病非常常见,其发病机制互为因果[2]。脑小血管病(cerebral small vessel disease,CSVD)是指由于各种原因影响脑内微小血管导致的一系列临床、影像、病理综合征,以高血压病等血管危险因素相关的小动脉硬化型CSVD最为常见。CSVD是引起卒中和血管性痴呆的主要原因之一。在疾病早期,未发生急性卒中事件之前,称为无症状性CSVD,常表现为头晕、失眠等,由于症状不具备特异性,容易漏诊,未能引起重视从而导致疾病持续进展[3]。
良好的睡眠对巩固记忆、调节免疫、平衡内稳态具有重要作用[4]。而睡眠障碍可能引起血压调节异常[5]、脂质代谢紊乱[6]、免疫调节紊乱[7],这些因素正是小动脉硬化型CSVD发病机制中的重要环节。对于中老年失眠患者共病CSVD的临床特征及其与单纯失眠鉴别诊断等方面,既往少见报道。本研究针对中老年失眠患者,调查共病无症状性CSVD情况及临床特征,为早期识别、鉴别诊断提供依据。
1 对象与方法
1.1 对象
本研究为横断面研究,连续纳入2018年1月至2019年4月中山大学附属第三医院精神科和神经内科门诊及住院的符合入排标准的失眠患者100例,其中男48例,女52例,年龄52~75岁,平均(63±11)岁。失眠患者中,共病CSVD者为研究组(28例,28%);仅为失眠者,为对照组(72例,72%)。研究组中男15例(53.6%),女13例(46.4%);年龄52~75岁,平均(64±9)岁。对照组中男33例(45.8%),女39例(54.2%);年龄53~75岁,平均(62±12)岁。两组患者的年龄、性别差异无统计学意义(均P>0.05),具有可比性。
所有患者均先进行临床问诊和体格检查,并于就诊当天完成相关量表评估,在2周内完成睡眠监测和头部MRI。研究内容经中山大学附属第三医院伦理委员会批准,其中涉及的检查为临床常规及必要检查,无侵入性检查,所有患者均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:(1)年龄50~75岁。(2)以“失眠”为主诉或主诉之一就诊,符合《美国精神疾病分类与诊断标准-5》中的慢性失眠标准[8],包括主诉对睡眠不满;睡眠紊乱引起明显的痛苦或社会、职业或其他重要功能损害,每周≥3次,>1个月;尽管有充足的睡眠机会,仍出现睡眠困难;不存在失眠以外的其他类型的睡眠障碍;失眠不能归因于某种物质的生理效应;共存的精神障碍和躯体状况不能充分解释失眠的主诉。排除标准:存在严重的、不稳定的精神疾病和躯体疾病;精神发育迟滞或痴呆;服用影响认知或睡眠的药物;夜班工作者;无法完成量表测试的情况,如耳聋、偏瘫、失语、视力障碍等;感染、肿瘤、炎性反应、射线、中毒等其他病因所致的大脑病理改变;遗传性、炎性、淀粉样变等原因所致的CSVD及卒中史者。
1.3 无症状性CSVD的诊断标准
既往无急性卒中史;存在至少1个脑血管病危险因素,如高血压病、糖尿病、高胆固醇血症、高同型半胱胺酸血症、吸烟、过量饮酒;MRI存在至少1个CSVD标志物(腔隙、脑白质高信号、微出血、血管周围间隙);皮质下无直径>15mm的梗死病灶;无狭窄超过50%的大动脉病变,如颈动脉、椎-基底动脉。CSVD标志物阳性的定义如下[9]。(1)腔隙:皮质下的圆形或卵圆形,直径为3~15mm,与脑脊液等信号,T2-液体衰减反转恢复(FLAIR)序列表现为中心区域脑脊液样低信号,周围环绕高信号,T1、T2则通常显示为脑脊液样信号。存在1个或多个腔隙为阳性。(2)脑白质高信号:脑白质区域异常信号,T2或T2-FLAIR上为高信号,T1显示为等信号或低信号,病灶内无空腔,分为深部白质高信号和侧脑室旁白质高信号。早期融合的深部白质高信号(Fazekas量表评分2~3分)或不规则的侧脑室旁白质高信号延伸至深部白质(Fazekas量表评分3分)为脑白质高信号阳性[10]。(3)血管周围间隙:基底节区、扩大的血管周围间隙,直径<3mm,与脑脊液等信号,线形(成像平面与血管走行平行时)或类圆形(与血管走行垂直时)。计算单侧基底节区血管周围间隙数量,计数>10个为阳性。(4)微出血:磁敏感加权成像(susceptibility-weighted imaging,SWI)序列上显示的小圆形或卵圆形、边界清楚、均质性的信号缺失灶,直径2~5mm,周围为脑实质,1个或多个微出血为阳性。
1.4 评价指标
1.4.1多导睡眠监测:使用无线遥测多导睡眠监测系统(德国SOMO medics,SOMOscreen plus PSG+,法兰克福)进行一整夜睡眠监测,记录数据包括脑电图、眼动电图、颏肌电图、下肢肌电图、心电图、胸腹呼吸运动、呼吸气流、氧饱和度。参照《美国睡眠医学会睡眠及其相关事件判读手册——规则、术语和技术规范》对所得数据进行分析判读[11]。睡眠评价指标为入睡潜伏期、睡眠时间、睡眠效率、入睡后觉醒时间、觉醒指数、呼吸暂停低通气指数和非快速眼动睡眠-1比例、非快速眼动睡眠-2比例、非快速眼动睡眠-3比例和快速眼动睡眠比例。
1.4.2头部MRI:采用美国GE Discovery MR750 3.0T超导MR成像系统(Verio,西门子,Erlangen,德国)进行MR扫描,8通道相控阵头颅线圈,扫描序列包括三维时间飞跃MR血管成像(time of flight magnetic resonance angiograhy,TOF-MRA)、T1加权成像(T1 weighted image,T1WI)、T2加权成像(T2 weighted image,T2WI)、FLAIR、SWI。
1.4.3北京版蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA):快速筛查认知功能障碍,约需10min,检测以下认知领域,即执行功能(4分)、视空间(4分)、短时记忆(5分)、注意力与工作记忆(6分)、语言(5分)、定向(6分)。如果受教育程度≤12年,加1分[12]。
1.4.4主观临床症状评估:视觉模拟评分法评估失眠和CSVD常见症状的主观严重程度,包括记忆障碍、步态不稳、抑郁情绪、头晕、头昏、排尿障碍、日间思睡、疲乏无力。采用一段10cm长的线段,标有10个刻度,最左边为0分,表示无症状;最右边为10分,表示最严重的症状;中间部分表示不同程度的症状。受试者在线段上作标记,表示自己主观症状的严重程度,取值介于0~10分[13]。
1.4.5人口学资料:采用自制量表调查人口学资料,包括年龄、性别、腰围、体质量、文化程度、脑血管病危险因素。危险因素分别定义为高血压病(血压>140/90mmHg或服用降压药)[9]、糖尿病(空腹血糖≥7.0mmol/L或服用降糖药)[14]、高胆固醇血症(总胆固醇>5.0mol/L或服用降胆固醇药物)[9]、高同型半胱胺酸血症(血同型半胱胺酸≥10μmol/L)[15]、缺血性心脏病(心肌梗死、心绞痛或心电图显示心肌缺血)[9]、吸烟[9]、过量饮酒[16]。
1.5 统计学分析
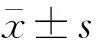
2 结果
2.1 研究组和对照组一般人口学及临床资料比较
研究组患高血压病、高同型半胱胺酸血症的比例高于对照组,差异均有统计学意义(均P<0.05);其余脑血管病危险因素及人口学资料的差异均无统计学意义(均P>0.05),见表1。

表1 两组失眠患者一般人口学及临床资料比较[例(%)]
注:研究组为失眠共病脑小血管病者,对照组为仅失眠者;a为t值,b为χ2值
2.2 研究组和对照组多导睡眠监测参数比较
研究组睡眠效率低于对照组,入睡后觉醒时间、觉醒指数、非快速眼动睡眠-1比例高于对照组,差异均有统计学意义(均P<0.05);入睡潜伏期、入睡后觉醒时间、呼吸暂停低通气指数、快速眼动睡眠比例、非快速眼动睡眠-2比例及非快速眼动睡眠-3比例比较,差异均无统计学意义(均P>0.05),见表2。
2.3 研究组和对照组主观临床症状比较
研究组头晕的症状评分高于对照组,差异有统计学意义(均P<0.05),其余症状比较,差异均无统计学意义(均P>0.05),见表3。
2.4 研究组和对照组MoCA评分比较
研究组MoCA总分、视空间、执行功能、短时记忆评分均低于对照组,差异均有统计学意义(均P<0.05),其余MoCA评分的组间差异均无统计学意义(均P>0.05),见表4。
3 讨论
既往报道普通人群CSVD的患病率为6%~7%[17],而本研究中老年慢性失眠患者CSVD患病比例为28%,远高于既往报道的数据,可能与本研究未设置健康对照组、采用的是慢性失眠患者及入组患者的年龄段有关。年龄和高血压病是CSVD公认的、传统的危险因素,而在失眠患者中CSVD的患病率高,且慢性失眠对血压调节[5]、脂质代谢紊乱[6]、免疫紊乱[7]的不利影响,均提示失眠可能是CSVD的一个非传统危险因素,需要引起关注和重视。
失眠共病CSVD患者的睡眠特征和普通失眠患者不同。虽然入睡潜伏期和睡眠总时间差异无统计学意义,但共病患者睡眠片段化程度更加严重,这可能与CSVD患者皮质下神经环路受损、神经递质分泌异常导致的睡眠维持困难有关[18]。而且睡眠片段化会加重炎性反应[19]、大脑垃圾清除障碍[20]、血-脑屏障破坏[21]、认知障碍[22],进而加重CSVD。因此,从睡眠障碍入手,通过改善睡眠片段化,来延缓CSVD的病理进展,可能成为未来的治疗策略之一。

表2 两组失眠患者多导睡眠监测参数比较

组别例数快速眼动睡眠比例睡眠效率非快速眼动睡眠-1比例非快速眼动睡眠-2比例非快速眼动睡眠-3比例x-±s,%研究组2813±467±1815±460±149.1±2.8对照组7216±675±1510±359±1711.6±2.4检验值0.851b1.854b3.254b1.147b1.265bP值0.625a0.044a0.009a0.236a0.105a
注:研究组为失眠共病脑小血管病者,对照组为仅失眠者;a为Z值,b为t值

表3 两组失眠患者临床症状的视觉模拟评分比较[M( P25,P75),分]
注:研究组为失眠共病脑小血管病者,对照组为仅失眠者
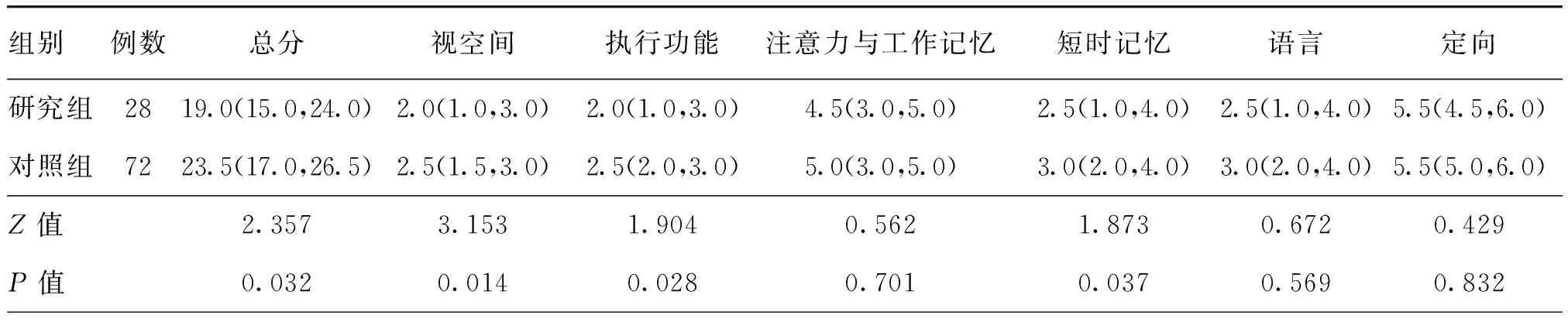
表4 两组失眠患者MoCA评分比较[M( P25,P75),分]
注:研究组为失眠共病脑小血管病者,对照组为仅失眠者;MoCA为蒙特利尔认识评估量表
共病患者主观症状的隐蔽性,仅头晕较为显著。慢性失眠患者常存在日间功能障碍,如疲劳、思睡、头晕、乏力、认知障碍、抑郁情绪[23],这些症状与CSVD的早期症状非常相似,如果医师仅关注失眠问题,容易延误诊断或漏诊。虽然主观症状存在隐蔽性,但本研究发现了一些线索有助于鉴别诊断,如认知功能测评方面,共病患者视空间、执行功能、短时记忆受损更加严重。这些认知损害的原因,可能因CSVD脑部的病理改变破坏了脑网络节点之间的连接纤维即前皮质下回路和胆碱纤维束所致[24]。另外,在血管危险因素方面,共病患者除了高血压病以外,高同型半胱胺酸血症的比例也高于对照组,而研究证实,高同型半胱胺酸水平与CSVD有关[25],因此,建议在鉴别诊断时注意筛查该项目。
总之,中老年失眠共病CSVD患者占一定比例,单从主观症状学上难以区分,睡眠监测、认知量表评估、头部MRI、血同型半胱胺酸测定均有助于鉴别诊断。本研究的不足之处为样本量较小,无法根据影像学标志对CSVD患者进一步分组和分析,需进一步扩大样本量验证。当然,CSVD患者大脑病理改变之间存在着共同的发病机制,会互相影响和转换,将各种病理改变看做一个整体来评估更加合适[26];本研究为横断面研究,无法阐述失眠与CSVD的因果关系,建议未来的研究能进行前瞻性的干预治疗,观察失眠与CSVD之间的相互关系。
