甲状腺功能谱与急性缺血性卒中患者早期新发失眠的相关性分析
2019-05-16刘玉景彭敏刘远路谷蒙蒙肖露露黄显军孙文刘新峰
刘玉景 彭敏 刘远路 谷蒙蒙 肖露露 黄显军 孙文 刘新峰
卒中患者常伴有失眠,既往研究显示,卒中患者失眠症状的发生率为30%~60%[1-4],其中约半数以上为卒中后新发失眠[1]。失眠可影响卒中患者神经功能恢复,不利于患者回归正常的工作岗位[2]。但相对于卒中后的运动功能障碍,卒中早期新发失眠往往被忽视。目前仅发现焦虑和服用精神类药物是卒中早期新发失眠的独立危险因素[2],但许多无焦虑及未服用精神类药物的患者仍然在卒中后出现了失眠。探讨卒中后早期新发失眠危险因素将有利于揭示其可能的内在机制。
甲状腺是人体最大的内分泌腺,主要分泌甲状腺激素。甲状腺激素作用广泛,可影响全身各个系统。甲状腺激素主要由下丘脑-垂体-甲状腺(hypothalamic-pituitary-thyroid axis,HPT)轴调控。垂体分泌的促甲状腺激素(thyroid-stimulating hormone,TSH)可直接作用于甲状腺而影响甲状腺激素的合成和分泌。甲状腺功能谱即甲状腺功能五项是直接反映甲状腺功能的血液检查指标,包括血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)及TSH。近年的几项研究表明,甲状腺功能障碍可影响卒中患者的功能预后[5-6],但尚未有研究评估甲状腺激素水平与其他非运动功能障碍,尤其与卒中后睡眠障碍的关联。因此本课题组在南京医科大学附属金陵医院进行一项单中心前瞻性队列研究,探讨甲状腺功能谱与急性缺血性卒中患者早期新发失眠的相关性。
1 对象与方法
1.1 对象
前瞻性连续纳入2018年5月至2019年5月南京医科大学附属金陵医院神经内科住院的急性缺血性卒中患者276例,男214例,女62例;年龄28~90岁,平均(63±12)岁;美国国立卫生研究院卒中量表(NIHSS)评分0~13分,中位评分2(1,4)分;其中合并高血压病217例(78.6%),糖尿病126例(45.7%),心房颤动26例(9.4%),既往卒中史48例(17.4%);甲状腺功能亢进者4例(1.4%),甲状腺功能减退者2例(0.7%)。本研究方案经医院伦理委员会批准(伦理号:2010NLY-018)并获得患者的知情同意。
1.2 纳入及排除标准
纳入标准:(1)年龄≥18岁;(2)急性缺血性卒中符合ICD-11(G45.000-G45.902)[7]的诊断标准;(3)发病7d内入院。排除标准:(1)既往患有慢性失眠或长期服用影响睡眠的药物者;(2)既往患有甲状腺疾病及精神障碍或近1个月服用了影响甲状腺功能及情绪的药物者;(3)昏迷、严重嗜睡或因存在严重失语或构音障碍及其他原因而无法进行沟通者;(4)简易智力状态检查量表(mini-mental state examination,MMSE)评分≤10分或MMSE评分为11~23分,但经医师或护士判断无法完成此次访谈者[8];(5)长期住在监护室或住院不满5d者;(6)拒绝行甲状腺功能检查或拒绝进行量表评估的患者。
1.3 临床基线资料收集及评价标准
1.3.1基线资料收集:入院后第2天早晨6时采集空腹血样。使用标准化放射免疫检测试剂盒检测血清FT3、FT4、TT3、TT4及TSH水平。本医院实验室TSH参考区间为0.49~4.5mU/L,FT3参考区间为3.8~6.5pmol/L,FT4参考区间为7.9~17.2pmol/L。根据患者甲状腺功能测量可将甲状腺功能状态分为如下:(1)甲状腺功能正常,TSH、FT3、FT4均在正常范围内;(2)亚临床甲状腺功能减退,TSH>4.5mU/L,FT3/FT4正常;(3)亚临床甲状腺功能亢进,TSH<0.49mU/L, FT3/FT4正常;(4)低T3综合征,FT3<3.8pmol/L,TSH、FT4在正常范围内;(5)甲状腺功能亢进,TSH<0.49mU/L,FT3和(或)FT4升高;(6)甲状腺功能减退,TSH>4.5mU/L, FT3和(或)FT4下降[9]。
年龄、性别、体质量指数(body mass index,BMI)、高血压病、糖尿病、心房颤动、既往卒中史、吸烟史、饮酒史、打鼾及受教育程度等临床资料均在入院当天收集。高血压病定义为2次或2次以上非同日测血压,收缩压均≥140mmHg或舒张压均≥90mmHg,或既往经医疗机构明确诊断[10]。糖尿病定义为空腹血糖≥7.0mmol/L (1 260mg/L)或75g葡萄糖负荷2h后血糖≥11.1mmol/L (2 000mg/L),或随机血糖≥11.1mmol/L (2 000mg/L),或既往经医疗机构明确诊断[11 ]。心房颤动定义为既往或本次入院期间经心电图检查明确诊断。既往卒中史定义为本次卒中发生前发生过的且曾被医院明确诊断为卒中或短暂性脑缺血发作(TIA)。吸烟定义发病前每天吸烟>10支,持续时间>6个月[12]。饮酒定义为发病前几乎每天喝酒,平均每天饮酒量>50g,持续时间>1年[12]。教育水平分为≤6年和>6年。
1.3.2量表资料收集及评估:卒中早期新发失眠定义为卒中发病之前无失眠(通过询问患者)而在住院期间出现失眠。失眠诊断参照2014年美国睡眠专家委员会制定的国际睡眠障碍第三版分类(international classification of sleep disorders,3rd edition,ICSD-3)[13]中失眠的诊断标准。失眠严重程度指数量表(insomnia severity index,ISI)[14]评估失眠严重程度。ISI包括睡眠启动、睡眠维持困难及早醒的严重程度、对睡眠的满意度、睡眠障碍对日间功能的影响程度、睡眠问题引起损害的可观察性及睡眠问题引起苦恼或担忧的程度共7个项目,每项评分0~4分,总分28分。分数越高说明失眠越严重。根据卒中早期是否有新发失眠将上述患者分为失眠组和非失眠组。
采用24项汉密尔顿抑郁量表(Hamilton depression scale-24,HAMD-24)[15]、14项汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)[16]、9项疲劳严重程度量表(fatigue severity scale,FSS)[17]和10项Lubben社会网络量表(Lubben social network scale)[18]分别对抑郁、焦虑、疲劳和社会交际进行评估。HAMD-24由24项症状组成,每一种症状的评分范围为0~2分或0~4分,总分以24个症状总分之和计算,分数越高表明抑郁症状越严重。HAMA每项评分范围为0~4分,总分越高,焦虑症状越严重。FSS由9个问题组成,每个问题评分范围为1~7分,得分越高表明疲劳程度越严重。Lubben社会网络量表每个问题的分数从0~5分不等,分数越高表明社会网络越好。量表评估在出院前由1名临床经验丰富且经过专业培训的医师完成,评估方式为面对面交谈。
1.4 统计学分析

2 结果
2.1 影响失眠因素的单因素及多因素分析
276例中,失眠组64例(23.2%),非失眠组212例(76.8%)。单因素分析结果如表1~4所示。与非失眠组比较,失眠组血清中TSH水平、入院时NIHSS评分、住院期间HAMD评分及HAMA评分、吸烟比率及打鼾比率较高,Lubben评分、男性比率及既往卒中或TIA史比率较低,两组梗死半球位置存在显著差异,差异均有统计学意义(均P<0.05,表1~4)。将TSH、年龄、性别、NIHSS评分、既往卒中或TIA史、梗死半球位置、Lubben评分、HAMA评分纳入多因素Logistic回归模型中,结果显示,较高的血清TSH水平及较高的HAMA评分是卒中早期新发失眠的独立危险因素,既往卒中史及较高的Lubben评分是卒中早期新发失眠的保护因素(表5)。
2.2 血清TSH正常的失眠患者影响失眠因素的单因素及多因素分析结果
进一步排除亚临床甲状腺功能异常的患者,将血清TSH正常患者分为失眠组(192例)与非失眠组(48例)。单因素分析结果显示,与非失眠组比较,失眠组住院期间HAMD及HAMA评分较高,Lubben评分、既往卒中或TIA史比率及打鼾比率均较低,差异均有统计学意义(均P<0.05,表6~9)。调整了混杂因素后的多因素分析结果显示,高血清TSH水平仍为卒中早期新发失眠的独立危险因素(OR=1.635,95%CI:1.047~2.554,P=0.031,表10)。
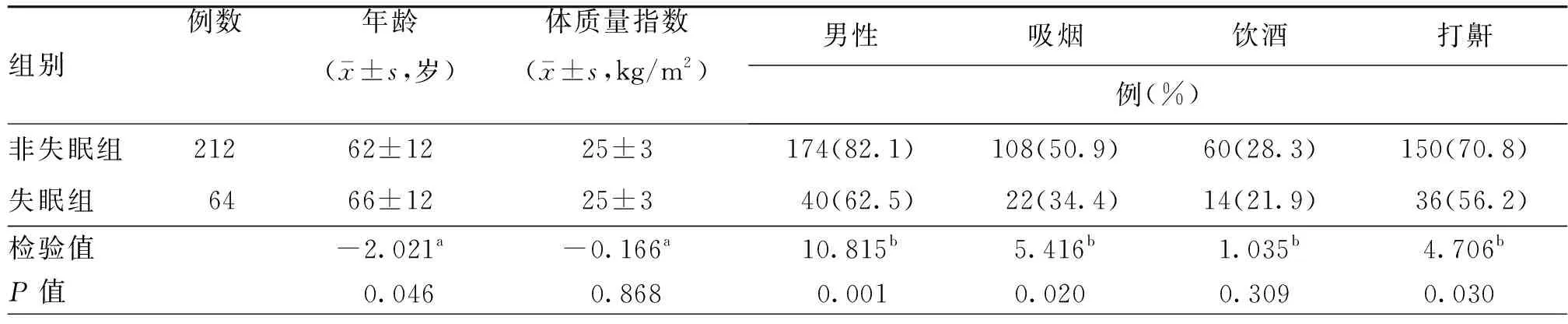
表1 失眠组与非失眠组急性缺血性卒中患者基线资料比较

组别例数高血压病糖尿病心房颤动既往卒中或TIA教育水平(≤6年)例(%)非失眠组212169(79.7)98(46.2)18(08.5)44(20.8)52(24.5)失眠组064048(75.0)28(43.8)08(12.5)04(06.2)10(15.6)检验值0.651b0.122b0.926b6.574b2.237bP值0.420a0.727a0.336a<0.01000a0.135a
注:TIA为短暂性脑缺血发作;a为t值,b为χ2值

表2 失眠组与非失眠组急性缺血性卒中患者甲状腺功能各指标比较
注: TSH为促甲状腺激素,FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺素,TT3为总三碘甲状腺原氨酸,TT4为总甲状腺素;a为Z值,b为t值
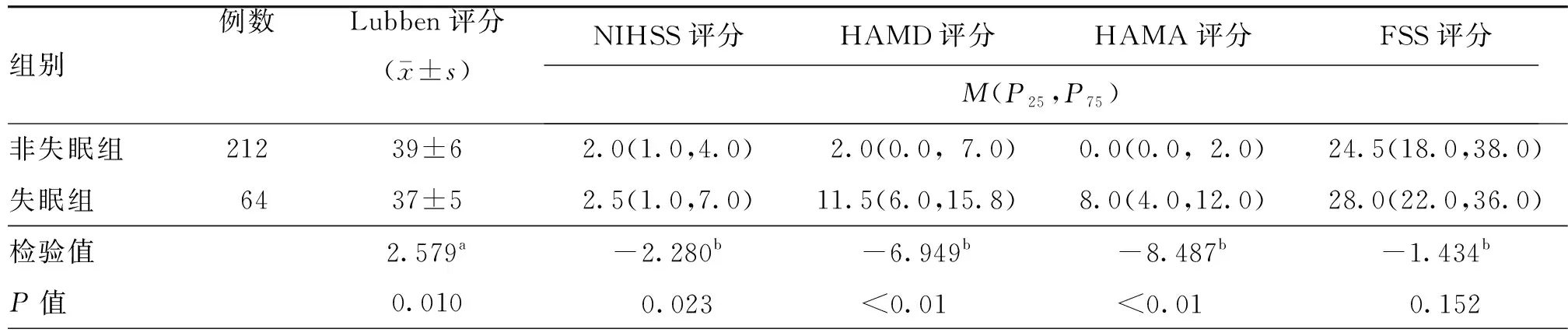
表3 失眠组与非失眠组急性缺血性卒中患者各量表评分比较(分)
注:Lubben为Lubben社会网络量表,NIHSS为美国国立卫生研究院卒中量表,HAMD为汉密尔顿抑郁量表,HAMA为汉密尔顿焦虑量表,FSS为疲劳严重程度量表;a为t值,b为Z值

表4 失眠组与非失眠组急性缺血性卒中患者梗死部位比较[例(%)]
注:a为Fisher确切概率法

表5 急性缺血性卒中患者早期新发失眠的
注: NIHSS为美国国立卫生研究院卒中量表,TIA为短暂性脑缺血发作,Lubben为Lubben社会网络量表, HAMA为汉密尔顿焦虑量表,TSH为促甲状腺激素
3 讨论
本研究结果显示,与非失眠组比较,卒中新发失眠组具有更高的TSH水平,在调整了焦虑等混杂因素后这种差异仍然存在,提示血清TSH水平是卒中早期新发失眠的独立预测因素。关于失眠与内分泌环境改变之间的关联性研究并不多见。在普通人群中,目前认为失眠主要与HPT轴有关[19-20]。随着HPT轴与失眠研究的逐渐开展,二者之间的关系越来越不能被忽视。既往研究结果表明,慢性失眠人群中HPT轴的活性较无慢性失眠人群明显升高[21]。但关于卒中早期新发失眠与HPT轴或甲状腺功能谱之间的相关性研究笔者尚未见报道,本研究结果首次支持上述结论。笔者认为卒中早期新发失眠可能与卒中后HPT轴的激活有关。卒中发生后,HPT轴活性发生适应性升高[22],TSH产生增多进而产生更多的甲状腺激素,甲状腺激素可通过作用于中枢神经系统的线粒体引起三磷酸腺苷升高,进而使机体警觉性升高、神经传导速度增快,从而导致睡眠减少[23]。本研究两组血清中甲状腺激素无明显差异,可能与甲状腺激素的释放方式及卒中发生后外周组织对其摄取、组织中脱碘酶活性改变有关[24-25]。
本研究结果显示,与非失眠组比较,卒中后新发失眠组患者入院期间HAMA评分更高,即使调整了其他混杂因素后,差异仍有统计学意义,提示卒中早期新发失眠可能与入院期间患者焦虑情绪相关,与既往研究结果一致[1]。但在本研究中,许多不伴焦虑的卒中患者仍然出现较为严重的新发失眠,提示了卒中患者情绪的改变虽可影响失眠的发生,但并不是引起卒中后新发失眠的唯一因素。
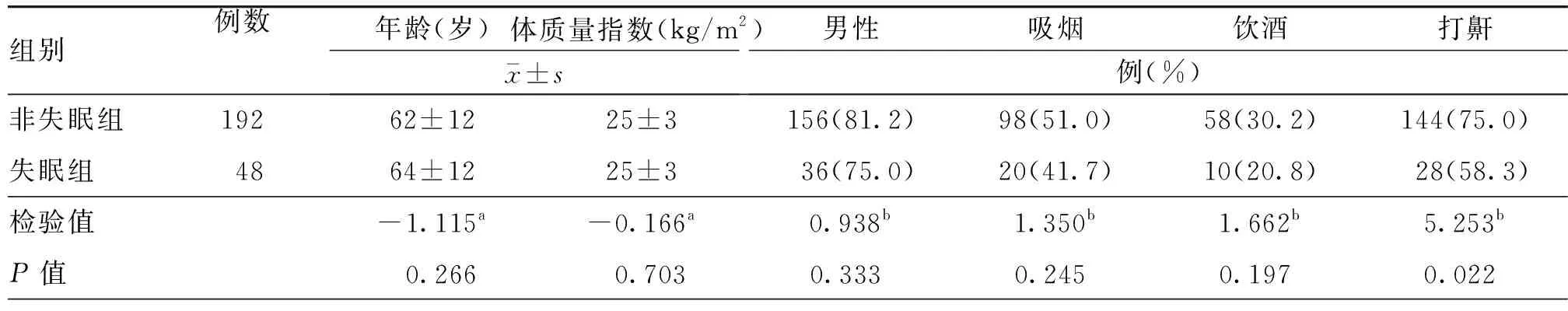
表6 血清TSH水平正常的急性缺血性卒中患者失眠组与非失眠组基线资料比较
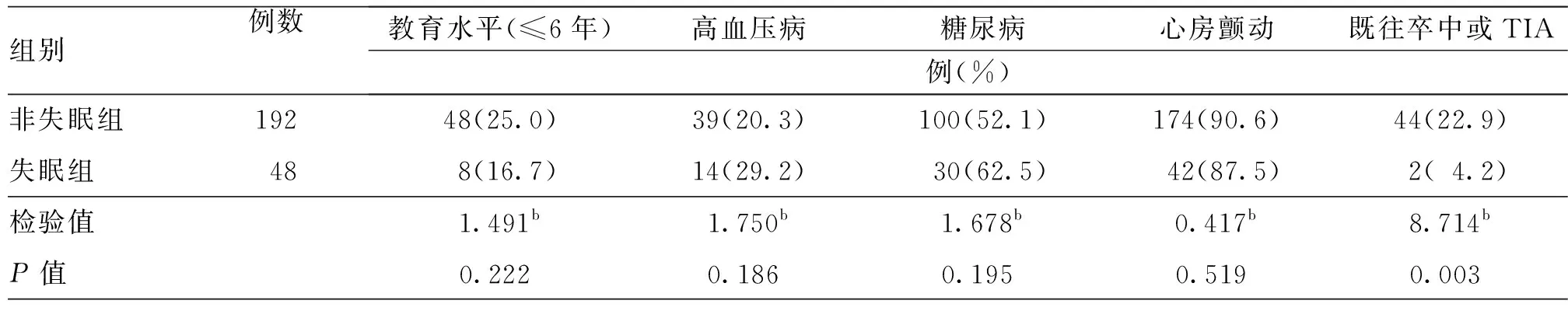
组别例数教育水平(≤6年)高血压病糖尿病心房颤动既往卒中或TIA例(%)非失眠组19248(25.0)39(20.3)100(52.1)174(90.6)44(22.9)失眠组04808(16.7)14(29.2)030(62.5)042(87.5)02(04.2)检验值1.491b1.750b1.678b0.417b8.714bP值0.222a0.186a0.195a0.519a0.003a
注:TSH为促甲状腺激素,TIA为短暂性脑缺血发作;a为t值,b为χ2值

表7 血清TSH水平正常的急性缺血性卒中患者失眠组与非失眠组甲状腺功能各指标比较
注:TSH为促甲状腺激素,FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺素,TT3为总三碘甲状腺原氨酸,TT4为总甲状腺素;a为Z值,b为t值
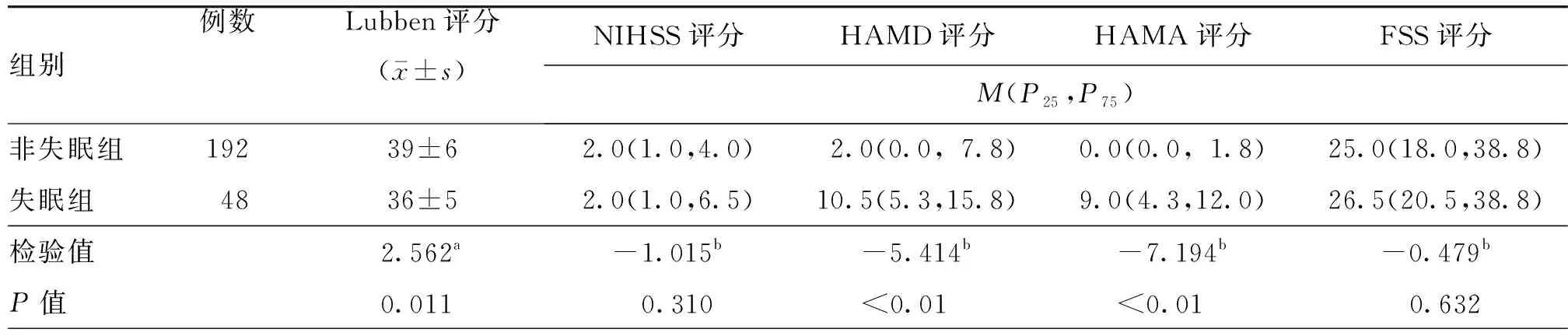
表8 血清TSH水平正常的急性缺血性卒中患者失眠组与非失眠组各量表评分比较(分)
注:TSH为促甲状腺激素,Lubben为Lubben社会网络量表,NIHSS为美国国立卫生研究院卒中量表,HAMD为汉密尔顿抑郁量表,HAMA为汉密尔顿焦虑量表,FSS为疲劳严重程度量表;a为t值,b为Z值
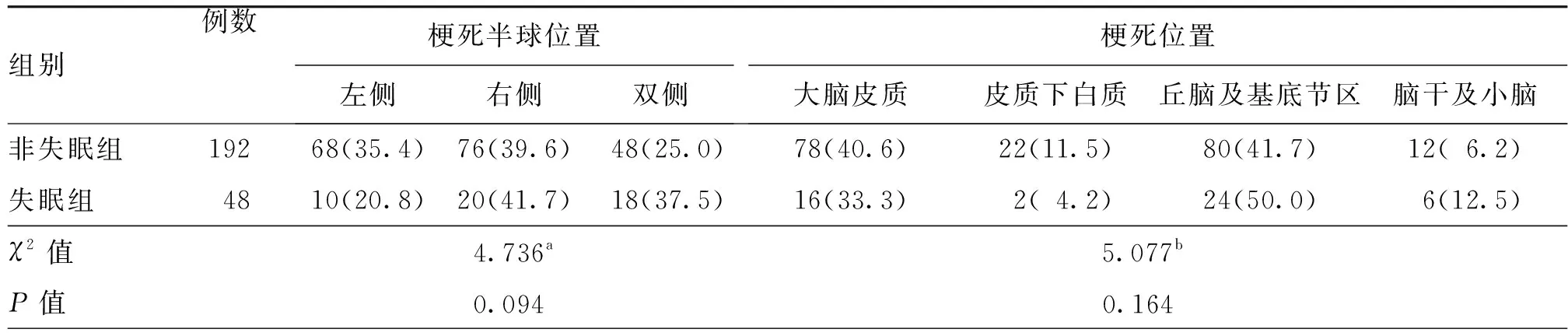
表9 血清TSH水平正常的急性缺血性卒中患者失眠组与非失眠组梗死部位比较[例(%)]
注:TSH为促甲状腺激素;a为χ2检验,b为Fisher确切概率法

表10 血清TSH水平正常的急性缺血性卒中患者早期新发失眠的多因素Logistic回归分析
注:TSH为促甲状腺激素,TIA为短暂性脑缺血发作,Lubben为Lubben社会网络量表,HAMA为汉密尔顿焦虑量表
对卒中患者发病前日常社会交际进行评估发现,社会网络关系越丰富的患者,卒中后越不容易发生失眠。这与既往失眠影响因素的研究中孤独、婚姻状况可影响失眠的结果一致[26-27],但目前尚缺乏社交关系与卒中后新发失眠的关联性研究。
本研究结果显示,既往卒中或TIA是卒中早期新发失眠的保护因素,提示既往发生卒中或TIA后未出现失眠的患者,当再次发生卒中时仍可能不易发生失眠。但本研究排除了既往卒中或TIA后失眠的患者,不排除存在选择偏倚的可能。本研究样本量较小,亦缺乏相关文献的支持,因此关于既往卒中或TIA是否与卒中复发时失眠有关尚不能确定,仍有待进一步研究。
本研究的优势在于这是首项针对卒中后新发失眠与甲状腺功能之间的相关性进行的研究,同时也存在一些局限性。首先,这是基于医院的单中心研究,样本量较小。其次,由于条件限制,本次研究并未涉及整个HPT轴,只纳入了甲状腺功能五项,甲状腺激素水平只在卒中急性期测量1次。尽管先前存在甲状腺相关异常的患者被排除在外,但仍然很难判断甲状腺激素的变化是发生在卒中之前还是之后,且入院后也未能进行动态监测。而且此次研究排除了昏迷、严重嗜睡等危重患者及失语、构音障碍等存在认知及交流障碍的患者,存在一定的选择偏倚。
关于卒中后睡眠障碍的研究,目前主要集中于睡眠相关呼吸障碍,而对于卒中后失眠的研究却很少[28]。卒中后新发失眠的发生机制,未来还需要开展多中心、大样本的前瞻性研究。
