高乌头的化学成分及药理作用研究进展
2019-05-15孙丽娜薛璇玑张新新詹冠群郭增军
张 蕾,孙丽娜,薛璇玑,张新新,詹冠群,张 卉,郭增军
(西安交通大学药学院,西安 710061)
高乌头(AconitumsinomontanumNakai)为毛茛科(Ranunculaceae)乌头属(Aconitum)牛扁亚属的多年生草本植物,以根入药,其入药部位习称网子七, 又名麻布七、辫子七等,主要分布于陕甘秦岭和太白山脉中。高乌头属陕西七药之一,是我国中西部地区广泛使用的中草药,具有理气止痛、祛风除湿和活血散瘀的功效,主治各种风湿性疼痛、关节肿痛、跌打损伤、急慢性菌痢、胃肠炎、瘰疬和疮疖等疾病[1]。高乌头的主要有效成分为高乌甲素,其氢溴酸盐已成为国内外广泛使用的非成瘾性中枢镇痛药[2]。
高乌头植物资源丰富,主要分布在陕西、青海、山西、甘肃、四川、湖北西部、河南西部和河北等地,目前主要作为临床镇痛药氢溴酸高乌甲素的提取原料[3]。为便于今后对高乌头进行深入系统研究,本文就高乌头的化学成分和药理作用等研究进行综述。
1 化学成分
高乌头化学成分以二萜生物碱为主,肖培根等[4]在前人的基础上将二萜生物碱细分为4大类:C18-型二萜生物碱、C19-型二萜生物碱、C20-型二萜生物碱和双二萜生物碱。按其分类将高乌头中的化合物进行整理,见表1和图1。
表1 高乌头中的化学成分
Tab.1 The chemical constituents inAconitumsinomontanumNakai

类型编号名称参考文献C18-二萜生物碱1高乌甲素[5-6]2冉乌碱[5-6]3N-去乙酰高乌甲素[7]4刺乌定[7]5刺乌宁[7]6excelsine[7]7N-去乙酰冉乌碱[7]88-O-acetylexcelsine[7]9高乌宁碱丁[8]10高乌宁碱戊[8]11高乌宁甲[8]12高乌宁乙[8]13高乌宁己[9]14高乌宁庚[9]15高乌宁辛[9]16高乌碱甲[10]17高乌碱乙[10]类型编号名称参考文献18冉乌定[11]19冉乌宁[11]20sinomontadine[12]21sinomontanine N[12]C19-二萜生物碱22高乌亭甲[13]23高乌亭乙[13]24高乌宁丙[13]25高乌宁壬[9]26去亚甲光飞燕草碱[14]27硬飞燕草碱[14]C20-二萜生物碱28septatisine[7]29来本宁[14]30sinomontanidine A[15]31sinomontanidine B[15]鞣花酸型生物碱32N-氯甲基塔斯品[11]其他类生物碱33苄索氯铵[11]非生物碱34牛扁酸单甲酯[6]
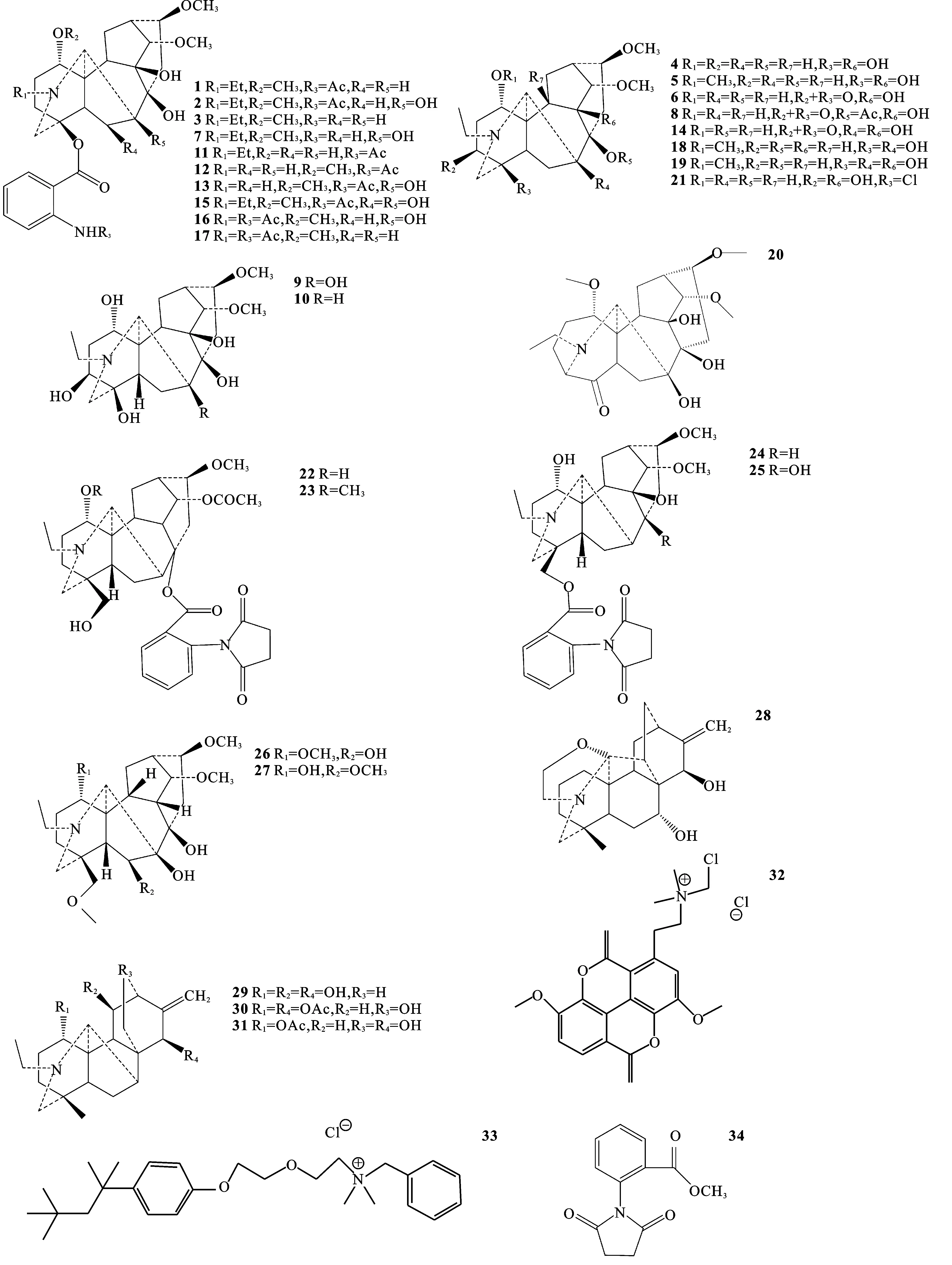
图1 高乌头中化学成分的结构
Fig.1 The structure of chemical constituents inAconitumsinomontanumNakai
2 药理作用
现代药理研究表明,高乌甲素(LA)具有镇痛、局部麻醉、抗炎、抗心律失常、抗肿瘤、抗菌、解热及抑制酪氨酸激酶活性等作用。高乌头所含的其他化学成分的活性研究则鲜有报道,仅N-去乙酰高乌甲素、ranaconitine、N-去乙酰冉乌碱、刺乌宁、刺乌定和excelsine有相关的活性报道,且主要是与LA在构效关系上的活性比较研究。
2.1镇痛作用 LA是国内首创的非成瘾性新型镇痛药,对于多种疼痛模型,如浸尾致疼模型、醋酸扭体模型、Ⅱ度烧伤模型、慢性压迫神经损伤模型及切口疼痛模型等均具有镇痛作用。One M等[16]对LA镇痛效果进行评测,用热板、夹尾、压尾、注射乙酸致小鼠扭体的疼痛模型和浸尾致大鼠疼痛、缓激肽诱导大鼠后肢屈肌反射、Randall-Selitto法进行评测,发现在以浸尾致大鼠疼痛模型的实验中,口服LA的镇痛效果比口服吗啡更强,在Randall-Selitto实验中,LA的镇痛活性比吗啡强。
研究发现,腹腔注射LA对脊髓背角中反应外周伤害性刺激P物质等神经递质呈剂量依赖性减少关系,说明LA有剂量依赖性镇痛作用;且术前给药组释放的 P 物质比术后给药组明显减少,表明LA具有超前镇痛的作用[17]。
LA发挥镇痛作用主要是通过抑制钠离子通道来提高体内的肾上腺素浓度和5-羟色胺的水平,进而发挥镇痛作用。在大鼠慢性压迫神经性损伤引起的疼痛模型中,当神经性疼痛发生时,LA通过抑制DRG神经元中P2X3受体的表达或者降低P2X3受体的敏感度抑制小鼠脊髓以上痛觉神经的传导进而增强机体内源性镇痛,产生镇痛作用。在Ⅱ度烧伤大鼠模型中,LA能通过上调大鼠中脑导水管周围可灰质中P2X3受体的表达进而增强机体内源性镇痛,产生镇痛作用[18-19]。
生物碱的镇痛活性与其结构有关。作为典型的 C18型二萜生物碱,LA局麻镇痛作用与A环上的叔胺基、C-8位上的乙酞氧基或乙氧基基团、C-14位的芳香酯以及D环的饱和状态密切相关[20]。与LA的氢溴酸盐相比,盐酸LA的镇痛作用较弱[21]。
2.2局部麻醉作用 LA具有局部麻醉作用,1 g·L-1LA的角膜局麻作用强度相当于质量浓度为8.4 g·L-1的可卡因;LA对小鼠坐骨神经的传导阻滞能力比可卡因和普鲁卡因分别强5.25和13倍;LA对豚鼠的阈麻醉浓度为0.28 g·L-1,比普鲁卡因和可卡因作用略强[22]。采用大鼠疼痛切口模型研究LA的局麻作用,发现LA其局部给药可阻断末梢伤害性感受器,P物质和谷氨酸等兴奋的递质无法作用感受器,使疼痛信息无法传入,因而NO生成也大为减少,从而发挥镇痛作用[23]。
通过研究乌头类生物碱的定量构效关系,发现局部麻醉作用的半数有效量(ED50)与化合物的相对分子质量、原子核之间的排斥力、空间势能和芳环C2′的活泼性有密切的关系,且与LA结构相似的二萜生物碱也具有局部麻醉作用,具有临床局部麻醉剂的潜力[24]。
2.3抗心律失常作用 LA是一种具有Ⅰ级抗心律失常作用的二萜生物碱,二萜生物碱诱发心率失常作用和抗心律失常作用与其结构有很大的关系[25]。LA及其衍生物与氢溴酸成盐后能够增强其抗心律失常的效果,当LA结构中的邻乙酰氨基苯甲酸甲酯基的C-5′位被卤元素(Cl、Br、I)取代后,无论在体内还是体外实验中,高乌甲素卤代盐的抗心律失常作用均强于LA,并且抗心律失常作用强弱依次为:LA-HBr>LA-HI>LA-HCl,但是仅C-5位溴代的LA无抗心律失常作用[26]。
Vakhitova I V等[27]从分子水平研究了氢溴酸LA的抗心律失常机制,发现氢溴酸LA抗乌头碱致心率失常作用主要是通过调控Na+、K+和Ca+通道相关基因的表达,进而控制不同阶段的动作电位的产生,发挥抗心律失常作用,同时氢溴酸LA抗心率失常作用也与乙酰胆碱和甘氨酸转运蛋白神经递质的参与有关。
2.4抗炎作用 LA对急性和慢性炎症均具有抑制作用。对于多种炎症模型,如二甲苯致小鼠耳壳肿胀、角叉菜胶致大鼠足肿胀、甲醛致大鼠足肿胀、佐剂致大鼠关节炎、琼脂致肉芽肿、大鼠脊髓钳夹损伤的炎症模型导致的毛细血管通透性增高及渗出、肿胀等有明显的抑制作用,同时可减少致炎因子及相关炎症介质、抑制毛细血管通透性,消除耳廓、足趾、关节、下肢肿胀、抑制芽肿形成。
胡建楣等[28]采用弗氏完全佐剂致大鼠佐剂性关节炎炎症模型说明LA具有抗佐剂性关节炎、减少致炎因子及相关炎症介质的抗炎作用。Wang Y Z等[29]研究改变血管通透性所致的急性炎症中LA的抗炎作用,发现其能够抑制蛋清所致大鼠足肿胀并且随着LA用量的增加,抑制效果增强。黄维艳等[30]采用大鼠脊髓钳夹损伤模型,观察到LA可减轻脊髓充血水肿,降低脊髓损伤发生后的脊髓IL-1β、TNF-α水平和升高脊髓IL-10水平,对脊髓损伤大鼠具有神经保护作用。
2.5抗肿瘤作用 LA可抑制肺癌原发灶和转移灶细胞的生长和增殖[31]。LA对非小细胞肺癌细胞株(A-549)具有抑制作用,其诱导非小细胞肺癌细胞株(A-549)凋亡,抑制作用与其浓度有关,作用机制可能是通过诱导肿瘤细胞凋亡、阻滞细胞周期、降低周期蛋白E1 (Cyclin E1)基因的表达等途径而发挥抗肿瘤效果[32-33]。氢溴酸LA能够抑制小鼠肝癌细胞和S180细胞的生长,且用药时小鼠的体质量不减轻,不良反应少[34]。硫酸LA对人肝癌细胞(Hep G2)的体外增殖具有抑制作用,可改变细胞周期分布,并诱导其凋亡[35]。高鸟甲素注射液体外对小鼠肝癌细胞株(H22)的生长、凋亡无影响[36]。氢溴酸LA具有微弱诱导人急性白血病细胞株(HL-60)分化和凋亡的作用[37]。
杨文艳等[38]以LA与芳香醛杂合化合物为原料,合成了一系列LA缩醛类化合物,其对人肝癌细胞(Hep G2)、人肺癌细胞(A-549)及人结肠癌细胞(HCT-8)的细胞毒性与LA相比显著增强。
2.6抗菌作用 LA对绿脓杆菌和伤寒杆菌具有较强的抑制作用[39]。从高乌头中分离得到的二萜生物碱去亚甲光飞燕草碱和来本宁也具有抗菌活性[40]。
2.7其他药理作用 LA对大鼠心肌缺血/再灌注损伤具有保护作用,其作用机制可能与其抗氧化作用有关[41];LA及其盐类化合物中的生物碱具有清除自由基的能力,表明其具有抗氧化作用[42];氢溴酸LA具有很强的抑制酪氨酸激酶活性,LA也具有抑制酪氨酸激酶活性[43]。
此外LA还具有解热、抗风湿、抗癫痫、免疫调节及抗血管新生等活性[44]。
3 杀虫作用
高乌头的甲醇提取物对3龄粘虫具有较强的毒杀活性,杀虫活性物质主要是生物碱[44]。从高乌头中分离得到的去亚甲光飞燕草碱和硬飞燕草碱对粘虫具有较好的杀虫活性,生物碱来本宁对粘虫具有诱食活性,以这3 种生物碱为主要有效成分研制出一种新型植物源杀虫剂0.5% AY高乌头水剂,该杀虫剂对菜青虫具有较好的防治效果,其已申请国家发明专利[45]。
4 降低高乌头毒性的方法及机制研究
高乌头生品有毒,LA是其毒性成分之一[46]。传统中药甘草、性甘、味平,有调和诸药的作用,研究发现,LA可能与甘草酸形成络合物从而影响生物碱的毒性及治疗活性[47]。李芸等[48]进行了正交实验,结果表明,高乌头的最佳炮制解毒工艺为加入质量浓度为100 g·L-1的甘草汁,以127 ℃、0.15 MPa 加压蒸 5 h。
5 结语
目前,对高乌头的研究尚不深入,只进行了初步的化学成分研究,药理作用的研究集中在氢溴酸LA上,在应用上主要作为镇痛药氢溴酸LA的原料药,而对其他化学成分的药理研究和其他方面的应用几乎没有。鉴于高乌头资源丰富、药用潜力大,同行应该深入研究,发掘潜在的药用价值,充分利用我国的高乌头资源。
