c-Myc蛋白对三阴性乳腺癌增殖迁移的影响
2019-05-10李常有于志强崔军威杨满朱丽璋韦伟
李常有, 于志强, 崔军威, 杨满, 朱丽璋, 韦伟
(北京大学 深圳医院 甲状腺乳腺外科, 广东 深圳 518036)
1 材料
1.1 材料与仪器
MDA-MB-231细胞(三阴性乳腺癌细胞),中国科学院上海细胞库.293-T细胞,中国科学院上海细胞库.CO2细胞培养箱,美国Thermo Fisher 公司.全波长酶标仪,美国Thermo Fisher 公司.corning costar Transwell细胞培养小室,美国康宁公司.蛋白电泳仪,美国Bio-Rad 公司10 cm培养皿,Nest公司24孔板,美国康宁公司倒置荧光显微镜,莱卡公司.
1.2 药品与试剂
DMEM高糖培养基,Gibco公司产品.澳洲胎牛血清,Gibco公司产品.Thiazolyl Blue Tetrazolium Bromide,sigma公司产品.Puromycin,invivogen公司产品.pLVX-U6-shRNA-EF1a-coGFP及包装质粒,深圳上为生物科技有限公司.Crystal violet,sigma公司.Lipofectamine 2000,Penicilin-Streptomycin,PierceTMBCA Protein Assay Kit,美国thermo Fisher公司.UltraSignal 超敏ECL化学发光底物,北京四正柏生物科技有限公司.Anti-c-Myc antibody[Y69]ab32072,abcam公司.Goat Anti-Rabbit IgG H&L (HRP) ab205718,abcam公司.c-mycshRNA载体,序列(GGAAACGACGAGA-ACAGTTGA), 深圳市上为生物科技有限公司.
1.3 实验方法
1.3.1 细胞培养
DMEM高糖培养基+质量分数为10%澳洲胎牛血清+质量分数为1%双抗,无菌条件下操作,3 d传代培养1次.
1.3.2 慢病毒包装
将pLVX-U6-c-mycshRNA-EF1a-coGFP载体、PCMV-VSVG、PCMV-Pax2共同转染293T细胞;pLVX-U6-NC-EF1a-coGFP载体、PCMV-VSVG、PCMV-Pax2共同转染293T细胞,24 h后观察到绿色荧光蛋白的表达,48 h后分别收获并浓缩病毒液,分装并长期储存于-80 ℃.
1.3.3 稳转细胞株的建立及筛选
将处于对数期的MDA-MB-231细胞收集,均匀铺于24孔板,10万/孔.将收集的病毒液分别感染目的细胞,48 h后观察荧光,并用含有Puromycin 4 μg/mL的高糖培养基筛选稳转细胞株.
假设2台机组正在运行,系统负荷变小时,冷冻供水泵将减小所供应的水量,机组感应到水量变小,即反映到机组的负荷相应减小,当2台机组的负荷达到或者小于1台机组的总负荷时,控制系统启动减机延时,延时一段时间后关掉其中一台机组,使另一台机组在高负荷状况下能够同时满足系统负荷的要求。
1.3.4 Western印迹分析
用PBS(pH7.4)洗涤细胞,用Pierce裂解液和蛋白酶抑制剂(按质量分数100 ∶1)混匀shRNA组和对照(NC)组细胞,提取蛋白.用牛血清白蛋白(BSA)作为标准,用BCA标准法测定蛋白质质量浓度[4],用质量分数为5%~10%SDS—PAGE分离等份的蛋白质(20 mg).将蛋白质转移至聚偏二氟乙烯膜(PVDF膜)上,将其在含质量分数为5%脱脂奶粉的TBST(含质量分数为0.05%Tween-20的TBS)中室温封闭1 h,然后在4 ℃用Anti-c-Myc antibody孵育过夜;TBST洗膜3次,每次15 min,羊抗兔IgG H&L孵育2 h,UltraSignal 超敏ECL化学发光底物显影.
1.3.5 c-myc敲低抑制三阴性乳腺癌细胞增殖的实验
对照组细胞和实验组肿瘤细胞以质量分数为10%的胎牛血清高糖培养基配成细胞2 000/孔的细胞悬液,96孔板培养(37 ℃,体积分数为 5%CO2).分别于24、48、72 h后,加入质量浓度为5 mg/mL的MTT溶液.全波长酶标仪490 nm处测量各孔的吸光值[5].
1.3.6 c-Myc敲低抑制三阴性乳腺癌细胞划痕愈合的实验
在6孔板内均匀铺细胞3×106/孔,12 h用20 μL枪头划直线,PBS洗2次,更换低血清(质量浓度<2%)培养基.将细胞放入37 ℃,体积分数为5%CO2培养箱中培养并于0、24 h拍照.
1.3.7 c-myc敲低抑制Transwell Assay
将实验组、对照组细胞以低血清培养基配成6×105/mL.取100 μL均匀铺于transwell上室,下室加入600 μL含质量分数为10%FBS的高糖培养基,选取24 h拍照.
1.4 统计学处理
c-Myc敲低对三阴性乳腺癌细胞增殖抑制率曲线图由GraphPad Prism 软件绘制.c-Myc敲低三阴性乳腺癌细胞划痕实验采用photoshop测量,GraphPad Prism绘图.c-Myc敲低抑制Transwell Assay由imagej2x统计,GraphPad Prism绘图.统计方法采用配对t检验,P<0.05为有显著统计学差异,P<0.01为有极显著统计学差异.
2 结果
2.1 c-Myc的基因敲低
应用倒置荧光显微镜观测GFP荧光表达水平,表明带有pLVX-U6-c-mycshRNA-EF1a-coGFP载体,pLVX-U6-NC-EF1a-coGFP载体的病毒感染成功(图1).紧接着对shRNA和NC组进行westernblot蛋白定量及灰度值统计分析.shRNA组蛋白表达量降低为NC组的1/3,重复3次,灰度值P<0.01为极显著统计学差异(图2).
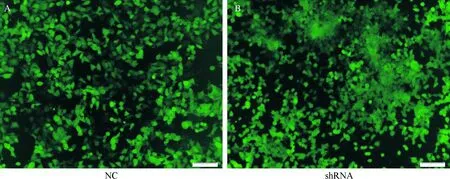
A:NC组GFP绿色荧光表达(×200); B:shRNA组GFP绿色荧光表达(×200)
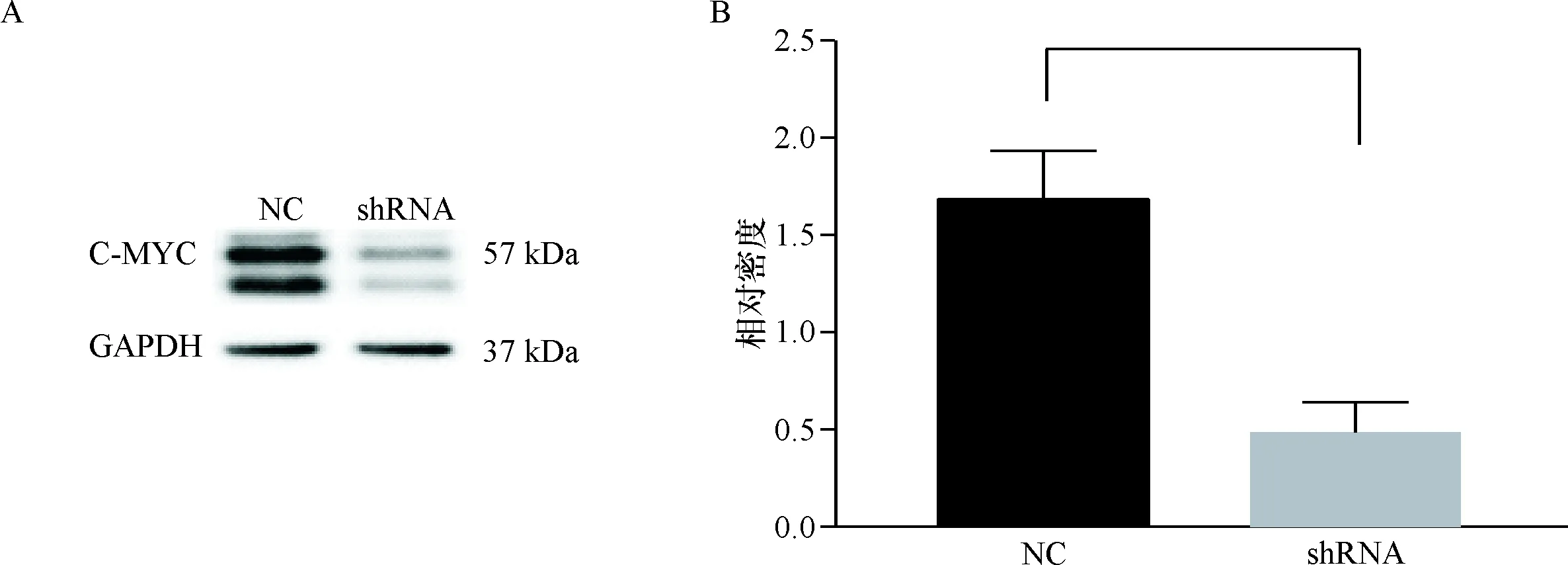
A:westernblot验证c-myc蛋白表达量; B:重复3次westernblot得到的灰度值测量统计图.
2.2 c-Myc蛋白对三阴性乳腺癌增殖影响
实验结果:与NC对照组比较,shRNA能抑制肿瘤细胞的增殖2倍.NC组和shRNA组MDA-MB-231细胞相同处理后,于24、48、72 h测量OD值,GraphPad Prism绘增殖曲线,shRNA组增值速率降低一半.24、48、72 h各时间点P<0.01(图3),具显著统计学差异.
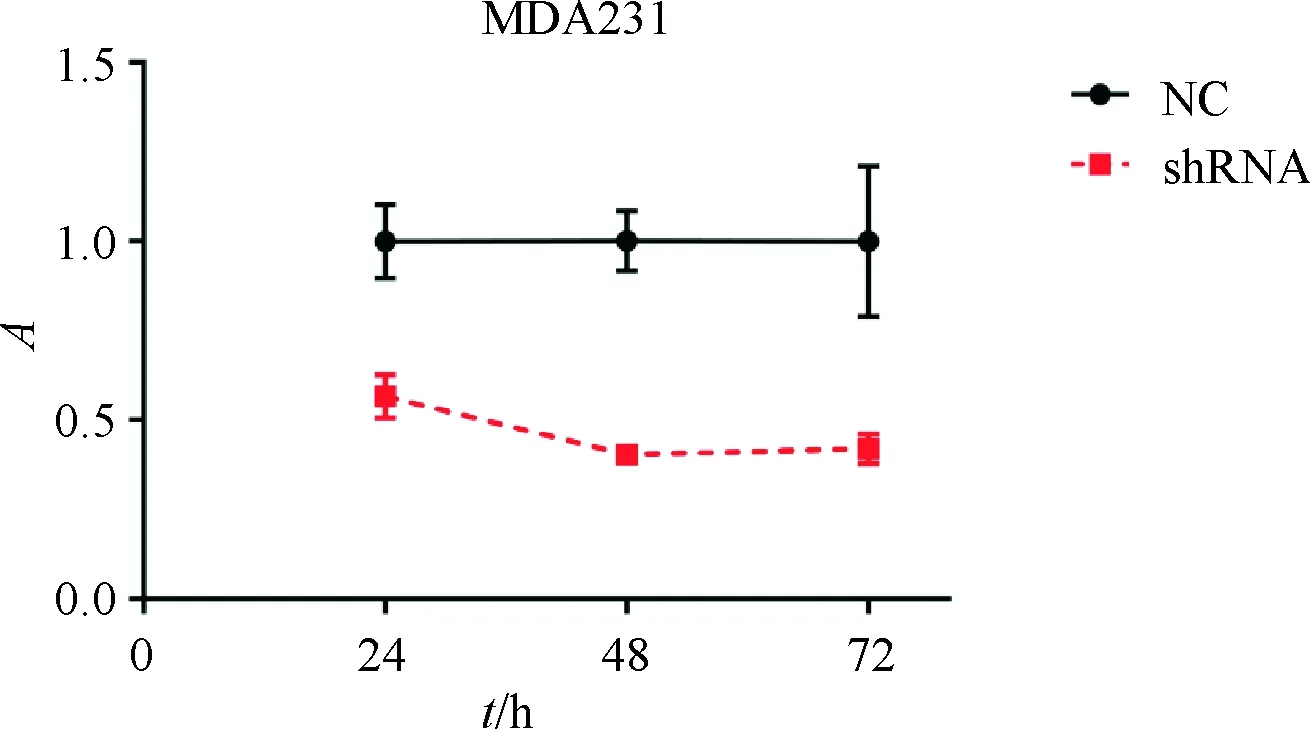
图3 c-Myc蛋白影响三阴性乳腺癌增值曲线
Fig.3 c-Myc protein affects the growth of triple negative breast cancer
2.3 c-Myc敲低抑制三阴性乳腺癌细胞划痕愈合
c-Myc蛋白敲低后,降低划痕愈合的速度,抑制三阴性乳腺癌的迁移.0、24 h,10倍镜下观察NC组和c-Myc敲低组划痕愈合情况,肉眼可见shRNA组愈合速度减慢(图4A),具极显著统计学差异(P<0.01,图4B).
2.4 c-myc敲低抑制Transwell Assay
从Transwell Assay结果证明shRNA组迁移率明显低于NC组.可观测出24 h,shRNA组迁移速率明显低于NC组(图5A).重复3次由imagej2x,GraphPad Prism统计分析,具极显著统计学差异(P<0.000 1,图5B),可得shRNA组迁移速率明显低于NC组.

A:0、24 h划痕镜下图(×200); B:划痕实验统计分析图
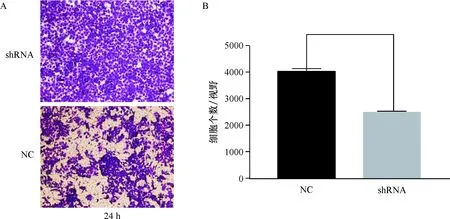
A: 24 h NC组和shRNA组迁移图(×200); B:重复3次统计图
3 讨论
c-myc基因已经被研究多年.在1983年Minna等[6]首次提出c-myc基因在肺癌中的高表达.随后人们发现c-myc基因在多种肿瘤中被激活[7].c-myc基因在30%~50%的高分化乳腺癌中高表达[8].在三阴性乳腺癌中,c-myc基因也显著高表达[9].
c-Myc蛋白的高表达也给乳腺癌患者带来了高风险,并且已有将c-Myc蛋白作为三阴性乳腺癌的肿瘤标志物的研究报道[10].其结果得到了Kaplan-Meier Plotter数据库的支持,Kaplan-Meier Plotter数据库对3 951名乳腺癌患者进行了生存相关性分析(图6),结果显示c-Myc蛋白与患者生存风险存在正相关性,c-Myc蛋白表达越低,死亡风险越低.c-Myc蛋白表达量在200个月后与生存相关性更加明显.c-myc基因的编码蛋白具有转录因子活性,有促进细胞增殖,调节细胞周期,降低细胞黏附性的作用[11].c-Myc蛋白作为转录因子,对MYC结合因子MAX具有特异性结合区域[12].这种结合复合物通过G1期调控细胞周期从而影响细胞增殖.本实验证明c-Myc蛋白的敲低,明显降低乳腺癌细胞的增殖(图3).c-Myc蛋白对细胞增殖的调控部分受到细胞周期依赖性激酶调控[13].在三阴性乳腺癌中c-Myc蛋白的高表达伴随着P53、RB等肿瘤抑制因子的丢失,可能进一步促进肿瘤的增殖、迁移[9-14].c-Myc蛋白的显著敲低可能导致MYC结合因子结合部位减少,进一步降低对G1期的调控而影响细胞的增殖.本实验结果表明c-Myc蛋白能促进肿瘤细胞的增殖,但尚未验证P53、RB、MYC结合因子的相关性,这有待进一步的探索.近年来,肿瘤的迁移侵袭机制逐渐被揭示,有学者认为细胞骨架重组是不可或缺的因素[15].由myc基因诱导的、与骨架蛋白F-actin息息相关的细胞间的嵌入和黏附力部分揭示了组织的迁移侵袭与被破坏[16].本实验结果证明应用shRNA敲低c-Myc之后肿瘤细胞迁移能力明显降低.这与相关文献报道一致.但是,c-Myc蛋白是如何影响三阴性乳腺癌的迁移功能,本实验尚未做出进一步研究.c-Myc蛋白作为增殖信号通路的重要成员,其下游分子CyclinD1、CyclinE、CDK4/6,P53、RB、F-actin等相关分子将作为新的方向来研究c-Myc蛋白对三阴性乳腺癌的功能影响.c-Myc蛋白对三阴性乳腺癌的明显促进作用、对早期三阴性乳腺癌化疗耐药的诱导作用都有利于进一步开发c-Myc抑制剂[17],给三阴性乳腺癌患者带来福音.
综上,三阴性乳腺癌因其表面受体均为阴性的特征,为临床治疗带来一定的受限.但是,c-Myc蛋白的高表达及对三阴性乳腺癌的增殖、迁移等功能的明显促进作用,在今后的治疗方面可能可以通过抑制c-Myc蛋白来调控三阴性乳腺癌的发展和愈后.
