猪PBD1成熟肽基因在干酪乳酸杆菌中的表达及其抑菌活性的检测
2019-05-10杨兴武韩昊莹郑慧华杨明凡陈红英
杨兴武,郭 奎,韩昊莹,赵 宇,郑慧华,杨明凡,3,陈红英,3*
(1.河南农业大学牧医工程学院,河南 郑州 450002;2.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069;3.郑州市猪重大疫病防控重点实验室,河南 郑州 450002)
防御素(Defensins)是一类大小仅有2 ku~6 ku、富含半胱氨酸的阳离子活性肽[1]。根据半胱氨酸的位置以及二硫键的大小不同,可以分为α、β、θ及植物和昆虫防御素[2]。猪β防御素-1(porcineβ-defensin-1,PBD1)是猪体内最早发现的防御素,广泛存在于猪消化道、呼吸道、肝脏等多种组织器官,在猪先天免疫系统中起重要作用[3]。罗刚在2002年将编码PBD1成熟蛋白的基因插入原核表达载体PinPoin t TMXa-3中,并在大肠杆菌JM 109中得到表达[4];姜丽华、江学斌等人在毕赤酵母中表达出PBD1成熟蛋白,并验证了其具有良好的抑菌效果[5-6]。
干酪乳酸杆菌是最早被广泛应用的益生菌之一,能够有效调节肠道微生物之间的平衡,增强机体的免疫力和抵抗力。其产生的非解离乳酸,对肠道致病菌尤其是大肠杆菌,具有很强的抑制作用[7]。许多学者利用基因重组技术,在菌株内转入外源基因(营养因子基因、抗性基因、酶基因等),使其表达目的蛋白[8],并且表达的蛋白可刺激粘膜产生免疫反应[9-11]。此外,由于乳酸杆菌仅有一层细胞膜,外源蛋白可以在信号肽的引导下直接分泌进入上清,更容易获得外源蛋白,可以直接将其添加到饲料中或者让新菌株再回到肠道内,在肠道内定居、增殖,除发挥原有的益生功能外,还能发挥外源基因的功能,达到一剂多功能的目的。因此,本研究将短小干酪乳酸杆菌信号肽(Signal peptide,SP)和PBD1成熟肽基因克隆到整合型表达载体pMJ67的Lac启动子下游,电转化干酪乳酸杆菌,通过红霉素筛选,获得稳定表达PBD1的重组干酪乳酸杆菌,为进一步研发广谱抗菌作用的微生态制剂奠定了基础。
1 材料与方法
1.1 质粒和菌株 含猪PBD1全基因序列(PBD1Q)的重组质粒pMD18-T-PBD1Q和pUCK-SP均由郑州市猪重大疫病防控重点实验室构建并保存;pMJ-67(+)载体和干酪乳酸杆菌感受态细胞由本实验室保存;大肠杆菌DH5α感受态细胞购自上海康为世纪有限公司。
1.2 主要试剂与培养基 PreMIX ExTaq、DNA Marker、异丙基 -β-D-硫代半乳酸酐(IPTG)、5-溴-4-氯-3-吲哚-半乳糖苷(X-gal)、T4 DNA连接酶、第一链合成试剂盒(HiFi-Script 1st Strand cDNA Synthesis Kit)、琼脂糖凝胶DNA回收试剂盒、高纯度质粒小提试剂盒等均购自康为世纪有限公司;小鼠抗His标签单克隆抗体(MAb),山羊抗小鼠HRP-IgG购自TaKaRa公司;限制性内切酶NdeⅠ、EcoRⅠ、KpnⅠ均购自美国Thermo公司。
1.3 引物的设计与合成 根据pMD18-T-PBD1Q中PBD1Q基因序列,设计1对特异性引物P1/P2,(P1:5'-GGGGGTACCAAAAACATAGGAAATTC-3'/P2:5'-TCTTTGAATTCTTAGTGGTGGTGGTGGTGG TGCCCGCTGCCGCCGCTGCCGCCCTTCCTTTTGCA GCATTTGAC-3'),扩增编码PBD1的成熟肽基因,上、下游引物5'端分别加入KpnⅠ和EcoRⅠ酶切位点,并在下游加上柔性蛋白linker(下划线部分)和6个组氨酸(his标签:斜体部分)。预期扩增片段为168 bp。引物由英潍捷基(上海)贸易有限公司合成。
1.4 整合性表达质粒pMJ67-SP-PBD1的构建
1.4.1 重组质粒pUCK-SP-PBD1的构建及鉴定利用引物P1/P2,以质粒pMD18-T-PBD1Q为模板,PCR扩增PBD1,采用KpnⅠ和EcoRⅠ双酶切PCR产物,电泳后回收PBD1片段,克隆至同样处理的pUCK-SP载体,构建重组质粒pUCK-SP-PBD1,并经PCR和酶切鉴定。
1.4.2 重组表达质粒pMJ67-SP-PBD1的构建及鉴定利用NdeⅠ和EcoRⅠ分别酶切pUCK-SP-PBD1和pM J67载体后将酶切产物SP-PBD1基因克隆到线性化的pMJ67载体,构建重组质粒pMJ67-SP-PBD1,并经PCR、酶切及测序鉴定。
1.5 电转化及重组乳酸杆菌的鉴定 将5μL pM J67-SP-PBD1与100μL干酪乳酸杆菌感受态细胞轻轻混匀后,转入0.1 cm的预冷电击杯中,冰浴10min,在电转仪中电击一次后立即加入900μL 10%蔗糖的MRS复苏培养基(MES、500 mmol/L蔗糖、20 mmol/L和2 mmol/L CaCl2)。然后将菌液转移到1.5m LEP管中,37℃厌氧孵育3 h,室温5 000 r/min离心5 min,弃去上清。取80μL菌液涂布于含5μg/m L红霉素的MRS固体培养板,37℃厌氧静置培养48 h。挑取单菌落接种于5 m L含5μg/m L红霉素MRS液体培养基中,37℃厌氧静置培养18 h。提取菌液基因组DNA,利用P1/P2引物,PCR扩增PBD1基因。并对PCR产物进行测序与分析。
1.6 半定量RT-PCR分析PBD1的转录水平 挑取经鉴定正确的重组猪PBD1干酪乳酸杆菌单菌落接种于5 m L含5μg/m L红霉素MRS液体培养基中,37℃厌氧静止培养18 h。取1 m L菌液,转接到50 m L含2%乳糖MRS液体培养基中,37℃厌氧分别诱导培养12 h、14 h、16 h、18 h、20 h。每个时间点各取2 m L菌液。利用总RNA提取试剂盒提取重组猪PBD1干酪乳酸杆菌总RNA,按照反转录试剂盒说明书反转录为cDNA,以其为模板利用P1/P2引物,PCR扩增PBD1基因。同时用Alphalmager HP系统软件检测不同时间点PBD1基因条带灰度值,以猪PBD1基因对内参基因(16S rRNA)的灰度值记录结果并对其进行分析。
1.7 PBD1蛋白的 western blot检测 取5 m L含重组质粒pMJ67-SP-PBD1的重组乳酸杆菌,接种至200m L含2%乳糖的MRS培养基中诱导培养过夜,同时以含pMJ67的重组乳酸杆菌为对照。取上述菌液12 000 r/min离心10 min,菌液上清通过超滤柱浓缩后加入10 m L PBS悬浮并超声破碎,离心后的上清及沉淀以及未破碎的重组乳酸杆菌菌液上清一起,进行SDS-PAGE检测,以小鼠抗His标签单克隆抗体(MAb)为一抗(1∶2 000),山羊抗小鼠HRP-IgG为二抗(1∶5 000),western blot分析。
1.8 重组蛋白抑菌活性的初步检测 用乳糖分别诱导空载体和pMJ67-SP-PBD1的重组菌,超声破碎后离心收集上清液。采用琼脂扩散试验进行重组蛋白抑菌活性的检测:取100μL葡萄球菌液均匀涂布于普通营养琼脂平板上,待菌液吸收完全,打孔器均匀打孔。每孔加入100μL重组PBD1蛋白上清液,37℃培养24 h,观察重组PBD1蛋白对金黄色葡萄球菌的抑菌现象。
2 结果
2.1 重组质粒pUCK-SP-PBD1的PCR及酶切鉴定结果 对构建的pUCK-SP-PBD1进行PCR扩增,获得1条约170 bp的目的片段。重组质粒经KpnⅠ和EcoRⅠ双酶切后出现了2条带,与预期结果相符(图略)。表明构建了重组质粒pUCK-SP-PBD1。
2.2 重组质粒pMJ67-SP-PBD1的构建及鉴定对pUCK-SP-PBD1进行双酶切获得SP-PBD1再将其克隆至载体pMJ67中构建重组质粒pMJ67-SPPBD1。对重组质粒pM J67-SP-PBD1进行PCR扩增鉴定,结果显示获得1条约170 bp的目的片段。重组质粒经KpnⅠ和EcoRⅠ双酶切后出现了2条带,与预期结果相符(图1)。对所获的基因序列测序分析,结果显示分别与GenBank中登录的PBD1基因序列(NM 213838)和短小乳酸杆菌(L.brevis)S-层蛋白信号肽基因序列(Z14250)同源性为100%,表明正确构建重组质粒pMJ67-SP-PBD1。

图1 重组质粒pMJ67-SP-PBD1的酶切鉴定Fig.1 Identification of recombinant plasmid pMJ67-SP-PBD1 by enzyme digestion
2.3 重组乳酸杆菌的PCR鉴定及序列测定 提取经红霉素筛选为阳性的乳酸杆菌DNA,并使用引物P1/P2进行PCR扩增,结果显示获得1条约170 bp的目的片段,与预期相符(图2)。测序结果进一步表明猪PBD1基因整合至干酪乳酸杆菌中。
2.4 RT-PCR检测猪PBD1的转录水平 使用AlphaImageHP凝胶成像分析系统,对RT-PCR扩增的PBD1基因对应的各个条带的吸光度值进行分析,结果显示,在诱导12 h、14 h、16 h、18 h、20 h时,PBD1基因相对灰度值分别为 0.62、0.87、1.41、1.57、1.46,将不同时间点的灰度值依据时间的变化制作灰度值变化曲线,显示重组乳酸杆菌诱导18 h时,猪PBD1转录水平相对较高(图3)。

图2 重组乳酸杆菌的PCR鉴定Fig.2 Idendification of recombinant L.casei by PCR
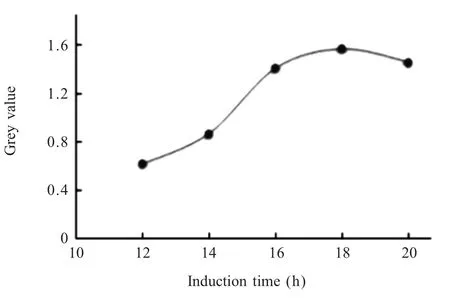
图3 PBD1基因灰度值变化曲线Fig.3 The change of grey values curves for PBD1 gene
2.5 Western blot检测猪PBD1蛋白的表达 Western blot结果显示,含重组质粒pMJ67-SP-PBD1的重组菌,经乳糖诱导后重组菌的上清、重组菌破碎后上清、破碎后沉淀中均有一条约5.8 ku的蛋白,而对照pMJ67的重组菌未见任何条带(图4)。表明重组干酪乳酸杆菌表达了猪PBD1蛋白。采用Alpha Image Hp凝胶成像系统对胞内目的蛋白(PBD1-6xHis)的特异性条带进行灰度值分析,显示胞内表达的PBD1重组蛋白主要以可溶性形式表达。
2.6 重组PBD1蛋白的抑菌活性检测结果 采用琼脂打孔扩散法检测重组PBD1对葡萄球菌的抑制作用,结果显示,与仅含空载体的重组菌相比,含pM J67-SP-PBD1的重组菌表达的PBD1对葡萄球菌有明显地抑制作用(图5A、5B)。
3 讨论

图4 重组PBD1蛋白表达的western blot鉴定Fig.4 Western blotanalysisof recombinantPBD1 protein in Lb.casei
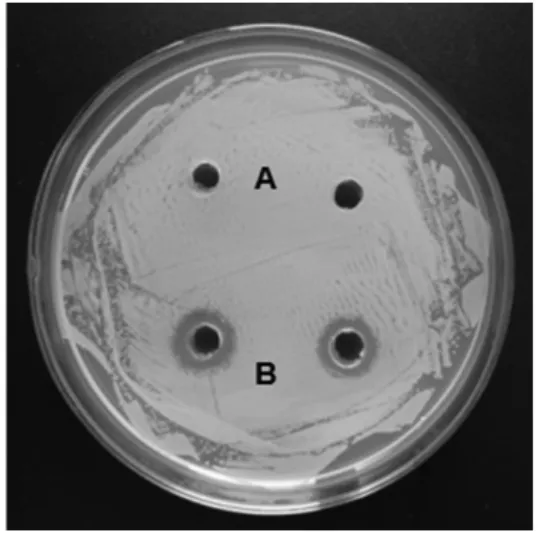
图5 重组PBD1蛋白的抑菌活性检测Fig.5 Antibacterial activity of recombinant PBD1 protein
PBD1基因编码区全长195 bp,共编码64个氨基酸,其中前21个氨基酸残基为信号肽,后42个氨基酸残基编码猪PBD1成熟蛋白。研究表明PBD1对大肠杆菌、金黄色葡萄球菌和肺炎放线杆菌具有体外抑菌作用[12],而且对宿主天然和获得性抗感染免疫具有重要调节作用,并通过对感染局部环境的改善而提高宿主抗感染能力[13]。考虑到在原核表达系统大肠杆菌内表达含信号肽的真核基因,会导致表达的重组蛋白易形成包涵体,且不利于重组蛋白复性,而影响其生物学活性[14-15]。因此,本实验仅选取编码PBD1成熟肽的129 bp核酸序列,并在其前面加上干酪乳酸杆菌自身SP,这样表达的PBD1成熟肽便可以在干酪乳酸杆菌SP作用下直接分泌到胞外。本实验构建的干酪乳酸杆菌表达系统不仅实现PBD1蛋白的可溶性表达,而且更有利于蛋白的纯化。
本实验对重组猪PBD1在干酪乳酸杆菌中的表达情况分别在mRNA转录水平和蛋白水平进行了分析。将转化pMJ67-SP-PBD1的干酪乳酸杆菌在含乳糖的MRS培养基中进行诱导,在诱导18 h时PBD1mRNA转录水平达到峰值。经western blot分析显示,重组乳酸杆菌诱导18 h后的菌体破碎后上清及沉淀中均表达了约5.8 ku的目的蛋白,与预期猪PBD1蛋白大小相符。抑菌试验显示,表达的重组蛋白对金黄色葡萄球菌具有较好的抑菌活性。本研究将进一步对猪重组PBD1的抑菌、抗病毒活性进行验证,为研发具有广谱抗菌作用的微生态制剂奠定基础。
