多基因型黑果枸杞高效快繁体系的建立
2019-05-09戴逢斌刘丽萍李艾佳饶书培陈金焕
戴逢斌 刘丽萍 李艾佳 饶书培 陈金焕
(北京林业大学生物科学与技术学院 林木育种国家工程实验室,北京 100083)
黑果枸杞(Lycium ruthenicumMurr.)为茄科枸杞属多年生多棘刺灌木[1]。果实味甘、性平,富含多种蛋白质、维生素、微量元素及矿物质,尤其富含天然原花青素,可预防并治疗多种疾病,可入药、制茶、防风[2-4]。黑果枸杞植株具有较强的抗逆性,耐盐碱、抗寒、抗旱,可用于盐碱地防风固沙、水土保持及绿化,是集生态价值、经济价值、营养价值、药用价值为一体的野生灌木树种,在生态建设和区域经济发展中有巨大的应用前景[5]。黑果枸杞主要分布在我国的西北部,集中在青海柴达木盆地(格尔木、都兰、德令哈等地区)、甘肃河西走廊(瓜洲、玉门、靖远等地区)、内蒙古的额济纳旗、阿拉善左旗和右旗以及新疆塔里木盆地(沙雅、阿克苏、库尔勒、巴楚)等地,各自然群体具有丰富的表型多样性和遗传多样性[6-9]。丰富的表型多样性和遗传多样性是遗传育种的基础,因此,保护其天然遗传资源对黑果枸杞的遗传多样性研究具有重要意义。
近年来,对黑果枸杞的野蛮采摘导致其野生资源破坏严重,野生资源濒临灭绝,对黑果枸杞野生资源的合理保护与利用已迫在眉睫[10]。黑果枸杞野生资源量在西北地区极为丰富,根蘖育苗、种子育苗、嫩枝扦插育苗都极为容易,组织培养体系建立可能更有利于转化体系构建。根蘖育苗需提前截断主根,待春季使其萌发新苗,再挖取主根旁萌发的根蘖苗移栽,且移栽过程中多需携带部分母根才能成活,因此该方法对母株的影响较大,往往影响母株的正常生长[11]。种子育苗由于对温度要求较高,在播种前需进行种子处理,且为提高发芽率和幼苗成活率,需安装喷灌设施,且温室中种植的黑果枸杞由于茎叶柔嫩,易受到大青虫和蝼蛄的危害[12]。扦插育苗时间受季节气候的影响较大,一般于4月中下旬萌发前或秋季进行扦插[13]。植物组织培养技术既可以保留植株原有的基因型和优良性状,又可将优良单株快速繁殖成无性系,迅速在生产应用中推广[14]。因此,对黑果枸杞的组培快速繁殖研究尤其重要。
目前,对黑果枸杞的组织培养快繁研究已取得一定进展,包振华等[15]发现培养基中细胞分裂素占比高时易产生愈伤组织,不定芽数量减少,叶片多,不适合继代,且1/2MS的生根率高于MS。杜敏智[16]采用大果黑果枸杞的嫩茎段为材料,发现ZT对大果黑果枸杞增殖培养的效果要显著优于6-BA,且在大果黑果枸杞的增殖培养过程中,提高光照强度、增加光照时间,或增加培养基中琼脂浓度,可有效减少组培苗玻璃化程度。孙晓红[17]以黑果枸杞成熟叶片为外植体,诱导愈伤组织及不定芽的分化,发现适当增加6-BA会增加愈伤组织诱导率和分化率,但玻璃化也更加明显。
虽然目前已有部分关于黑果枸杞组织培养的研究报道,但都局限于单一种源(品种)培养条件探索,因此,常出现在各阶段培养基条件的摸索中,不同实验室对所采集的不同种质苗采用同一培养基配方时,仅有部分或几乎都不能正常生长,给黑果枸杞的工厂化育苗带来不便。此外,大部分报道中都提到不同程度的玻璃化的现象,说明玻璃化问题没有得到根本解决。
本试验以7个不同种源地的黑果枸杞为研究材料,通过不同培养基的设置,分析不同浓度生长素及细胞分裂素在黑果枸杞生根及分化过程中的影响,旨在提供一种适用于黑果枸杞不同种质资源、具有普遍适用性且操作过程简单方便、成苗繁殖速度快、成活率高的高效快速繁殖方法,为黑果枸杞的后续功能研究及大规模育种奠定基础。
1 材料与方法
1.1 材料
从新疆阿克苏(AKeSu,简写为AKS)、库尔勒(KuErLe,简写为KEL)、巴楚(BaChu,简写为BC)、沙雅(ShaYa,简写为SY)和青海格尔木(GeErMu,简写为GEM)、大格勒(DaGeLe,简写为DGL)以及内蒙古阿拉善左旗(ALaShan,简写为ALS)(名称下同)等7个地区收集到的不同种源的野生黑果枸杞种子及叶片。
1.2 方法
1.2.1 种源亲缘关系鉴定 通过采集7个种源黑果枸杞的叶片进行转录组测序并鉴定了黑果枸杞的EST-SSR位点,根据黑果枸杞SSR位点,设计引物,提取黑果枸杞叶片DNA进行扩增,从中选取条带清晰、多态性良好的引物,在其5′端添加荧光后重新合成荧光引物,重新扩增并进行毛细管电泳,根据毛细管电泳结果对7个种源地进行遗传多样性分析。
1.2.2 外植体消毒 将不同地区收集到的野生黑果枸杞种子,挑选饱满个大、形状均一的一定数量种子,装入无菌的2 mL离心管,先用2 mL 75%酒精消毒30 s,用无菌蒸馏水冲洗2-3次,然后用2 mL 70%的84消毒液消毒6 min,蒸馏水再冲洗4-5次,吸干水分,用已灭菌的镊子接种于Murashige和Skoog(MS)基本培养基(MS 4.43 g/L+蔗糖30 g/L+琼脂6 g/L,pH 5.8-6.0),制备无菌苗,长出的小苗待用。
1.2.3 培养条件 将黑果枸杞材料放置于北京林业大学林木育种国家工程实验室组培室,培养温度为(25±2)℃,光周期16 h/8 h(昼/夜),光照强度3 000 lx。
1.2.4 嫩茎段诱导不定芽分化培养基的筛选 种子萌发后,待幼苗长至5 cm时,将其剪成约1 cm的茎段,去除叶片,分别转接至含不同浓度的6-BA和IAA的MS分化培养基中,诱导分化丛生芽。以MS+蔗糖30 g/L+琼脂6 g/L+6-BA 0.1 mg/L+IAA 0.2 mg/L(单位下同)为启动培养基进行不定芽诱导,根据诱导情况,在此培养基基础上调整不同浓度的激素组合(表1),选出适于不同种源黑果枸杞茎段诱导分化的培养基。
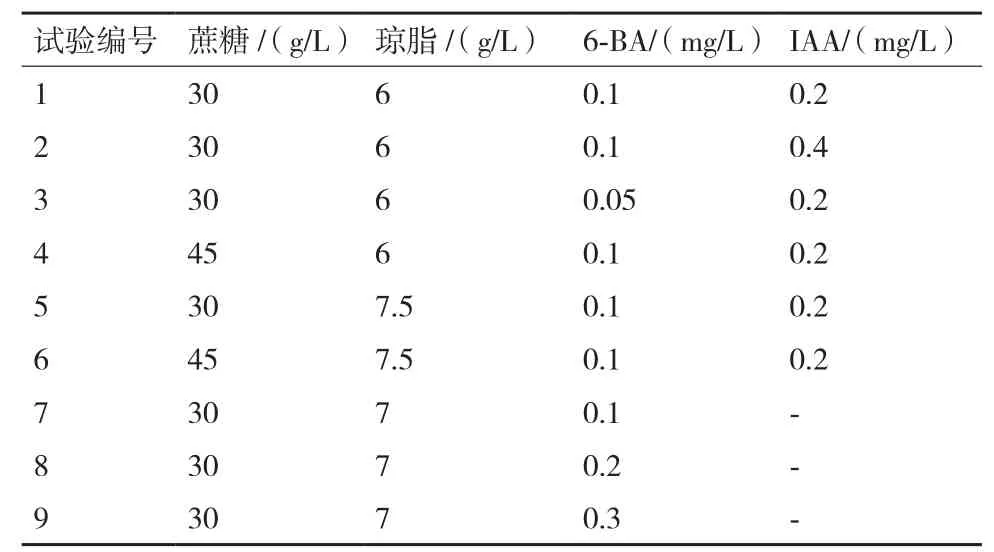
表1 茎段诱导分化培养基的筛选设置
1.2.5 叶片诱导不定芽分化培养基的筛选 选取生长良好的不同种源和培养基,挑选成熟的叶片,接种于含不同6-BA浓度的培养基上。每个种源接5瓶,每瓶接5-6个生长旺盛的叶片。所用培养基为MS+蔗糖30 g/L+琼脂6 g/L+6-BA 0.5 mg/L+NAA 1.0 mg/L及MS+蔗糖30 g/L+琼脂6 g/L+6-BA 1.0 mg/L+NAA 1.0 mg/L。
1.2.6 茎段诱导生根培养基的筛选 选取长势良好、生长一致的种源和株系,将不定芽或幼苗剪成约2 cm,且带有1-2个小叶片的茎段,分别接种于不同的生根培养基中,每个种源接种3株×8瓶,共24株。研究不同组合的激素对黑果枸杞诱导生根的影响,一周后统计生根情况,并计算生根率。生根率(%)=生根幼苗数/接种总幼苗数。根据已有文献报道,适宜诱导黑果枸杞生根的培养基为MS+IBA 0.6 mg/L+NAA 0.4 mg/L[17],但根据包振华等[15]研究,培养基中添加1/2MS的平均生根率高于MS和1/4MS,因此本研究以此激素组合为启动培养基,并添加1/2MS粉(2.18 g/L),根据不同种源的黑果枸杞生根情况,分别改进不同浓度的激素组合,探索适于不同种源黑果枸杞生根的培养基(表2)。

表2 茎段诱导生根培养基的筛选设置
2 结果
2.1 种源亲缘关系鉴定
根据前期基于黑果枸杞转录组序列的EST-SSR标记开发分析,通过毛细管电泳,对扩增产物峰值进行分析,构建了7个种源地聚类分析图(图1),阿克苏种源与库尔勒种源的黑果枸杞在遗传上相近,格尔木与大格勒遗传距离较近,巴楚与沙雅相近,并且与格尔木、大格勒的遗传距离较其他3个种近,而内蒙古的阿拉善独立为一支,没有与之最相近的种源地。

图1 7个黑果枸杞种源地聚类分析图
2.2 嫩茎段诱导不定芽分化培养基的筛选
在筛选嫩茎段诱导不定芽的培养基过程中,启动培养基MS+蔗糖30 g/L+琼脂6 g/L+6-BA 0.1 mg/L+IAA 0.2 mg/L分化前期有明显的玻璃化倾向,后期几乎所有茎段分化的不定芽均严重玻璃化,叶片肥厚,水分含量大,生长停滞(表3)。

表3 不同培养基诱导茎段分化丛生芽的比较
通过增加IAA浓度的方式,达到降低6-BA在培养基中激素比例的目的,6 d时部分基因型有芽点长出,但后期茎段诱导分化出的不定芽仍然严重玻璃化;培养基中降低6-BA浓度,10 d时所有茎段表面分化出的不定芽小叶正常,30和45 d时,发现不定芽与前期相比,大小保持在刚分化状态,生长缓慢,但无玻璃化;
增加蔗糖浓度,培养6 d时,发现茎段表面已分化出绿色的小芽点,12 d后,芽点已发育成很小的不定芽,但有明显的玻璃化倾向;增加琼脂浓度,分化情况和增加蔗糖时类似,虽然能分化出不定芽,但有较明显的玻璃化倾向;蔗糖和琼脂浓度均增加时,能诱导出不定芽,但是玻璃化现象依然存在。增加琼脂浓度,依然加入0.1 mg/L 6-BA,不添加IAA,培养5 d时,茎段表面有绿色的小芽点生成,8 d时芽点已继续分化为小的成形的不定芽,所有基因型也无玻璃化出现,培养基稳定,后期可以长成正常的丛生芽。在前面的基础上增加6-BA浓度至0.2 mg/L,培养4 d时,有小芽点生成,但是生长缓慢,后期叶片肥厚,玻璃化严重,生长停滞。继续增加6-BA浓度至0.3 mg/L,虽能诱导出不定芽,但后期也存在严重的玻璃化现象。
2.3 叶片诱导不定芽分化培养基的筛选
先以新疆的沙雅(SY)、阿克苏株系2(AKS-L2)、阿克苏株系3(AKS-L3)的成熟叶片作为代表材料,接种30 d,可以看到部分叶片伤口处愈伤组织分化出不定芽,还有很多即将分化成不定芽的芽点(图2)。45 d时统计芽诱导情况(表4),在得到更多的种源材料后,发现在6-BA浓度为1.0 mg/L时均能分化出不定芽,其中GEM、DGL、KEL、BC均分化良好,内蒙古的ALS分化效果次之。
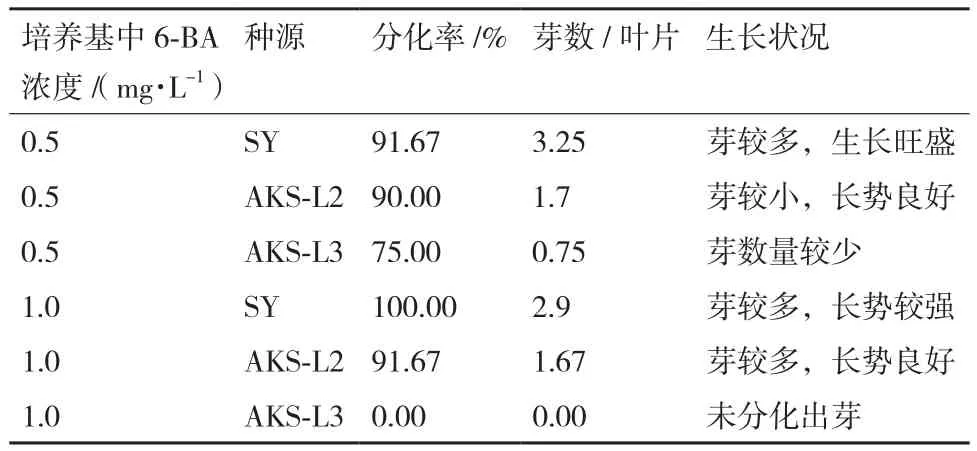
表4 叶片诱导不定芽分化结果

图2 不同种源黑果枸杞叶片分化30 d不定芽生长情况
2.4 茎段诱导生根
为观察植株生根情况,先以植物凝胶作为凝固剂。在1/2MS+蔗糖30 g/L+植物凝胶2 g/L+IBA 0.6 mg/L+NAA 0.4 mg/L的培养基中,以阿拉善(ALS)、沙雅(SY)、大格勒(DGL)、库尔勒(KEL)、阿克苏株系1(AKS-L1)作为种源,在接种20 d时统计生根情况,发现所有黑果枸杞植株基部只膨大形成愈伤,不生根。因此,该培养基并不适合黑果枸杞的生根。
对于1/2MS+蔗糖30 g/L+植物凝胶2 g/L+IBA(0.2、0.25、0.4、0.5、0.75、0.8 mg/L),以添加不同浓度梯度IBA作诱导激素,以格尔木(GEM)种源为材料,培养10 d后统计生根情况(表5)。接种的所有茎段生根率极低,茎段基部有膨大长成的愈伤组织。培养20 d时,大部分都还未生根,茎段基部只膨大长成愈伤。30 d时,发现只有少数茎段产生新生根,且具有明显的偶然性。添加0.2、0.25、0.4、0.5、0.75和0.8 mg/L浓度的IBA,其生根率依次为36%、8.33%、4.17%、4.16%、4.16%和2.5%。总之,在这几类培养基中,黑果枸杞生根启动时间明显延迟,即使生根,生根数量也稀少,且长势较弱。因此,影响生根的可能的因素仍需要进一步深入探究。
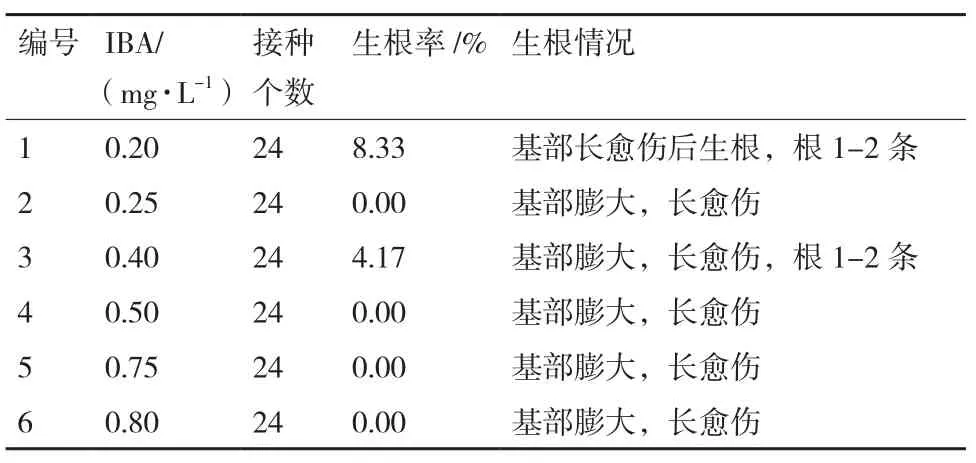
表5 20 d时不同IBA浓度下GEM种源黑果枸杞植株生根情况
对于1/2MS+蔗糖30 g/L+琼脂7.5 g/L+IBA 1 mg/L组合,以阿克苏株系1(AKS-L1)、阿克苏株系2(AKS-L2)、阿克苏株系3(AKS-L3)、阿克苏株系7(AKS-L7)、大格勒(DGL)、沙雅(SY)等6个种源为材料,培养13 d时统计生根率(表6),各种源或同一种源的不同株系无菌苗均有生根,但生根率不高,在6%-30%。
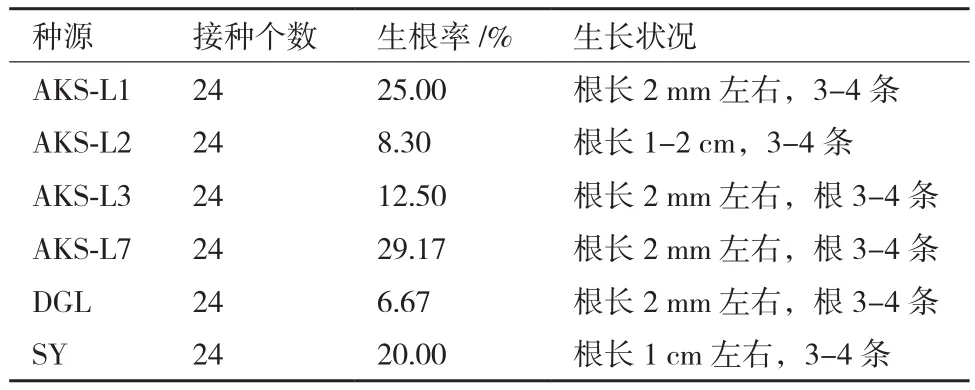
表6 IBA浓度为1 mg/L时各种源生根情况
在1/2MS+蔗糖30g/L+琼脂7.5 g/L+IBA(0.1、0.25 mg/L)两种组合下,根据种源聚类关系分别以4个具有代表性的阿拉善(ALS)、沙雅(SY)、格尔木(GEM)、阿克苏株系3(AKS-L3)种源为材料,将生长健壮的不定芽转接至新的诱导生根培养基中。发现植株地上部分开始逐渐长高,培养5 d时,大部分植株从底部开始生根;14 d时,当IBA为0.1mg/L时(表7),接种的几个种源植株均有生根,根长在0.2-1 cm不等。21 d时,根明显伸长,且有明显的根毛。在IBA浓度为0.25 mg/L时(表8),各种质苗茎段基部均没有膨大,直接生根。相比较而言,IBA浓度为0.25 mg/L时生根率更高,效果更好,且生根早,5 d左右即开始生根,20 d后,几乎所有接种茎段均能生根。

表7 IBA浓度为0.1 mg/L时各种源生根情况
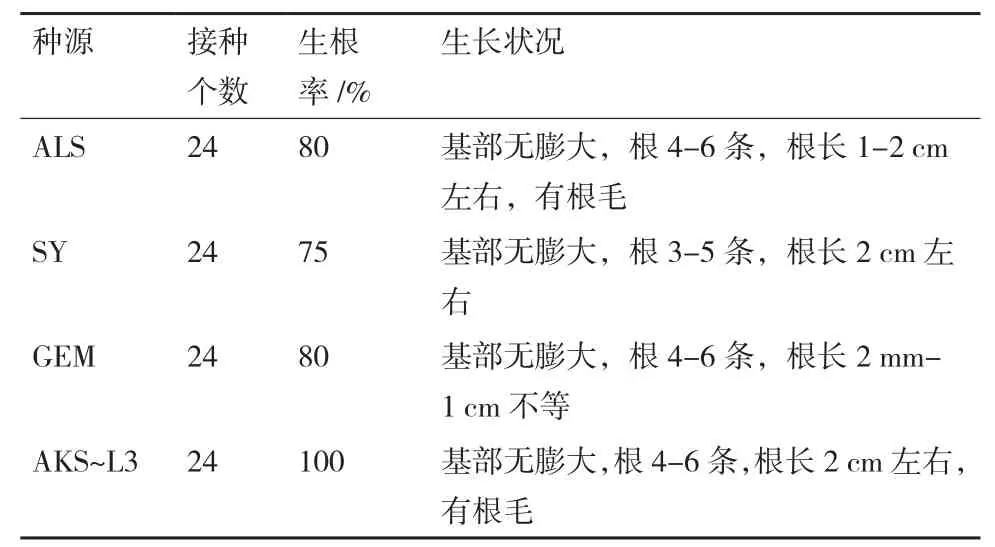
表8 IBA浓度为0.25 mg/L时各种源生根情况
3 讨论
在嫩茎段诱导不定芽分化培养基的筛选过程中,针对启动培养基MS+6-BA 0.1 mg/L +IAA 0.2 mg/L中出现的玻璃化现象,本研究采取了8种措施以减轻玻璃化。结果显示,增加IAA浓度对茎段诱导丛生芽玻璃化问题,无明显缓解甚至加重玻璃化;采用降低6-BA浓度的方法一定程度上对玻璃化的减轻有一定效果,但是,茎段诱导分化产生芽的时间明显延迟,并且,芽后期很难继续长大;改变蔗糖或琼脂的浓度虽能诱导出不定芽,但生长后期还是存在不同程度的玻璃化现象。因此,该6-BA和IAA激素浓度组合并不适合作为茎段诱导分化。
增加琼脂浓度(7 g/L)且分别单独添加0.2 mg/L 6-BA和0.3 mg/L 6-BA时,均能诱导出不定芽,但又都存在不同程度的玻璃化现象,培养基不稳定。单独加入0.1 mg/L 6-BA时,8 d左右,可以看到有芽点长出,没有愈伤,也无玻璃化问题,后期可以生长为成正常的小芽,培养基稳定,重复性好,因此,该浓度适合茎段诱导丛生芽,培养基条件为MS+蔗糖30 g/L+琼脂7 g/L+6-BA 0.1 mg/L。
在筛选叶片诱导不定芽分化的培养基过程中,较高浓度的细胞分裂素可能对丛生芽的增殖具有明显的促进作用[19]。本研究中先以新疆的2个材料SY、AKS作为代表,以6-BA浓度为变量,研究了不同浓度的6-BA对成熟黑果枸杞叶片直接诱导分化成苗的影响,在分化30 d时,0.5 mg/L 6-BA的培养基中,3种基因型的叶片均能诱导出不定芽,其中SY的不定芽数最多,生长也最旺盛;当6-BA调为1.0 mg/L时,AKS-L2及SY均能分化出不定芽,但AKS-L3未能分化出芽,猜测6-BA浓度过高抑制了叶片的分化。因此,最适宜多基因型叶片直接诱导不定芽的培养基配方为蔗糖30 g/L+琼脂6 g/L+MS+6-BA 0.5 mg/L+NAA 1.0 mg/L,后又用其余5个种源进行了验证,发现除了种源地相距较远的内蒙古ALS,其余均能良好分化。
在茎段诱导生根培养基的筛选过程中,为方便观察枸杞生根情况,最先选用透明植物凝胶作为MS培养基中的凝固剂,对不同种源嫩茎段进行生根培养。结果显示,IBA 0.6 mg/L+NAA 0.4 mg/L组合在接种20 d时,几乎所有种源的黑果枸杞植株基部只膨大,不生根;然后,仍以植物凝胶做凝固剂,以GEM作材料,以不同浓度梯度IBA(0.2、0.25、0.4、0.5、0.75和0.8 mg/L)做诱导激素继续摸索诱导生根的条件,结果显示,设置不同浓度IBA梯度后,依然是大多数只出现基部膨大,少数种源可以生根,生根数量也稀少。
针对茎段基部只膨大不生根的问题,推断可能是培养基中使用的植物凝胶影响了培养基的凝固状态,从而影响到植株生根。因此,改用琼脂粉代替植物凝胶,因有报道显示黑果枸杞在组培时使用IBA的生根率更高[20],仍然只用IBA激素。将IBA浓度范围扩大至1 mg/L,结果显示,各种源均有不同比率的生根(表6),为6%-30%,生根率很低。根据包振华等[15]的研究,较低浓度IBA对植株生根有一定的诱导作用,且1/2MS培养基中组培苗生根率和平均生根数相对于MS培养基及1/4MS培养基均比较高,因此,又以IBA浓度为0.1 和0.25 mg/L 2个浓度作为比较,在这两种情况下,各种源均可以在茎段基部直接生根,且生根率较高,IBA含量为0.25 mg/L时生根率更高(表8),且生根更早,5 d左右即开始生根,20 d后各种源接种茎段生根率均接近100%,说明使用0.25 mg/L IBA诱导生根效果更好,因此,具有不同种源诱导生根普适性的培养基为1/2MS+蔗糖30 g/L+琼脂7.5 g/L+IBA 0.25 mg/L。
4 结论
获得适于多基因型黑果枸杞嫩茎段诱导不定芽分化、叶片诱导不定芽以及茎段诱导生根的培养基,成功建立了适用于不同种源多基因型的快速繁殖体系,使得在短时间内获得大量的不同种质来源的黑果枸杞幼苗成为可能。
