水产品中砷形态分析研究进展
2019-05-09汤施展陈中祥黄晓丽王海涛吴松高磊黄丽王鹏
汤施展,陈中祥,黄晓丽,王海涛,吴松,高磊,黄丽,王鹏
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
砷(俗称砒)是环境中最常见有毒物质。2017年世界卫生组织国际癌症研究机构(IARC)将砷和无机砷化合物列为一类致癌物。水产品中砷化合物主要为亚砷酸盐、砷酸盐、一甲基砷酸(MMA)、二甲基砷酸(DMA)、砷甜菜碱(AsB)和砷胆碱(AsC)。不同形态砷的毒性不同,无机态的亚砷酸盐和砷酸盐毒性较大,为公认的致癌物质,有机态的一甲基砷化物和二甲基砷酸毒性较小,但亦为明确的致癌物,砷甜菜碱和砷胆碱常被认为是无毒[1]。受设备及方法的限制,通常检测的多为总砷的含量。近年来对不同形态砷的生物毒性效应的研究表明,此前被认为是无毒或低毒的有机形态砷,生物毒性不容忽视,而且在生物体内不同形态的砷也可以相互转化。结合砷的总量分析和形态分析,开展砷毒性机制和风险评估的研究受到广泛关注。经过多年的发展研究,该研究领域已经涵盖砷的毒性、污染现状、富集转化规律,并建立了一系列灵敏、准确的砷形态分析方法。
1 砷的毒性研究
广泛存在于环境中的砷的毒性因形态和化合物溶解度不同差别很大。大部分有机砷的毒性较弱,单质砷在环境中的溶解度低,毒性也不大,但是,无机砷化合物的毒性较为剧烈,已引起广泛关注[2]。1980年IARC已肯定摄入无机砷可引发皮肤癌,对肝脏、生殖系统和机体酶系统都有不同程度的毒性作用。三价砷As(Ⅲ)和五价砷As(Ⅴ)的毒性高,痕量即使鼠在96h内半致死性中毒;而一甲基砷酸(MMA)和二甲基砷酸(DMA)具有中等毒性,砷甜菜碱基本无毒性[3,4]。据报道,直接接触有毒砷化物可以产生急性炎症、出血和坏死,进入机体后可使细胞内酶失活,干扰新陈代谢,最终导致细胞凋亡;DMA的细胞毒性与砷酸盐和亚砷酸盐的毒性相似,而MMA的细胞毒性很弱[5]。砷甜菜碱是目前为止发现的海洋动物体内最主要的砷形态,通常占可提取砷的 80%,浓度约为 1~300μg·kg-1。研究表明,砷甜菜碱具有较高的生物可利用性,海洋动物体内砷主要以此形态存在[6]。随着砷形态检测技术的发展,最近在淡水动物(如鱼)体内检出了低浓度的砷甜菜碱。水生生物体内也发现了砷胆碱,但浓度低于砷甜菜碱。体外试验发现,亚砷酸钠对小鼠骨髓细胞有较强的细胞毒性;AsB明显增强骨髓细胞活性;小鼠骨髓细胞培养72h后,AsB提高了骨髓中大型成熟细胞数。然而,迄今在克隆实验中并未发现AsB引起骨髓细胞增殖[5,7],也没有胚胎毒性[8],鼠口服砷甜菜碱的急性 LD50大于 10g·kg-1[9]。金亚平等[10]等研究发现,接触 25μmol·L-1的 As(Ⅲ)或 100μmol·L-1的 As(Ⅴ)对原代培养的 Wister大鼠脑组织星型胶质细胞即可产生明显的毒性损伤;相同条件下MMA和DMA对原代培养星型胶质细胞无明显的直接毒性作用。秦志峰等[11]研究了亚砷酸钠对人淋巴细胞遗传物质的影响,发现不同浓度的亚砷酸钠对人淋巴细胞微核率、染色体畸变率和姊妹染色体互换率的影响显著高于对照组。砷的甲基化代谢物(尤其是DMA)也具有细胞毒性[12]。DMA染毒后可使小鼠骨髓细胞有丝分裂指数明显上升,DNA单链断裂。体外试验证实,损伤DNA的主要物质是DMA的进一步代谢产物二甲基胂化物。它与分子氧反应形成活性氧参与DNA的损伤形成。DMA能诱导巨核细胞凋亡,不能被抗氧化酶(超氧化物歧化酶SOD)和过氧化氢酶(CAT)阻断,而谷胱甘肽(GSH)却能增强DMA的细胞毒性。
2 水产品中砷的污染现状
目前,水产品中砷化合物的污染较为常见。Dabeka等[13]采集了加拿大6个城市的食品,分析发现砷的浓度范围在0.1~4 830μg·kg-1。鱼类砷平均含量最高,为1 662μg·kg-1,肉和家禽为24.3μg·kg-1,面包和谷物为 24.5μg·kg-1,脂肪和油为19μg·kg-1。加拿大人平均每日摄入总砷量为38.1μg,1~4 岁 组 为 14.9μg,20~39 岁 男 性 为59.2μg。Han等[14]评估台湾主要海产品食用风险时发现,牡蛎Ostrea gigas的铜、锌、砷含量在各种海产品中最高。用139 g·d-1的牡蛎个体最大的消费率计算目标的危害商数有机砷为1.61。无机砷可能导致终生致癌风险,马群岛居民消费牡蛎的无机砷风险估算为5.10×10-4,长期食用牡蛎对一些高危人群可能是危险的。当牡蛎体内砷的残留水平在5.6~7.6μg·kg-1(湿重)时即达到卫生防护标准上限。黄宏瑜等[15]研究珠海市近海水域海、淡水水产品重金属污染状况时发现,淡水鱼有毒元素含量较低,甲壳类和贝类砷含量超标率高。采用高效液相色谱串联电感耦合等离子体质谱法可测出鲭Pneumatophorus japonicus和鲱Clupea pallasi中痕量的DMA;高效液相色谱串联配有氢化物发生器的原子荧光法也可检出中国对虾Penaeus orientalis的DMA含量,但在鳕Gadus macrocephalus、褐牙鲆Paralichthys olivaceus、黑线鳕 Melanogrammus aeglefinus、鲽Pleuronectidae等通过上述两种技术均未检测到[16,17]。
国内学者广泛研究了水产品中总砷和不同形态砷的含量(表1)。覃东立等[18]对东北三省9个市县 45家渔场的鲤 Cyprinus carpio、草鱼Ctenopharyngodon idellus和鲫Carassius auratus共计177个样品的分析发现,砷元素在不同鱼类肌肉中残留量变化在nd~0.534mg·kg-1(湿重)之间,平均含量为0.084mg·kg-1(湿重),低于限量标准。值得关注的是,不同种类的鱼体肌肉中As含量不同,其中含量较高的已超出国家水产品质量安全标准。远洋渔业公司提供的南极磷虾油中总砷含量较高,多以AsB形态赋存;广州市货贝Monetaria moneta、金线鱼Nemipterus virgatus和鱿Ommastrephes bartrami及汕头市养殖虾中均检出As(Ⅴ),潜在食用风险需引起重视。
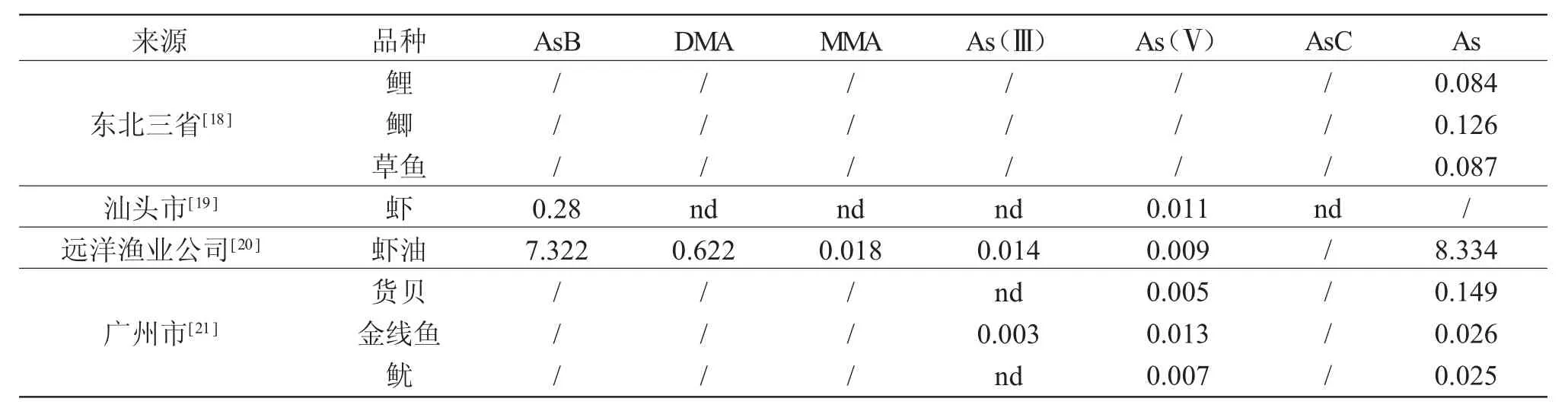
表1 不同地区和不同水产品中各种形态砷的含量Tab.1 The contents(mg·kg-1)of different arsenic forms in different fishery products collected from various regions
近几年,对砷的存在形态决定其生物毒性和化学毒性的认识不断加深,用砷的总含量来评价砷对环境和生物的污染不能如实反映砷的污染现状,应对其进行具体的形态分析和毒性效果评估。
3 砷在生物体内的富集与转化研究
目前广泛研究了不同生物,包括原核生物如细菌、真核生物如酵母、哺乳动物和高等植物对砷的富集以及相应的解毒机制。三价和五价砷化合物均可从消化道和呼吸道进入体内,被肠道和肺部吸收。机体消化系统和酶系统对其富集转化后,毒性较强的五价砷化合物先被还原成三价砷化合物,然后经过甲基化逐渐聚集在肾脏和肠道缓慢排出。形成的甲基化砷化合物一般毒性和活性较低,无机砷化合物更容易由尿排出,还有一部分则以胆汁和汗液的形式排出体外。在此过程中,五价砷化合物还原是机体砷代谢的第一步,一般三价砷毒性高于五价砷,因此,这一步常被看作是机体砷化物的致毒过程[22]。砷的毒性及其致癌风险也与此关系密切。机体内砷化合物的代谢过程中产生的氧自由基能够激发层叠的毒性效应[23],砷的富集转化规律、解毒机理和砷化物毒性钝化技术的研究值得广泛关注。砷进入植物体内后,也有相应的解毒机制。五价砷通过与磷酸盐相似的离子通道从细胞中排出,而三价砷则可直接排出,排出速率与细胞膜上质子梯度相关[24]。研究证实,淡水绿藻可以迅速将体内五价砷转化成二甲基砷化物和砷糖类等物质[25],这对水体中砷化物的降解有重要意义。急性毒性试验发现,三价砷对大型水蚤Daphniamagna的24h EC50为2.7mg·L-1[26]。静脉注射砷酸盐和亚砷酸盐后,用液相色谱串联原子荧光法检测给药鼠、豚鼠和兔胆汁和尿液中砷及其代谢产物含量,未发现豚鼠进行无机砷甲基化;以砷酸盐染毒时,砷化物大部分经肾脏以尿液的形式排出体外;染毒试验发现,亚砷酸盐的代谢途径主要为胆汁,在2 h代谢中以MMA形式排泄出所给剂量8%左右的污染物[27]。
大多数鱼类包括一些淡水鱼类,对砷化物具有一定的生物富集性。如在被砷污染的Txeoma湖底泥中,砷含量达到209 ng·kg-1(干重),生活在湖中的鱼体内平均砷含量达到34.0 ng·kg-1(湿重)[28];Davis[29]等研究了底质中的砷在鱼体内的生物富集规律,发现鱼体内的砷含量与底质中砷含量密切相关。澳大利亚胭脂鱼Myxocyprinus asiaticus各组织内砷含量显著不同,主要富集在肝脏,含量达到19.2 ng·kg-1(干重)[30]。Mormede等[31]研究了深海鱼体内砷的富集规律,发现其累积和分布规律与鱼的种类关系密切,且差异较显著;对体内砷化合物毒性的研究发现,亚砷酸钠和砷酸钠对青鳉Oryzias latipes的LC50分别为14.6mg·L-1和30.3mg·L-1。机体内砷化物的富集程度与亚砷酸钠浓度呈正相关,只有少量的砷甲基化,更多的砷化物被机体代谢出体外[32]。孙永学等[33]利用洛克沙胂胁迫鲫,进行富集试验,发现洛克沙胂在鲫各组织内的残留多在第3d达到平稳水平,内脏中砷的残留量最高达30.25mg·kg-1,15d后肌肉中砷的含量已低于0.5mg·kg-1;转入清水后,砷含量迅速下降,24h后即消除完全。
4 不同形态砷的分析方法
目前,砷化物的形态分析中大部分采用高效液相色谱与原子荧光光谱、原子吸收光谱和电感耦合等离子体质谱联用技术[34-36]。在单元素定量分析中,原子吸收光谱法选择性好、灵敏度高、稳定性强,已应用于不同类型研究领域,发展较为成熟;原子吸收光谱往往需要借助色谱分离技术才能更好地分析元素砷。液相色谱串联原子吸收光谱法直接测定砷化物形态噪声干扰大,检出限高,但是,利用氢化物发生装置将不同形态砷化物经硼氢化钾还原为共价气态氢化物可优化其灵敏度[37]。研究表明[38-41],高效液相色谱-氢化物生成-原子吸收联用系统测定环境、地下水和食品中不同形态砷化物可以满足痕量分析需求。但是,随着分析仪器的不断发展和分析技术的更新,人们开始更多关注灵敏度更高、抗干扰能力更强、运行维护费用更低廉的仪器。
高效液相色谱串联电感耦合等离子体质谱在砷形态分析中有明显优势,但仪器配备率较低和维护费用成本高,使其难以普及应用。氢化物发生原子荧光光谱测定砷的检出限低、稳定性好、耗时短、成本低廉,优于其他分析仪器。用不同前处理方式后可以用液相色谱串联原子荧光法测定超痕量的砷形态。Van Elteren等[42]采用HPLC-HG-AFS联用系统,基于选择性共沉淀技术HPLC-HG-AFS,使矿泉水中 As(Ⅲ)和 As(Ⅴ)的检出限达 0.05μg·L-1。Bohari等[43]利用气-液分离装置显著提高了液相色谱串联原子荧光法在天然淡水样品中的砷形态分析检出限,水样中通常遇到的四种砷化物As(Ⅲ)、As(Ⅴ)、MMA和DMA检出限达到0.05~0.07μg·L-1。
水产品中砷形态分析方法的研究主要集中在样品砷形态提取效率和仪器条件优化等。Guo等[44]利用液相色谱串联原子荧光法,在超声时间(60min)、超声温度(60℃)、盐酸浓度(5mol/L)下提取新疆额尔齐斯河水域鱼体中无机砷,As(Ⅲ)和As(Ⅴ)的检出限均为0.02mg·kg-1。其中,白斑狗鱼Esox lucius As(Ⅲ)含量为 0.071mg·kg-1,鲤 As(Ⅲ)含量为 0.082mg·kg-1,河鲈 Perca fluviatilis As(Ⅴ)含量为 0.051mg·kg-1。Yang等[45]采用液相色谱串联原子荧光法分析市售海产品中四种形态砷化物含量。结果表明,As(Ⅲ)的检出限为0.02mg·kg-1,MMA、DMA和 As(Ⅴ)的检出限均为 0.03mg·kg-1。所检测的海产品中总砷含量很高,但多以毒性较弱的有机砷为主,无机砷含量很低。Shang等[46]利用高效液相色谱-氢化物发生-原子荧光光谱法测定海藻食品中三价砷化合物的含量,优化了萃取剂的浓度、提取时间和仪器条件,发现在0.10mg·kg-1和1.0mg·kg-1添加水平下As(Ⅲ)的平均回收率在92%以上,相对标准偏差小于4%,具有较高的精度。
HPLC-HG-AFS联用系统可以满足多形态砷化合物的分析,还可灵敏地分析一些重要的砷代谢中间体。利用离子对色谱50℃下恒温分离,可以成功分析砷代谢中间产物一甲基亚砷酸MMA和二甲基亚砷酸DMA。Cullen等[47]采用氢化物发生-原子荧光光谱法对砷化合物进行色谱分离研究,发现人体尿液中存在MMA。一般认为,MMA是砷的生物甲基化代谢的关键中间体,其中涉及由五价甲基氧化加成逐步还原成三价砷。As(Ⅲ)、MMA、DMA和As(Ⅴ)在5min之前完全出峰,可作为快速定量检测痕量砷形态化合物的有效手段,也可为研究砷在机体内相互转化机制提供技术支持。
高效液相色谱-氢化物发生-原子荧光光谱法是基于氢化物发生提高砷形态分析灵敏度的方法,对于基质复杂、不易产生气态氢化物的砷形态化合物,可采用在线消解装置进行在线消解,将其降解为简单砷形态化合物,产生气态氢化合物,拓展原子荧光分析测定范围,灵敏地分析砷胆碱、砷甜菜碱、四甲基砷离子和砷糖等复杂砷化合物[48-51]。
5 展望
砷的形态研究在未知砷形态化合物的鉴定、筛查、砷的富集转化规律和与机体酶系统相互作用的毒理学机制研究、脱砷技术的研究等方面都将成为今后的发展方向。以不同形态的砷含量评价水产品中砷的环境健康效应比用砷总量评价更科学。研究鱼体内砷的富集规律与形态转化机制,可为水产品中砷限量标准的修订和水产品质量安全提供基础数据,为推测砷的生物地球化学循环与人体健康关系、砷在生物体内的吸收及代谢机制以及减少砷在水生生物中的积累,控制其在食物链中的传递提供数据支撑和理论参考。
