小剂量阿帕替尼联合TACE治疗晚期肝癌临床观察
2019-05-05杨秀丽亚国伟胡孟达
沈 玲 杨秀丽 亚国伟 胡孟达
南阳医学高等专科学校第一附属医院肿瘤内科三病区(南阳 473007 )
晚期肝癌已经失去根治手术或肝移植的机会,TACE是主要治疗手段之一,可有效延长患者的生存期[1]。影响TACE治疗肝癌疗效的因素很多,其中肿瘤血管再生是一个重要因素;如何抑制TACE后新生血管的生成,成为肝癌治疗的新靶点[2-3]。阿帕替尼是一种小分子抗血管生成制剂,主要通过抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)发挥抗血管生成作用,由我国江苏恒瑞医药公司自主研发,并于2014年12月13日获得国家食品药品监管局批准上市,应用于胃腺癌的三线治疗。研究表明,阿帕替尼对进展期肝癌也有一定的治疗效果[4-5]。本研究旨在观察小剂量阿帕替尼联合TACE治疗晚期肝癌的疗效。
1 资料与方法
1.1 一般资料
选择2016年1月1日—2017年12月31日,在我院治疗的晚期肝癌患者38例,均为Ⅲa期。肝癌的诊断及分期参照2001年中国抗癌协会肝癌专业委员会修订的《原发性肝癌的临床诊断与分期标准》。其中男33例,女5例;中位年龄54岁(40~59岁);肝功能均为child-pugh A级或B级,C级为TACE禁忌;8例有门静脉癌栓;4例存在远处转移。
1.2 治疗方法
所有患者及家属均自愿参加本项研究,签署知情同意书,并经我院伦理委员会通过。将38例晚期肝癌患者随机分成对照组和观察组,每组19例。对照组给予TACE治疗,观察组在TACE治疗的基础上联合口服阿帕替尼(250 mg/d)。TACE治疗方法:采用Seldinger’s技术插管至肝动脉,注入碘海醇造影,明确肿瘤血供、性质、数目、大小等;微导管超选择至肿瘤供血动脉,适量碘化油和化疗药(5-氟尿嘧啶、顺铂、表柔比星)制成乳剂,由肿瘤供血动脉注入瘤灶,然后用明胶海绵栓塞该动脉;术后予保肝、止吐、补液、维持水电酸碱平衡等内科综合治疗。
1.3 疗效评价
所有患者均于TACE治疗后 1个月行上腹部增强CT,根据 mRECIST 标准对肿瘤的控制情况进行疗效评价:①完全缓解(complete response,CR),所有靶病灶均无动脉期增强;②部分缓解(partial response,PR),靶病灶增强扫描动脉期的直径总和缩小不低于30%;③疾病进展(progressive disease,PD),动脉增强期,靶病灶直径比原始水平至少增大20%,或有新生病灶;④疾病稳定(stable disease,SD), 靶病灶的缩小直径既未达到 PR标准,增大程度亦未达到PD 标准。客观缓解率 (objective response rate,ORR)=(CR+PR) /总病例数×100%。生存期定义为患者自第1次诊断开始至末次随访或死亡的时间。
1.4 随访
TACE治疗频率依随访结果而定。通过调查病历或电话回访获得两组患者的存活状态。生存时间计算:首次治疗日至死亡日(或最后随访截止日)。随访时间为2016年1月1日—2018年5月31日(截尾日期),在该时间段内未出现结果事件的均视为截尾值;本研究所有病例的随访率为 92.11%。对照组有3例并发上消化道大出血、2例并发肝性脑病退出研究,2例失访。观察组有3例并发严重手足综合征(3~4级)、2例并发消化道出血而退出研究,1例失访。对照组平均随访时间4.3月,观察组平均随访时间5.8月。
1.5 统计学分析
应用EXCEL 2003建立数据库,SPSS软件16.0版统计学处理。两组计量资料的比较,采用t检验,计数资料比较采用卡方检验,中位生存期采用 Kaplan-Meier 法进行统计分析,两组间生存曲线的比较采用 log-rank检验,P<0.05时差异有统计学意义。
2 结 果
2.1 治疗前两组患者基线资料比较
组间年龄分布、性别构成比无差异(P>0.05)。两组患者的child分级无差异(P>0.05)。见表1。
2.2 两组患者近期客观缓解率(ORR)比较
随访4个月,治疗组1月、2月、3月、4月的ORR高于对照组 。
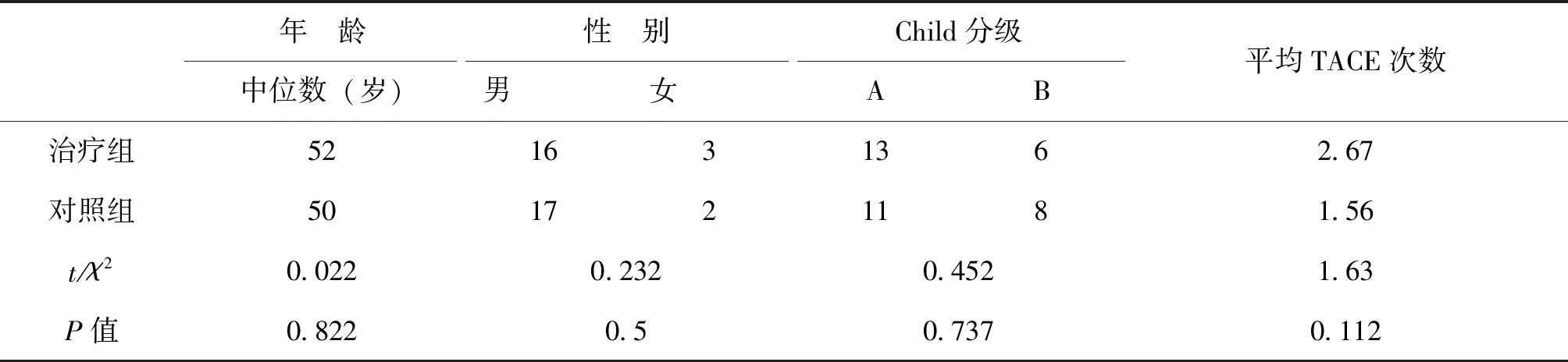
表1两组患者治疗前临床资料比较 n=19

表2两组患者4月的ORR比较
2.3 两组患者中位生存期的计算及生存曲线比较
所有患者中位生存期为4.9月;其中观察组中位生存期为5.8个月,95%可信区间(3.3个月,5.3个月),对照组中位生存期为4.3个月,95%可信区间(4.6个月,7.0个月)。Log-Rank法比较两组生存曲线,Chi-Square=4.691,P=0.043,见图1。

图1 两组生存曲线比较
2.4 不良反应
两组患者在TACE后出现不同程度的栓塞后综合征,见表3,两组间差异无统计学意义(P>0.05)。化疗药物所致骨髓抑制的发生率无差异(P=0.346)。治疗组发生阿帕替尼相关并发症:其中高血压16例(84.21%)。手足综合征11例(57.59%),其中3例出现3级或4级不良反应;1例严重手足综合征患者停止阿帕替尼治疗2周,给予对症治疗后手足皮肤反应消退,恢复治疗;2例严重手足综合征患者因4级不良反应终止阿帕替尼治疗。蛋白尿9例(47.37%);腹泻4例(21.05%);口腔溃疡2例(10.53%)。治疗组与口服阿帕替尼有关的并发症如高血压、手足综合征、蛋白尿发生率高于对照组,差异有统计学意义(P<0.05)。
表3 两组患者不良反应比较[n=19,例(%)]

不良反应治疗组对照组χ2P值发热15 (78.95)13 (68.42)0.5430.357腹痛12 (63.16)9 (47.37)0.9580.257恶心呕吐10 (52.63)8 (42.11)1.0030.253化疗后骨髓抑制5 (26.32)3 (15.79)0.1580.346高血压1 (5.26)16 (84.21)23.95<0.001手足综合症0 (0)11 (57.89)19.86<0.001蛋白尿0 (0)9 (47.37)15.320.001腹泻1 (5.26)4 (21.05)2.2010.17口腔溃疡0 (0)2 (10.53)2.8840.243
3 讨 论
肝动脉化疗栓塞(TACE)自1978年由日本山田(Yamada)教授提出以来,已被广泛应用于临床,是治疗中晚期肝癌的有效方法之一。TACE主要通过栓塞肿瘤的供血动脉,阻断肿瘤的血液供应,导致肿瘤缺血、缺氧,促使肿瘤细胞坏死、凋亡。研究表明,肿瘤组织缺血坏死所产生的微环境可导致肿瘤细胞缺氧反应基因转录和表达,诱导VEGF表达上调[6],刺激肿瘤血管生成,导致肿瘤复发、转移[2,7-8]。众所周知,VEGF是最有效的血管生成生长因子之一,由VEGF及VEGFR介导的信号传导通路在调控肿瘤血管生成过程中发挥重要作用;其中VEGFR-2被认为与肿瘤血管生成关系最为密切[9]。肝癌患者TACE后血清VEGF水平发生动态变化[8],TACE术后1周血清VEGF水平显著升高,术后1月完全缓解组的血清VEGF水平明显低于部分缓解组和进展组[10]。
从理论上讲,应用VEGFR抑制剂可以弥补TACE治疗肝癌的缺陷;二者联合可能起协同作用,增加抗肿瘤的疗效。阿帕替尼是一种新型小分子抗血管生成制剂,是VEGFR-2的抑制剂,可高度选择性地结合VEGFR-2,竞争性抑制VEGF与VEGFR-2结合,抑制肿瘤血管生成,从而抑制肿瘤细胞增殖,达到抗肿瘤作用[11]。因阿帕替尼有手足综合征、高血压、蛋白尿等副作用,导致部分数患者难以耐受,且晚期肝癌患者多伴有肝硬化,肝脏储备功能差,对正常剂量阿帕替尼的耐受性差;因此我们尝试应用小剂量阿帕替尼治疗晚期肝癌患者。本研究采用小剂量阿帕替尼(250 mg/d)联合TACE治疗晚期肝癌,相比于单纯TACE治疗,二者联合治疗可以显著延长生存时间,且依从性好,这与Lu W[12]等研究一致。本研究存在一定局限性,两组患者TACE治疗次数不同,且未检测治疗前后血清中VEGF的变化;观察病例数量尚少,仍需要大样本研究进一步证实疗效及安全性。
