黄芪和当归的主要活性成分配伍对骨髓抑制小鼠造血功能的影响
2019-05-05黄小平邓常清
徐 昊,黄小平,张 伟,邓常清
(湖南中医药大学分子病理实验室,中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208)
黄芪当归5 ∶1配伍的当归补血汤(Danggui Buxue Tang, DBT)主要用于造血功能低下的治疗。药理研究表明,DBT具有明显促造血作用,可促进小鼠骨髓造血抑制模型外周血象恢复和造血祖细胞增殖,上调造血生长因子(hemopoietic growth factor, HGF)促红细胞生成素(erythropoietin, EPO)、促血小板生成素(thrombopoietin, TPO)和粒-单核细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)的表达[1-2]。
虽然传统的DBT为芪归5 ∶1配伍,但在临床使用时仍有不同。有研究表明,在贫血模型中,当归-黄芪以1 ∶5~5 ∶1配伍对促进造血具有协同作用[3]。我们的研究也表明,在小鼠骨髓造血抑制模型,黄芪当归1 ∶1、1 ∶2.5、1 ∶5配伍的促造血作用较强,二者配伍具有增效作用[4]。且芪归1 ∶1配伍,其主要活性成分阿魏酸、黄芪甲苷、芒柄花素、毛蕊异黄酮、毛蕊异黄酮苷在药物提取中的溶出量增多,以及小肠中的吸收增加[5],提示它们可能为其主要药效物质。但是这5种成分对造血各环节有何影响?5种成分配伍是否具有芪归配伍相同的作用?这些问题尚不清楚。因此,本实验采用骨髓造血抑制模型,研究了5种主要活性成分配伍的促造血作用,为揭示其促造血作用的特点提供实验依据。
1 材料与方法
1.1 药物黄芪和当归饮片,均购自湖南省松龄堂中药饮片有限公司,经鉴定,黄芪为豆科(Leguminosae)植物蒙古黄芪AstragalusmembranaceusBunge var.mongholicus(Bge.) P.K. Hsiao的干燥根,产地内蒙古。当归为伞形科(Umbelliferae)植物Angelicasinensis(Oliv.) Diels的干燥根,产地甘肃。
当归主要活性成分:阿魏酸(ferulic acid)(纯度>99%,批号:rq0838);黄芪主要活性成分:黄芪甲苷(astragaloside Ⅳ)(纯度>98.5%,批号:16022804)、芒柄花素(formononetin)(纯度>98.5%,批号:16031 005)、毛蕊异黄酮(calycosin)(纯度>98.5%,批号:16031110)、毛蕊异黄酮苷(calycosin glycoside)(纯度>98.5%,批号:16031205)。以上均购自上海雅吉生物科技有限公司。
1.2 试剂重组小鼠促血小板生成素(rm-TPO)(Absin,批号:P40226);重组小鼠粒-单核细胞集落刺激因子(rm-GM-CSF)(SinoBio,批号:P01587);重组小鼠促红细胞生成素(rm-EPO)(Cell Signaling,批号:0004);小鼠白介素3(interleukin-3, IL-3)(Cell Signaling,批号:0012); IMEM完全培养基(Gibco,批号:1846253);L-谷氨酰胺(VETEC,批号:WXBC1767V); 特级马血清(Solarbio,批号:331E051);环磷酰胺(江苏恒瑞医药股份有限公司,批号:16071925);小鼠GM-CSF(Ex Cell Bio,批号:21F343)、TPO(Cloud-Clone Corp,批号:L161130210)、EPO(Cloud-Clone Corp,批号:L161124009)酶联免疫吸附实验(ELISA)测定试剂盒。
1.3 实验动物SPF级昆明种小鼠,♀♂各半,6周龄,体质量20~25 g,由湖南斯莱克景达实验动物公司提供,合格证号:SCXK(湘)2016-0002。饲养于湖南中医药大学实验动物中心,使用环境合格证号:SYXK(湘)2013-0005。
1.4 黄芪-当归1 ∶1配伍水提取物(以下简称提取物)的制备称取黄芪和当归饮片各40 g,用水热回流法提取,第1次加8倍量水,提取2 h。第2次及第3次各加6倍量水,提取1 h。合并3次提取物并过滤,浓缩至生药含量0.24 g·L-1,再加入1 g·L-1苯甲酸钠后,4 ℃保存。
1.5 提取物中主要活性成分测定
1.5.1提取物供试品及对照品溶液制备 取10 mL提取物,置60 ℃干燥,再加入70%甲醇溶液5 mL,震荡后静置过夜,次日再次震荡后,4 000 r·min-1离心15 min,上清液以0.22 μm微孔滤膜过滤,即得2倍浓缩的供试样品液。
精确称取阿魏酸1.82 mg、芒柄花素1.83 mg、黄芪甲苷2.16 mg、毛蕊异黄酮1.83 mg、毛蕊异黄酮苷2.51 mg,分别置于10 mL容量瓶中,加入10 mL甲醇。超声混匀后,即成对照品溶液。
1.5.2提取物5种主要活性成分含量的测定 以超高压液相色谱/质谱联用(UPLC-MS/MS)法测定。Waters-Xevo-G2-S Qtof超高效液相色谱-质谱联用仪(美国Waters公司,masslynx V4.1色谱工作站)。色谱条件:ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相0.1%甲酸水溶液(A)-乙腈(B);梯度洗脱(0~1 min,95%→90% A;1~4 min,90%→80% A;4~7 min,80%→65% A;7~10 min,65%→50% A;10~11 min,50%→5% A;11~12 min,5%→5% A;12~13 min,5%→95% A;13~15 min,95%→95% A)。柱温35 ℃,流速0.4 mL·min-1,进样体积1 μL。以上述条件测得样品和对照品的UPLC图谱,通过样品中各成分的峰面积与对照品峰面积,计算样品中5种活性成分的含量。
1.6 5种活性成分及其配伍剂量的确定及药物制备根据芪归1 ∶1配伍提取物中5种活性成分的含量,计算各成分的给药剂量。要求5种成分单独及其配伍给药时,各成分的给药剂量与提取物中各成分的剂量相等。芪归1 ∶1配伍的给药剂量为6 g·kg-1,根据水提物中5种成分的含量(见结果),换算得各成分的小鼠给药剂量为:阿魏酸574.74 μg·kg-1,黄芪甲苷275.52 μg·kg-1,芒柄花素607.26 μg·kg-1,毛蕊异黄酮391.26 μg·kg-1,毛蕊异黄酮苷1 394.28 μg·kg-1。活性成分配伍的给药剂量为上述各成分单用剂量相加。精确称取各药物成分,以4 g·L-1羧甲基纤维素钠溶液配制。
1.7 实验分组与处理小鼠随机分为空白对照组(blank)、模型组(model)、阿魏酸组、黄芪甲苷组、芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组、活性成分配伍组(active components combination)、芪归配伍提取物组(Angelica+Astragalus),每组12只。动物先适应性饲养2 d。空白组每日给予25 mL·kg-1羧甲基纤维素钠溶液灌胃7 d;模型组同上灌胃等量羧甲基纤维素钠,于d 3腹腔注射环磷酰胺(360 mg·kg-1),连续3 d;各药物组均连续给药7 d,并于d 3 同上注射环磷酰胺。各组于末次给药后24 h检测。
1.8 外周血象测定心脏采血抗凝后,以全自动血液分析仪检测外周血红细胞(red blood cell, RBC)、白细胞(white blood cell, WBC)、血小板(platelet, Pt)数及血红蛋白(haemoglobin, HGB)含量。
1.9 血清HGF含量测定心脏采血后制备血清,ELISA法测定血清GM-CSF、TPO和EPO含量。
1.10 造血祖细胞培养和集落测定处死后取右侧后肢,浸泡于75%酒精中,以无菌PBS冲洗干净。分离股骨,露出骨髓腔,用3 mL IMEM培养液将骨髓腔内细胞冲出,反复吹打,4 ℃、3 000 r·min-1离心8 min,去上清,加入2 mL IMEM培养液,反复吹打,过200目细胞筛,调细胞数至2×108·L-1。将制备好的骨髓有核细胞与培养体系混合后,加入6孔细胞培养板内,置37 ℃、5% CO2培养箱培养。培养体系组成见Tab 1。红系集落形成单位(erythroid colony forming unit, CFU-E)培养3 d后计数,爆式红系集落形成单位(burst forming unit-erythroid, BFU-E)、粒-单核细胞集落形成单位(granulocyte-monocyte colony foming unit, CFU-GM)、巨核细胞集落形成单位(megakaryocyte colony forming unit, CFU-MK)培养7 d后计数。CFU-E、BFU-E经二甲氧基联苯胺染色法鉴定,呈红色者为阳性集落。CFU-MK经乙酰胆碱酯酶染色鉴定,呈棕色者为阳性集落。CFU-GM经氯乙酸AS-D萘酚酯酶染色法鉴定,呈鲜红色者为阳性集落。镜下观察,CFU-E >8个细胞、BFU-E和CFU-GM >50个细胞、CFU-MK>3个细胞者,均计为1个集落。计数每孔造血祖细胞的集落形成数。

Tab 1 Constitution of CFU-GM, CFU-MK, CFU-E and BFU-E culture systems
1.11骨髓造血组织面积测定分离左侧股骨,10%中性甲醛固定3 d,流水冲洗后放入EDTA脱钙液中,4 ℃搅拌脱钙40 d后,流水冲洗。乙醇梯度脱水,二甲苯透明,石蜡包埋,在股骨头下2 mm处,垂直于股骨干进行连续切片,厚度5 μm。将切片贴于经多聚赖氨酸处理的玻片上,脱蜡处理后,行苏木精-伊红(HE)染色,梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下每张切片随机取3个不同视野拍照,用Image-Pro Plus图像分析软件测定骨髓造血组织面积和骨髓腔总面积,计算骨髓造血组织面积占骨髓腔总面积的百分比作为骨髓造血组织面积。

2 结果
2.1 黄芪当归1 ∶1配伍提取物5种活性成分测定结果见Fig 1、Tab 2。测得提取物中5种活性成分含量及换算成1 g生药中各成分的含量见Tab 2。

Fig 1 UPLC chromatogram of five active components
2.2 各组外周血象的比较Tab 3结果显示,与空白组比较,模型组WBC明显降低(P<0.05);与模型组比较,阿魏酸组、活性成分配伍组、提取物组WBC明显增加(P<0.05);与活性成分配伍组比较,芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组WBC明显降低(P<0.05)。与空白组比较,模型组Pt明显降低(P<0.05);与模型组比较,阿魏酸组、黄芪甲苷组、活性成分配伍组、提取物组Pt明显增加(P<0.05,P<0.01);与活性成分配伍组比较,芒柄花素组、毛蕊异黄酮苷组Pt明显降低(P<0.05,P<0.01)。与空白组比较,模型组RBC和HGB均明显降低(P<0.05);与模型组比较,各成分单用组、活性成分配伍组、提取物组RBC和HGB均明显增加(P<0.05,P<0.01)。
2.3 各组造血生长因子的比较Tab 4结果显示,与空白组比较,模型组GM-CSF明显降低(P<0.05);与模型组比较,阿魏酸组、毛蕊异黄酮组、活性成分配伍组、提取物组GM-CSF明显增加(P<0.05,P<0.01);与活性成分配伍组比较,阿魏酸组、黄芪甲苷组、芒柄花素组、毛蕊异黄酮苷组GM-CSF明显降低(P<0.05,P<0.01)。与空白组比较,模型组TPO明显降低(P<0.05);与模型组比较,各成分单用组、活性成分配伍组、提取物组TPO明显增加(P<0.05,P<0.01);与活性成分配伍组比较,黄芪甲苷组、芒柄花素组TPO明显降低(P<0.01)。与空白组比较,模型组EPO明显降低(P<0.01);与模型组比较,阿魏酸组、毛蕊异黄酮组、毛蕊异黄酮苷组、活性成分配伍组、提取物组EPO明显增加(P<0.05,P<0.01);与活性成分配伍组比较,黄芪甲苷组、芒柄花素组EPO明显降低(P<0.05)。
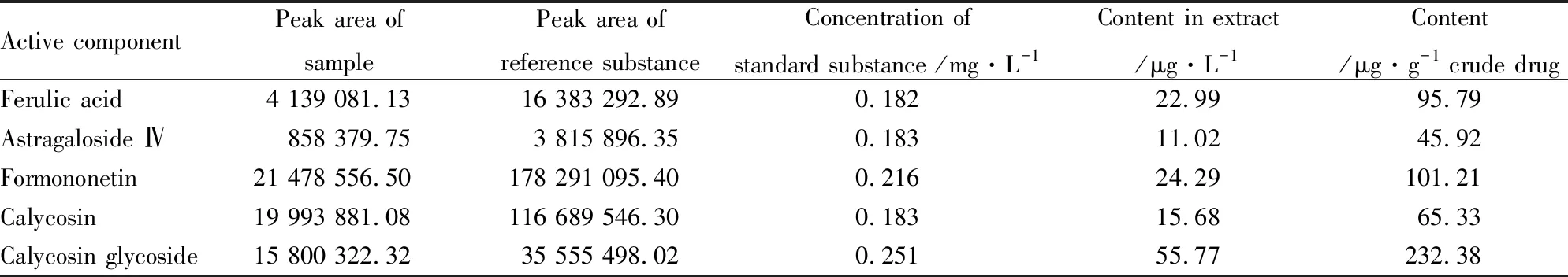
Tab 2 Contents of main active components in extract
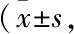
Tab 3 Comparison of peripheral blood among each group n=12)
#P<0.05vsblank;*P<0.05,**P<0.01vsmodel;△P<0.05,△△P<0.01vsactive components combination
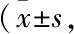
Tab 4 Comparison of serum hematopoietic growth factors among each group n=12)
#P<0.05,##P<0.01vsblank;*P<0.05,**P<0.01vsmodel;△P<0.05,△△P<0.01vsactive components combination
2.4 各组骨髓造血组织面积的比较与空白组比较,模型组骨髓造血组织面积明显减少(P<0.01);与模型组比较,阿魏酸组、活性成分配伍组,提取物组骨髓造血组织面积明显增加(P<0.05,P<0.01);与活性成分配伍组比较,各成分单用组骨髓造血组织面积明显减少(P<0.01)。见Tab 4、Fig 2。
2.5 各组造血祖细胞集落数的比较Tab 5结果显示,与空白组比较,模型组CFU-GM明显降低(P<0.01);与模型组比较,阿魏酸组、芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组、活性成分配伍组、提取物组CFU-GM均明显增加(P<0.05,P<0.01);与活性成分配伍组比较,黄芪甲苷组、芒柄花素组CFU-GM均明显降低(P<0.01)。与空白组比较,模型组CFU-MK明显降低(P<0.05);与模型组比较,阿魏酸组、芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组、活性成分配伍组、提取物组CFU-MK均明显增加(P<0.01);与活性成分配伍组比较,阿魏酸组CFU-MK明显增加,黄芪甲苷组、毛蕊异黄酮组均明显降低(P<0.01)。与空白组比较,模型组CFU-E明显降低(P<0.01);与模型组比较,各活性成分单用组、活性成分配伍组、提取物组CFU-E均明显增加(P<0.05,P<0.01);与活性成分配伍组比较,黄芪甲苷组、芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组CFU-E均明显降低(P<0.01)。与空白组比较,模型组BFU-E明显降低(P<0.01);与模型组比较,阿魏酸组、活性成分配伍组、提取物组BFU-E均明显增加(P<0.01);与活性成分配伍组比较,黄芪甲苷组、芒柄花素组、毛蕊异黄酮组、毛蕊异黄酮苷组BFU-E均明显降低(P<0.01)。

Tab 5 Comparison of colony number of hematopoietic progenitor cells among each group (per n=12)
#P<0.05,##P<0.01vsblank;*P<0.05,**P<0.01vsmodel;△△P<0.01vsactive components combination
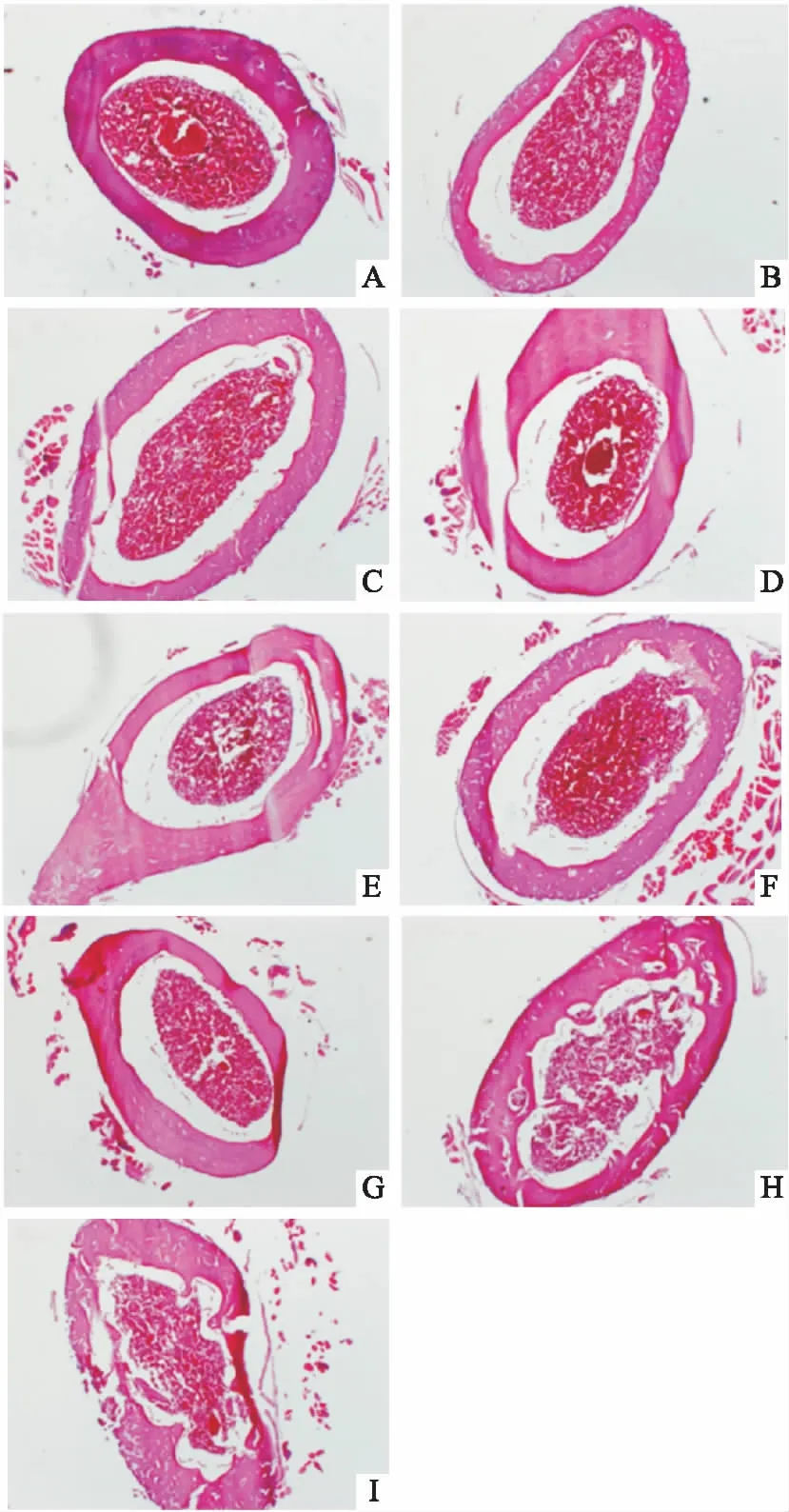
Fig 2 Morphological pattern of bone marrow hematopoietic tissues in each group (HE staining×100)
A:Blank;B:Model;C:Ferulic acid;D:Astragaloside IV;E:Formononetin;F:Calycosin;G:Calycosin glycoside;H:Active components combination;I:Angelica+Astragalus.
3 讨论
环磷酰胺可引起骨髓造血功能抑制,停药后其骨髓抑制可自行恢复[6]。因此,本实验采用连续注射环磷酰胺3 d,于注射后d 2观察造血功能的恢复情况。
芪归配伍补血作用的活性成分已见相关研究。正常和血虚大鼠口服DBT后,肝脏中主要活性成分(阿魏酸、咖啡酸、毛蕊异黄酮苷、芒柄花素和黄芪甲苷)的含量明显高于其他组织[7]。芪归1 ∶1、1 ∶2.5、1 ∶5 配伍有明显的促造血作用,且芪归1 ∶1配伍可促进黄芪甲苷、毛蕊异黄酮、毛蕊异黄酮苷、芒柄花素和阿魏酸的溶出和在大鼠离体小肠段的吸收[4]。提示这些成分可能是其促造血的主要药效物质。因此,本实验研究了5种主要成分及其配伍的补血作用。研究发现,芪归1 ∶1配伍和5种成分配伍均可升高RBC、WBC、Pt和HGB含量,增加骨髓造血组织面积,二者作用相当,表明5种成分是黄芪当归配伍促造血的主要药效物质。进一步分析表明,5种成分均可升高RBC和HGB,表明5种成分可能为升高红细胞的主要药效物质。阿魏酸可升高WBC,表明它可能是升高白细胞的主要药效物质。阿魏酸、黄芪甲苷可升高Pt,表明二者可能是升高血小板的主要药效物质。骨髓形态学研究表明,只有阿魏酸可增加骨髓造血组织面积,提示阿魏酸可能是抑制骨髓造血组织萎缩的主要药效物质。
血细胞生成是在骨髓腔中由造血干/祖细胞增殖、分化而成,这一过程需依赖HGF与其相应受体。HGF主要有EPO、TPO和集落刺激因子,可直接作用于骨髓造血前体细胞,促进其增殖、定向分化。EPO主要由肾脏分泌,可使红系祖细胞池扩大及促进祖细胞分化和成熟[8]。GM-CSF来源于T 细胞、 单核巨噬细胞、内皮细胞、成纤维细胞等,可促进粒、红、单核、巨核系造血干/祖细胞增殖分化[9]。TPO可促进巨核细胞增殖和血小板生成[10]。研究表明,DBT能促进骨髓抑制小鼠HGF(EPO、TPO和GM-CSF)的表达[2],以及体外培养的Hep3B细胞表达EPO[11],促进造血祖细胞增殖[4]。本研究进一步证明,芪归1 ∶1配伍和5种活性成分配伍均可使血清EPO、TPO、GM-CSF含量增加,二者作用相当。但只有阿魏酸、毛蕊异黄酮、毛蕊异黄酮苷可升高血清EPO含量,提示这3种成分可能是促进EPO合成与分泌的主要物质。阿魏酸、毛蕊异黄酮可升高血清GM-CSF含量,提示此两种成分可能是促进GM-CSF合成与分泌的主要药效物质。5种成分均可使血清TPO含量升高,提示5种成分可能均可促进TPO合成与分泌。体外细胞实验研究表明,DBT增加EPO表达的作用与Raf/MEK/ERK信号通路活化有关[12]。DBT可促进雌激素应答元件激活和雌激素受体α(estrogen receptor α, ERα)磷酸化,抑制巨核细胞凋亡,这些作用可被MAPK抑制剂、雌激素受体抑制剂和ERK1/2抑制剂阻断[11,13-14]。提示DBT诱导HGF表达和促进血细胞生成的作用与MAPK信号通路、雌激素受体信号通路等有关。另有研究表明,骨髓造血微环境是影响造血的重要因素,骨髓基质细胞可通过分泌多种HGF改善造血微环境。骨髓间充质干细胞(mesenchymal stem cell,MSC)是骨髓造血微环境的重要组成细胞,具有支持造血的作用,促进MSC增殖可改善造血微环境诱导造血相关因子表达[15]。因此,黄芪和当归配伍及其有效成分促进造血和HGF合成与分泌的作用,可能与上述多个细胞、多个信号途径有关,但其具体作用机制有待进一步阐明。
造血祖细胞是一类具有增殖能力的原始骨髓有核细胞,可由不同的HGF刺激而生成对应的祖细胞集落。目前已知的3类主要造血祖细胞分别是:① 粒-单核细胞系祖细胞,必须在GM-CSF作用下形成CFU-GM;② 巨核细胞系祖细胞,必须在TPO作用下形成CFU-MK;③ 红系祖细胞,必须在EPO作用下形成CFU-E和BFU-E[16]。因此, 检测造血祖细胞增殖可反映造血能力。研究表明,芪归5 ∶1和1 ∶1配伍均可促进造血祖细胞增殖[2,4]。本研究结果进一步表明,芪归1 ∶1配伍和5种成分配伍均可使CFU-GM、CFU-MK、CFU-E和BFU-E集落数增加,两者作用相当。提示芪归1 ∶1配伍及5种成分配伍均可促进造血祖细胞增殖。这可能是黄芪和当归中的药效物质通过促进多种细胞合成与分泌HGF,从而促进了造血祖细胞增殖。而阿魏酸、黄芪甲苷、芒柄花素、毛蕊异黄酮、毛蕊异黄酮苷均可促进CFU-E和BFU-E增殖,提示5种成分可能均具有促进红系祖细胞增殖的作用。阿魏酸、毛蕊异黄酮、毛蕊异黄酮苷均可促进CFU-MK增殖,提示它们可能是促进巨核系祖细胞增殖的主要药效物质。阿魏酸、芒柄花素、毛蕊异黄酮、毛蕊异黄酮苷均可促进CFU-GM增殖,表明它们可能是促进粒-巨噬细胞系祖细胞增殖的主要药效物质。
