2-(N-丙基)-6-三氟甲氧基苯并噻唑抗肿瘤活性研究
2019-05-05刘振国王海芳武祥龙蔺旭彬吕文君
张 飞,刘振国,王海芳,武祥龙,刘 柳,蔺旭彬,吕文君,刘 浩
(1. 西北工业大学生命学院空间生物实验模拟技术重点实验室,陕西 西安 710072;2. 陕西省人民医院重症医学科,陕西 西安 710068;3. 陕西中医药大学陕西省中西医结合心血管病防治重点实验室,陕西 西安 712046)
癌症的明显特征是肿瘤细胞不受控制和不规则的增殖,并且细胞周期和细胞分裂过程严重紊乱。肿瘤在机体内不停地转移和侵袭,正常组织被严重破坏,最终导致机体的死亡[1]。面对癌症发病率逐年增加,加快抗肿瘤新药的研究迫在眉睫[2]。因此,发现新的抗肿瘤药物并研究其作用机制,具有十分重要的意义。
利鲁唑,化学名为2-氨基-6-三氟甲氧基苯并噻唑(Fig 1,化合物1),目前用于治疗侧索硬化症。韩国和美国学者分别发现了利鲁唑对人肝癌细胞和乳腺癌细胞增殖有抑制作用[3-4]。本课题组主要从事利鲁唑衍生物的镇痛研究[5-7],并且已经合成了12种利鲁唑衍生物[8],经过SciFinder查新发现,其中2-(N-丙基)-6-三氟甲氧基苯并噻唑(Fig 1,化合物4)是新化合物。关于其药理活性作用有待研究,本实验通过细胞增殖、凋亡和迁移实验,研究化合物4的抗肿瘤活性。
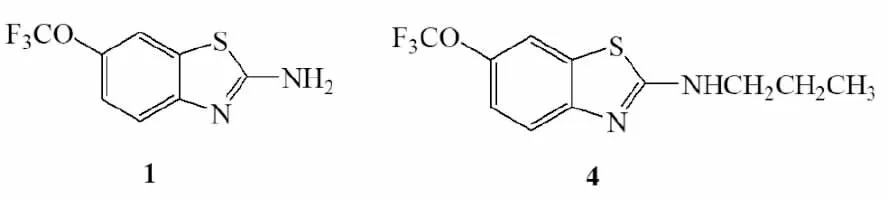
Fig 1 Structure of riluzole(1) and
1 材料与方法
1.1 材料
1.1.1细胞株 小鼠成骨MC3T3-E1细胞系、小鼠骨髓瘤SP2/0细胞系,人宫颈癌HeLa细胞系、人肝癌HepG2细胞系、人乳腺癌MCF-7细胞系,源自于本学院细胞种子库。
1.1.2药物与试剂 2-(N-丙基)-6-三氟甲氧基苯并噻唑为本课题组合成,纯度99.9%。培养基α-MEM、RPMI 1640、DMEM,购自HyClone公司;胎牛血清,购自美国Gibco公司;CCK-8试剂盒,购自南京恩晶生物科技有限公司;Hoechst 33258、Annexin V-FITC/PI凋亡检测试剂盒,购自碧云天生物技术有限公司;索拉非尼,购自济南晟齐医药科技有限公司。
1.1.3仪器 Synergy HT多功能酶标仪(美国伯腾仪器有限公司);FACSCalibur流式细胞仪(美国BD公司);Nikon 80i正置荧光显微镜(尼康仪器上海有限公司);Olympus CKX41倒置式生物显微镜(奥林巴斯中国有限公司)。
1.2 方法
1.2.1CCK-8法测定药物对肿瘤细胞增殖的影响 取对数生长期的HepG2、HeLa、MCF-7、MC3T3-E1贴壁细胞,消化,计数;对于半贴壁细胞SP2/0直接吹打离心,弃上清液,加入培养液吹打计数。以每孔2.5×103个细胞接种于96孔板,培养24 h,加入含有不同浓度2-(N-丙基)-6-三氟甲氧基苯并噻唑的培养液,使其终浓度为1.23、3.7、11.11、33.33、100 μmol·L-1,空白溶剂为对照组。孵育48 h,每孔加入10 μL的CCK-8溶液,再孵育2 h,测定450 nm时吸光度值,根据公式:增殖抑制率=(1-实验组OD值/对照组OD值)×100%,计算细胞增殖抑制率及IC50值[9]。
1.2.2毒性选择性指数的计算方法 采用毒性选择性指数(selectivity index,SI)来衡量化合物的安全性。计算公式为:某化合物的SI值=化合物对正常细胞的IC50值/化合物对肿瘤细胞的IC50值。SI值表示某个化合物可以抑制肿瘤细胞,但不损害正常细胞,当SI值大于1时,表示该化合物对肿瘤细胞的毒性大于对正常细胞的毒性;当SI值大于3时,表明该化合物的选择性比较好,SI值越大表明化合物的抗肿瘤活性越好,对正常细胞的细胞毒性越小[10]。
1.2.3Hoechst 33258染色检测细胞凋亡 将对数期MCF-7细胞以每孔5×105个接种于6孔板内的盖玻片上,培养24 h,然后加入含有不同浓度药物(终浓度为12.5、25、50 μmol·L-1)的培养液。培养24 h,弃培养液,固定10 min,用PBS洗涤3次,加入0.5 mL Hoechst 33258染色液,孵育5 min,再用PBS洗涤3次。将盖玻片转移至载玻片上,封片。激发波长350 nm,发射波长460 nm条件下,荧光拍照,观察细胞形态[11]。
1.2.4Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡 取对数期的MCF-7细胞接种于6孔板内,每孔5×105个。培养24 h,加入含有不同浓度药物(终浓度为12.5、25、50 μmol·L-1)的培养液。药物作用24 h后,弃培养液,用PBS洗涤,消化,按试剂盒说明书步骤操作,采用流式细胞仪检测。
1.2.5划痕实验检测药物对MCF-7细胞迁移能力的影响 细胞划痕实验可以检测贴壁肿瘤细胞的迁移能力,是一种常用的检测细胞运动的方法。以每孔5×105个细胞将对数期细胞接种于6孔板内,培养24 h。用1 mL枪头在孔内沿直径方向画粗细均匀的1条竖线,PBS洗掉划下的细胞和碎片,在光学显微镜下拍照记录给药前的划痕情况。加入含有药物的培养液,终浓度为25 μmol·L-1,孵育24 h,再次拍照记录划痕状态[12]。计算划痕的相对愈合率,公式为:划痕的相对愈合率=(0 h的划痕宽度-24 h的划痕宽度)/0 h的划痕宽度×100%。

2 结果
2.1 化合物4对肿瘤细胞增殖的抑制作用CCK-8法检测不同浓度的化合物4(1.23、3.7、11.11、33.33、100 μmol·L-1)对HeLa、HepG2、MCF-7、SP2/0细胞增殖的影响,取药物浓度的对数作为横坐标。由Fig 2可见,随着浓度的增加,化合物4对4种肿瘤细胞增殖抑制率均明显增加,尤其对MCF-7细胞作用最明显,在浓度较低时就表现出很好的增殖抑制作用。
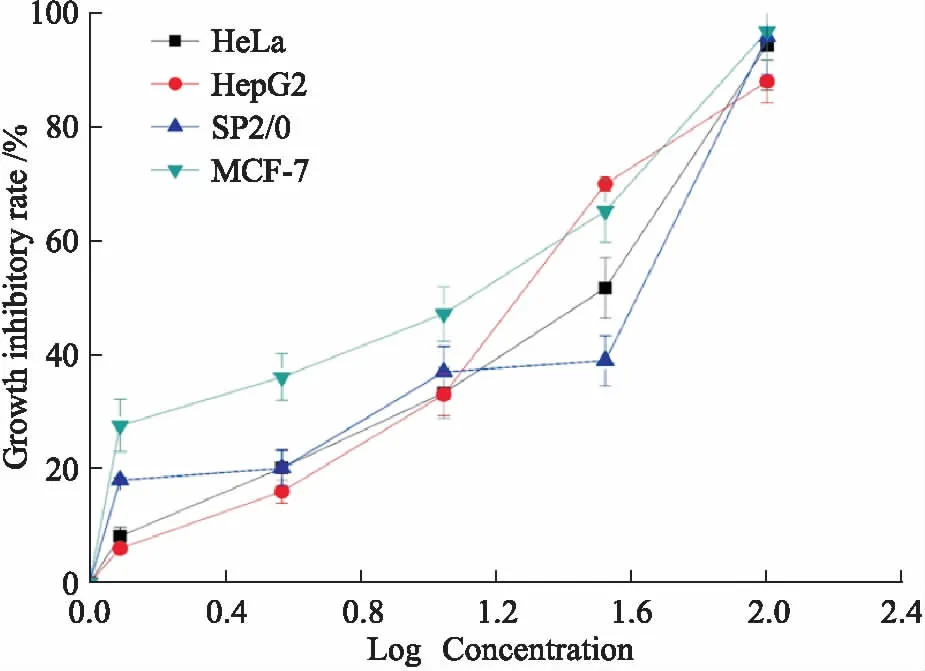
Fig 2 Proliferation inhibitory rate to HeLa,HepG2,
根据不同浓度下增殖抑制率,计算半数抑制浓度IC50值,索拉非尼作为阳性对照。由Tab 1可见,化合物4对4种细胞均有一定的抑制作用,其中对肿瘤细胞HepG2和MCF-7抑制作用接近阳性对照的作用效果。选取MC3T3-E1研究药物对正常细胞的毒性,计算其IC50值,以此为标准,计算药物对不同肿瘤的SI值。化合物4对4种肿瘤细胞的SI值均大于1,表明其对肿瘤细胞毒性大于对正常细胞的毒性。而对于HepG2和MCF-7的SI值都大于3,充分说明其对HepG2和MCF-7细胞具有较好的抗肿瘤活性,且对正常细胞毒性小。
2.2 化合物4对MCF-7细胞的促凋亡作用根据细胞毒性筛选实验,发现化合物4对MCF-7细胞的抑制效果最明显,故选用MCF-7作为研究对象,采用Hoechst 33258染色,观察化合物4对MCF-7细胞核形态的影响。由Fig 3可见,空白对照细胞呈现完整的细胞核结构,具有圆形饱满的细胞核,且颜色较暗。药物浓度增加到25 μmol·L-1时,出现细胞核致密浓染的状态,细胞核颜色呈现亮白状态,这是细胞凋亡的典型特征。当浓度为50 μmol·L-1时,可以看到细胞核近似破裂,分散在胞质中,说明细胞已经凋亡。形态学结果表明化合物4能使细胞发生凋亡,从而抑制了细胞的增殖。

Tab 1 IC50 value and selectivity

Fig 3 Hoechst 33258 staining of MCF-7 cells treated by different drug concentrations for 24 h
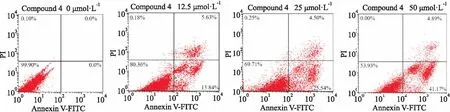
Fig 4 Apoptosis of MCF-7 cells treated by different concentrations of compound 4 detected by flow cytometry
细胞凋亡的诱导是癌症治疗过程中的重要靶标,抗肿瘤药物可以诱导和促进其凋亡[13]。采用Annexi V-FITC和PI双染法研究化合物4对MCF-7细胞凋亡的影响,由Fig 4可见,空白组MCF-7细胞的存活率高达99.9%,说明在没有药物时,MCF-7细胞不受影响,正常生长。当药物浓度为12.5 μmol·L-1时,早期凋亡细胞比例为13.84%;当浓度为25 μmol·L-1时,早期凋亡细胞的比例逐渐增加到25.54%;当给药浓度增加到50 μmol·L-1时,早期凋亡细胞的比例增加到41.17%。可见,早期凋亡率随着化合物4浓度增加而增大,并且早期凋亡率均大于坏死率,说明化合物4具有诱导MCF-7细胞早期凋亡的能力,并且具有浓度依赖关系。
2.3 抗迁移实验研究如Fig 5所示,对照组细胞划痕宽度愈合程度高,而给药组的划痕宽度变化不明显。空白组的划痕愈合率高达75%,给药组划痕愈合率只有16%,说明化合物4对MCF-7细胞具有一定的抗迁移能力。

Fig 5 Effect of compound 4 on migration
**P<0.01vscontrol
3 讨论
利鲁唑具有一定的抗肿瘤作用,本课题组设想其衍生物可能也具有抗肿瘤作用,因此,合成了2-(N-丙基)-6-三氟甲氧基苯并噻唑,并研究其抗肿瘤作用和机制。采用CCK-8法分析了该化合物对HeLa、HepG2、MCF-7、SP2/0细胞增殖的影响,发现其可以抑制这4种肿瘤细胞的增殖,作用效果没有超过阳性对照索拉非尼。该化合物对MCF-7细胞的IC50值最接近阳性对照,作用效果最明显,所以,采用MCF-7细胞深入研究了化合物抗肿瘤作用机制。
Hoechst染色是一种可以直接观察细胞凋亡的方法,当细胞发生凋亡时,染色物质会固缩。在荧光显微镜下可以观察到,凋亡细胞的细胞核呈现致密浓染状态,或者呈现碎块状的致密浓染,颜色发白,而正常细胞核则呈现均匀的蓝色。通过Hoechst 33258染色可见,化合物4浓度增加时,有明显的细胞核浓染,说明化合物4可以使肿瘤细胞凋亡。
单层细胞划痕实验是经典且操作简单的研究细胞迁移能力的体外实验,显微镜下观察不同时间点的划痕宽度,可直观看出细胞迁移情况。相对划痕愈合率可以定量说明细胞迁移能力,迁移率越大,表明细胞迁移能力越强,反之,迁移能力越弱。本实验结果提示,化合物4作用后的迁移率只有16%,而对照组的迁移率为75%,说明化合物4可以抑制细胞的迁移。
药物使细胞凋亡的作用机制是复杂多样的,本研究通过流式细胞分析法,获得凋亡过程中细胞数量占比,分析细胞凋亡的原因。结果提示,随着药物浓度增加,早期凋亡细胞比率逐渐增加,表明化合物通过诱导细胞早期凋亡而发挥作用。在单层实验中,浓度是一个关键因素,浓度太低时,无法观察到抗迁移效果,浓度太高会使绝大多数细胞凋亡而无法形成细胞层。结合IC50值,经过多次预实验,本研究选取了化合物4浓度25 μmol·L-1开展研究。
综上所述,本实验采用CCK-8法筛选了2-(N-丙基)-6-三氟甲氧基苯并噻唑对4种肿瘤细胞增殖的影响,发现其对4种肿瘤细胞具有明显的增殖抑制活性和良好的选择性,尤其是对MCF-7细胞作用效果最明显。2-(N-丙基)-6-三氟甲氧基苯并噻唑还可以改变MCF-7细胞核形态,明显抑制其迁移能力,诱导细胞的早期凋亡,本研究为开发新的抗肿瘤药物提供了实验基础。
(致谢:本研究是在西北工业大学生命学院完成,衷心感谢各位老师和同学在实验过程中的帮助与指导!)
