亚砷酸钠对SH-SY5Y细胞周期的影响及MPST过表达的干预
2019-05-05柳香香孙达权许键炜范海琼徐国强潘际刚
柳香香,孙达权,许键炜,范海琼,徐国强,潘际刚
(1.贵州医科大学基础医学院,贵州 贵阳 550025;2. 贵州医科大学干细胞与组织工程实验中心,贵州 贵阳 550004;3. 黔东南民族职业技术学院医药技术系,贵州 凯里 556000)
砷及其化合物具有毒性,在我国一些地区严重超标,经人体摄入后,易引起急、慢性砷中毒,造成肝脏、心脏、肾脏或皮肤等器官或组织损伤[1]。研究显示,神经细胞难以再生,且对毒性物质更加敏感,因而砷暴露时间过长将损伤神经系统[2-3]。因此,如何有效预防和治疗砷中毒显得尤为重要。3-巯基丙酮酸硫转移酶(3-mercaptopyruvate sulfurtransferase,MPST或3-MST)由297个氨基酸组成,定位于细胞质。MPST以单体或二硫键连接的同型二聚体存在,其功能是催化硫离子的转移,使硫离子结合硫醇化合物(如氰化物),进而参与氰化物解毒和半胱氨酸降解[4]。本课题组前期研究显示,亚砷酸钠(sodium arsenite,NaAsO2)可抑制PC-12和SH-SY5Y神经细胞生长,下调MPST蛋白表达[5-6]。因此,本研究采用SH-SY5Y细胞为研究对象,外源性过表达MPST蛋白,观察其在NaAsO2干预神经细胞生长周期中的作用。
1 材料与方法
1.1 材料
1.1.1细胞系 人神经母细胞瘤SH-SY5Y细胞,购自德国DSMZ公司。
1.1.2试剂 胎牛血清(FBS),购自杭州四季青公司;青霉素-链霉素和胰蛋白酶,购自美国Gibco公司;磷酸盐缓冲液(PBS)和结晶紫染液,购自北京索莱宝公司;DMEM培养基,购自美国HyClone公司;NaAsO2,购自美国Sigma公司;CCK-8溶液,购自日本同仁;PI单染细胞周期检测试剂盒,购自南京凯基;抑癌基因p53蛋白抗体、细胞周期调控因子CDC25A抗体、细胞周期蛋白A(cell cycle protein A,CyclinA)抗体、周期蛋白依赖性激酶2(cyclin-dependent kinases 2,CDK2)抗体、MPST抗体、抗小鼠IgG-HRP二抗,购自美国Santa Cruz公司。
1.1.3仪器 Model 310细胞恒温CO2培养箱(美国Thermo公司);细胞培养超净台(苏州净化);全波段多功能酶标仪(BioTek公司);Eclipse Ti-s倒置显微镜(日本Nikon公司);FACSCalibur流式细胞仪(美国BD公司);全自动凝胶成像仪(美国SynGene)。
1.2 方法
1.2.1细胞培养 SH-SY5Y细胞培养在高糖DMEM培养基(含10% FBS和1%青霉素-链霉素)中,培养于37 ℃、5% CO2的培养箱中,隔天换液,细胞生长至70%汇合度时进行传代或冻存。
1.2.2慢病毒转染MPST过表达 经PCR扩增、双酶切、连接目的片段与载体、挑选阳性克隆、测序验证,扩增培养阳性菌落,而后鉴定和抽提质粒。慢病毒包装MPST质粒和空载体,收集病毒并测定滴度。SH-SY5Y细胞在12孔板生长至50%汇合度时进行转染,细胞更换为含10 mg·L-1基因转染增强剂聚凝胺(polybrene)及10% FBS的DMEM培养基,分别于不同孔加入1 mL含MPST和空载体的病毒液,分别设为过表达组和空载对照组,培养箱中继续培养6 h后,更换含10% FBS的DMEM培养基继续培养,细胞生长至90%汇合度时,以嘌呤霉素进行筛选,最终以蛋白印迹实验验证MPST表达水平。
1.2.3组别设置 实验组别分别为:慢病毒转染的过表达组(overexpression group),简称OP组;空载对照组(no-load control group),简称NC组;同时以正常模型细胞设立空白组(blank control group),简称BC组。
1.2.4CCK-8法检测 取对数期模型细胞,以每孔8×103个铺于96孔板中,培养过夜,设6个NaAsO2浓度梯度(5、10、20、50、75、100 μmol·L-1),每组5个复孔,同时设置调零孔和对照孔。放入培养箱继续培养,分别于24、48 h后,每孔加10 μL CCK-8溶液,继续培养3 h,酶标仪测定OD值(450 nm),计算细胞活力。细胞活力=[(NaAsO2处理孔OD值-调零孔OD值)/(对照孔OD值-调零孔OD值)]×100%。
取对数期BC、NC和OP组细胞,分别以每孔8×103个铺于96孔板中,培养过夜,每组设5个复孔,以含50 μmol·L-1NaAsO2的DMEM培养基处理上述3组细胞,同时设置调零孔及以BC细胞设置空白对照组,48 h后按上述方法继续操作。
1.2.5结晶紫染色 选择对数期BC、NC和OP组细胞接种于6孔板,培养箱培养至汇合度达到60%~70%时,细胞同步化12 h,然后以含50 μmol·L-1NaAsO2的DMEM培养基处理上述3组细胞,继续无血清培养。24 h后结晶紫染色,细胞PBS洗3遍,每孔2 mL 4%多聚甲醛固定10 min,PBS洗掉固定液后,双蒸水洗2遍,每遍1 min,加入2 mL结晶紫染色10 min,双蒸水洗涤后拍照,每组取拍照图3~5张,人工计数后进行图片和统计学处理。设BC组细胞贴壁存活率为100%,细胞贴壁存活率=(NaAsO2处理组细胞数/BC组细胞数)×100%。
1.2.6细胞周期检测 取对数期BC、NC和OP组细胞铺于6孔板中(5×109·L-1),培养过夜,以含50 μmol·L-1NaAsO2的DMEM培养基处理上述3组细胞,同时以无NaAsO2的DMEM培养BC细胞作为空白对照,48 h后以不含EDTA的胰酶消化细胞,1 528×g离心5 min,PBS洗2次,70%乙醇于4 ℃ 冰箱固定30 min,1 528×g离心5 min,PBS洗2次,1 528×g离心5 min,弃PBS,加入300 μL PI/RNase染色工作液,室温避光60 min,加入样品管中,用流式细胞仪在488 nm激发光处检测。
1.2.7蛋白印迹检测 药物处理细胞后,以RIPA细胞裂解液(含1 mmol·L-1PMSF)裂解细胞,冰上裂解10 min,20 627×g离心15 min,取上清液进行BCA蛋白定量,计算并配制上样缓冲液,100 ℃变性5 min,进行12% SDS-PAGE电泳分离蛋白,湿转至PVDF膜,5%的脱脂牛奶封闭2 h,用p53、CDC25A、CyclinA、CDK2抗体(1 ∶1 000)或内参抗体GAPDH(1 ∶2 000)于4 ℃摇床孵育过夜,PBS洗膜3次,抗小鼠IgG-HRP二抗室温孵育1 h,PBS洗膜3次,PVDF膜以化学发光试剂盒显色,凝胶成像仪成像,以Quantity One对蛋白印迹条带处理和分析。

2 结果
2.1 NaAsO2和MPST对细胞活力的影响如Fig 1B所示,NaAsO2(5、10、20、50、75、100 μmol·L-1)分别处理模型细胞24、48 h,48 h时NaAsO2对模型细胞的IC50为50 μmol·L-1。蛋白印迹实验发现(Fig 1A),BC和NC组MPST蛋白表达无明显差异;而与NC组相比,OP组MPST蛋白表达明显升高(P<0.01)。以NaAsO2(50 μmol·L-1)处理3组细胞48 h,结果显示(Fig 1C),BC和NC组细胞存活率明显降低(P<0.01);BC和NC组间细胞存活率无明显差异;而与NC组相比,OP组细胞存活率明显升高(P<0.01)。
2.2 NaAsO2和MPST对细胞贴壁能力的影响如Fig 2所示,NaAsO2(50 μmol·L-1)处理48 h,BC和NC组细胞贴壁力明显降低(P<0.01),BC和NC组细胞贴壁存活率无明显差异;与NC组相比,OP组细胞贴壁存活率明显回升(P<0.01)。
2.3 NaAsO2和MPST对细胞周期的影响如Fig 3、Tab 1所示,NC加药组和BC加药组细胞周期无明显差异,与空白组相比,给予NaAsO2(50 μmol·L-1)处理48h后,BC和NC组细胞S期比例明显增加(P<0.01);而与NC组相比,OP组细胞S期比例明显减少(P<0.05)。
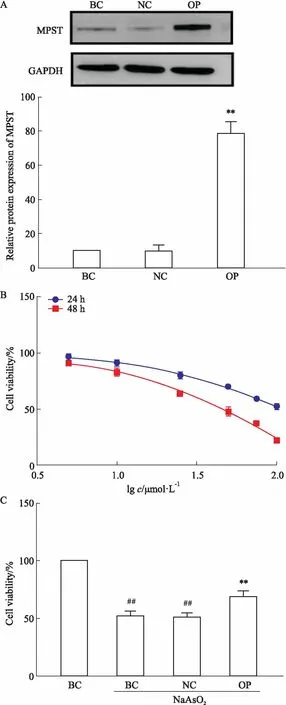
Fig 1 Effects of NaAsO2 and MPST over-expressionon cell viability of SH-SY5Y
A:MPST protein expression level;B:Effects of different concentrations of NaAsO2on the viability of model cells;C:Effect of NaAsO2on the viability of cells in each group.**P<0.01vsNC;##P<0.01vsBC alone.
2.4 NaAsO2和MPST对蛋白表达的影响如Fig 4所示,NaAsO2(50 μmol·L-1)处理48 h, BC和NC组细胞p53蛋白明显上调,CDC25A、CyclinA及CDK2蛋白明显下调(P<0.01);BC和NC组细胞各蛋白表达无明显差异;与NC组相比,OP组细胞上述改变明显被拮抗(P<0.05,P<0.01)。

Fig 2 Effect of MPST over-expression on cell adherenceviability of NaAsO2 inhibition
A:Effect of NaAsO2on the viability of adherent cells in each group;B:Adherence survival rate.**P<0.01vsNC;##P<0.01vsBC alone.

Tab 1 Effects of NaAsO2 and MPST over-expression on cell cycle in all group
##P<0.01vsBC;*P<0.05vsNC+NaAsO2
3 讨论
环境中的砷一般以无机砷化物的形式存在,如NaAsO2、三氧化二砷、砷酸盐等,长期暴露于无机砷化物环境中可引起神经系统损伤、心血管疾病、泌尿系统等疾病[7]。砷进入血液后可通过血脑屏障进入大脑,进而损伤神经系统。研究表明[8],NaAsO2可诱导神经细胞凋亡,抑制细胞骨架形成,破坏细胞正常结构。
前期工作表明[5],NaAsO2可抑制SH-SY5Y细胞生长。而本研究发现,MPST过表达能明显抑制NaAsO2导致的细胞活力和贴壁能力下降的效应。
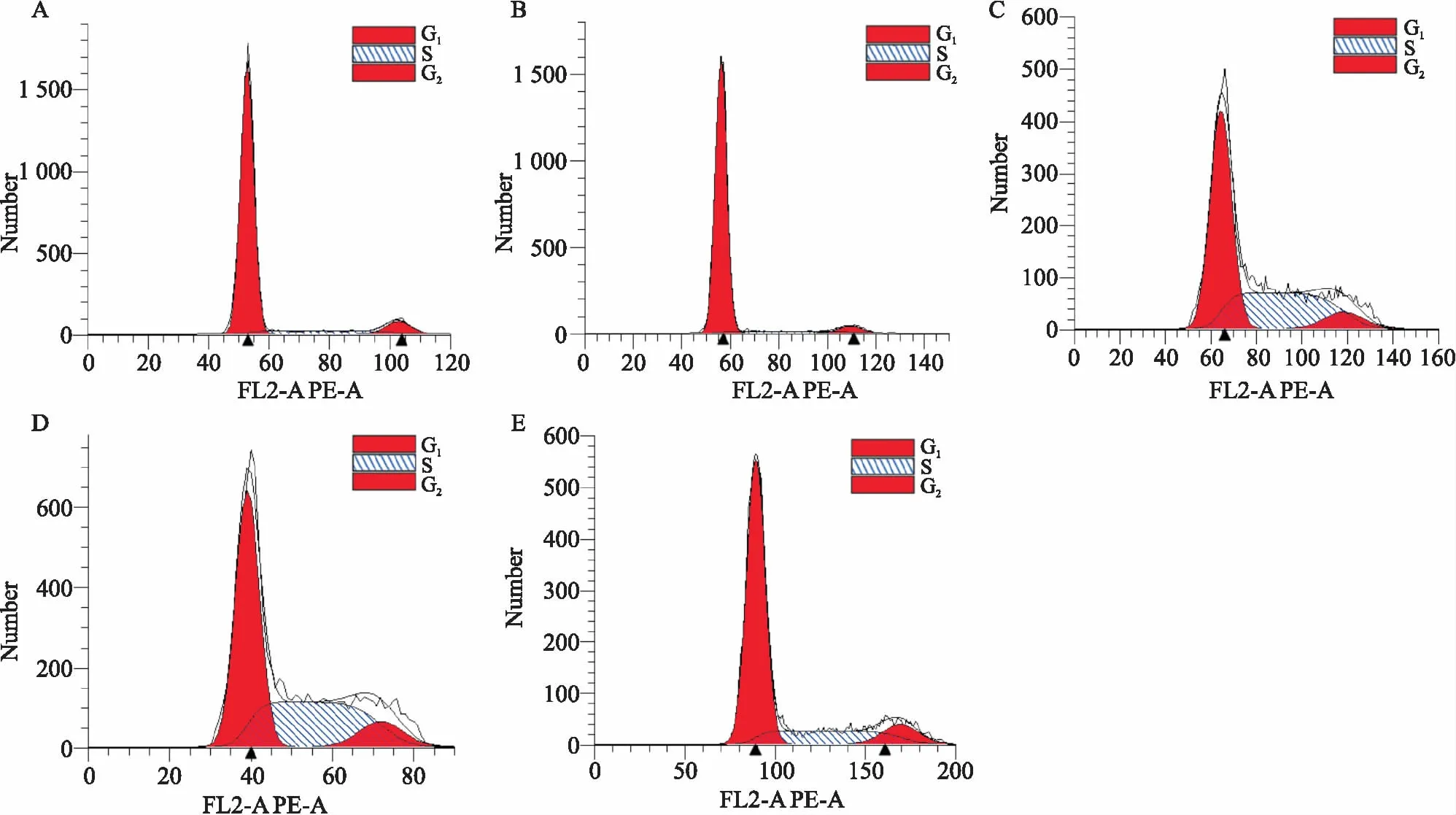
Fig3Cellcyclechangesineachgroup
A:BC group;B:OP group;C:Treatment of BC group with NaAsO2;D:Treatment of NC group with NaAsO2;E:Treatment of OP group with NaAsO2.

Fig 4 Changes of p53,CDC25A,CyclinA and CDK2 protein expression in different
*P<0.05,**P<0.01vsNC;##P<0.01vsBC alone
有报道,NaAsO2或三氧化二砷能诱导人正常肝细胞G2/M期阻滞、生长抑制[9]。本研究也发现,NaAsO2明显诱导SH-SY5Y细胞S期阻滞,而过表达MPST可减轻NaAsO2对S期的阻滞效应。这些结果提示,MPST过表达所发挥的保护效应可能与降低细胞S期阻滞有关。
为了探讨MPST对细胞S期相关蛋白的影响,我们进一步观察了p53、CDC25A、CyclinA及CDK2等S期相关蛋白的表达情况。研究发现,经NaAsO2处理后,SH-SY5Y细胞CyclinA、CDK2及CDC25A明显下调,p53明显上调;而过表达MPST可拮抗NaAsO2对CyclinA、CDK2、CDC25A及p53的作用。
CyclinA-CDK2是细胞S期主要的复合物,能启动DNA的复制[10-11]。据报道,阿霉素诱导肝癌细胞HepG2 S期阻滞,伴随CyclinA、CDK2及CDC25A表达下调[12]。有研究报道,miR-155可通过上调p53蛋白表达,诱导前列腺癌细胞周期阻滞[13]。在本研究中,NaAsO2可能通过上调p53,下调CyclinA、CDK2、CDC25A蛋白表达,诱导SH-SY5Y细胞S期阻滞;过表达MPST通过调节S期相关蛋白表达,发挥对NaAsO2毒性损伤的拮抗效应。
硫化氢对化学性神经细胞损伤具有保护作用,而MPST是硫化氢的内源性合成酶[4,14]。因此,外源性过表达MPST增加了内源性硫化氢,进一步拮抗砷造成的细胞S期阻滞,从而发挥对神经细胞的保护效应。本实验将为临床神经性砷中毒的防治提供一定的实验依据。
(致谢:本实验在贵州医科大学生理学教研室实验室完成,感谢所有老师和同学对本课题研究给予悉心指导和帮助。)
