沙棘甾醇化合物的分离纯化研究
2019-04-28龚晨高庆超常应九王悦王树林
龚晨,高庆超,常应九,王悦,王树林,2,*
(1.青海大学农牧学院,青海西宁810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁810016)
沙棘(Hippophae rhamnoidesL.)为胡颓子科沙棘属,包括柳叶沙棘、中国沙棘、中亚沙棘等。主要分布于我国青海、新疆等,种植面积占全世界的90%[1]。沙棘具有多种生物活性成分,如维生素C、黄酮、植物甾醇等。其中植物甾醇主要有β-谷甾醇、豆甾醇等,具有乳化性和稳定性,并能明显地降低体内胆固醇水平[2],对肿瘤的生长和癌细胞的扩散具有一定的抑制效果[3]。此外,还可促进机体对免疫系统的调节,并具有较强的抗氧化作用,已运用于医药、化妆品、食品、光学产品、植物基因工程等相关领域[4]。
目前国内外对植物甾醇提取分离的方法有皂化法、酯化法、溶剂结晶法、酶法和沸石吸附法等[5-6]。其中,最常用的方法是溶剂结晶法。该法可制备出高纯度的产品,且具有简便的工艺流程,适合工业化的连续生产。确定规模化生产前的工艺数据,是β-谷甾醇生产工艺研究的关键内容[7]。植物甾醇的纯化主要采用大孔树脂吸附法、分子蒸馏法、超临界CO2萃取法等[8-9]。由于大孔吸附树脂有较高的稳定性、较好的吸附选择性、较温和的解吸条件、较长的使用周期等特点,因而具有较好的纯化效果。植物甾醇的鉴定方法主要有反式高效液相色谱法、红外光谱法、薄层色谱法和气相色谱法等[10]。其中,薄层色谱法快捷简便、成本低,适合用作混合物中主要成分的快速分离与鉴定。
本试验采用皂化法通过单因素和正交试验确定制备β-谷甾醇粗制品的最佳工艺参数;利用重结晶法和大孔吸附树脂法对甾醇粗制品进行精制和纯化,并用薄层色谱法进行鉴定,以便提高β-谷甾醇的纯度。该研究结果可为今后沙棘中生物活性成分(β-谷甾醇)的理论研究、产品开发及工业化生产提供一定的理论依据和参考。
1 材料与方法
1.1 材料与仪器
AL204 万分之一分析天平:梅特勒-托利多仪器(上海)有限公司;PHSJ-4A 型pH 计:上海仪电分析仪器有限公司。
沙棘籽油:青海清华博众生物技术有限公司;β-谷甾醇标准品(98%):合肥博美生物科技有限责任公司;AB-8 大孔树脂:天津波鸿树脂科技有限公司;无水乙醇(AR):天津市富宇精细化工有限公司;三氯化铁(AR):昌邑宏达化工有限公司。
1.2 试验方法
1.2.1 β-谷甾醇标准曲线的绘制
将20 mg β-谷甾醇标准品溶于10 mL 无水乙醇中,配制成2 mg/mL β-谷甾醇标准溶液。使用时稀释10 倍,分别取0.0、0.5、1.0、1.5、2.0、2.5 mL 的200 μg/mL β-谷甾醇标准溶液于试管中,均以无水乙醇定容至4 mL,加入硫磷铁显色剂2 mL,振荡摇匀,室温下静置15 min 后进行全波长扫描,并在最大吸收波长处测定吸光值。以β-谷甾醇溶液质量浓度为横坐标,以吸光值为纵坐标,绘制标准曲线。
1.2.2 β-谷甾醇含量的的测定
将供试甾醇样品配制成浓度为0.04 mg/mL 的溶液。按照1.2.1 中的操作方法,于最大吸收波长处测定其吸光值,并计算β-谷甾醇含量[11],公式如下:
β-谷甾醇百分含量/%=(W×V×T)/M×100
式中:W为吸光值对应的样品中β-谷甾醇的浓度,mg/mL;V为定容体积,mL;T为稀释倍数;M为样品质量,mg。
1.2.3 β-谷甾醇的鉴定
参照文献并稍作修改[12-14],采用薄层色谱法进行鉴定。以石油醚∶乙醚=8∶2(体积比)的混合液为展开剂,10%的硫酸-无水乙醇溶液为显色剂,计算比移值,以鉴定混合物中的甾醇种类。
参照公式:Rf=A/B
式中:A为原点至斑点的距离,cm;B为原点至溶剂前沿的距离,cm。
1.2.4 沙棘甾醇分离纯化工艺
沙棘籽油→皂化→旋转蒸发浓缩→乙酸乙酯萃取→水洗至中性→旋转蒸发浓缩→干燥→甾醇粗制品→重结晶→甾醇精制品→大孔树脂吸附→薄层色谱鉴定
准确称取2.0 g 沙棘籽油于100 mL 具塞三角瓶中,按照比例加入50%KOH-无水乙醇混合液,置于恒温振荡器中皂化,震荡结束后,立即将皂化液放入冰水浴中冷却。加入90 mL 蒸馏水,用30 mL 乙酸乙酯萃取3 次,合并上清液,再用蒸馏水洗涤至中性。用旋转蒸发仪蒸发至体积约30 mL 后,烘干称重,即为甾醇粗制品,并计算其得率(得率/%=甾醇粗制品质量/原料油质量×100)。
取一定量甾醇粗制品,加热溶于适当体积的无水乙醇,置于4 ℃冰箱内养晶一段时间后,减压抽滤,收集滤纸上的晶体,并用旋转蒸发仪除去母液中的部分乙醇后,再次将其放置冰箱中继续养晶,一定时间后再次抽滤;重复3 次上述步骤。收集不同结晶时间得到的晶体,即为甾醇精制品,测定其中β-谷甾醇的含量。
利用大孔树脂吸附法,将吸附液上样并静置数小时后,加入解吸液进行洗脱,收集具有相同时间间隔的流出液,并将其烘干称重,测定其中β-谷甾醇的含量。并将纯化前后的β-谷甾醇分别进行薄层色谱鉴定。
1.2.4.1 β-谷甾醇粗制品制备的单因素试验
参考相关文献及预试验结果[15],考察50%KOH-无水乙醇溶剂配比为1∶1、1∶5、1∶10、1∶15(体积比);料液比为1∶10、1∶15、1∶20、1∶25(g/mL);皂化时间为1、2、3、4 h;皂化温度为70、80、90、95 ℃对 β-谷甾醇粗制品得率的影响。
1.2.4.2 β-谷甾醇粗制品制备的正交试验
参考文献[15]及单因素试验结果,正交试验考察的因素为溶剂配比、料液比、皂化温度、皂化时间,指标为甾醇粗制品得率,按照正交表L9(34)设计四因素三水平正交试验,正交试验因素水表见表1。

表1 正交试验因素水平表Table 1 Levels and factors of orthogonal experiment
1.2.4.3 重结晶次数对β-谷甾醇纯度的影响试验
称重干燥后的甾醇粗制品,按料液比为1∶15(g/mL)的比例加入无水乙醇加热至溶解,放置于冰箱4 ℃下养晶24 h,减压抽滤后,收集滤纸上的晶体,并用旋蒸仪使滤出母液的体积浓缩至原体积的1/2 并放置在4 ℃的冰箱中,养晶24 h 后再次减压抽滤;重复上述步骤3 次。将收集的晶体干燥保存,分别测定其中β-谷甾醇的含量。
1.2.4.4 β-谷甾醇的纯化及鉴定
采用大孔吸附树脂法,参考文献并作修改[16]。本试验选用AB-8 大孔吸附树脂,将晶体配制成0.10 mg/mL的吸附液;解吸液按照95%乙醇∶三氯甲烷=1∶5(体积比)进行配制。将吸附液上样4 h 后,加入解吸液进行洗脱,每隔15 min 分别对流出液进行收集,将收集液放置于60 ℃的烘箱中使溶剂全部蒸发后称重,再用无水乙醇配制成0.1 mg/mL 的待测液,测定其吸光值,计算β-谷甾醇的含量。
将纯化前后的β-谷甾醇分别利用薄层色谱法对混合物中甾醇的种类进行定性分析。
1.3 数据处理
试验数据采用SPSS2.0 软件和Excel 软件进行数据处理与分析。
2 试验结果与分析
2.1 β-谷甾醇的标准曲线
对β-谷甾醇标准溶液进行全波长扫描,确定其最大波长为442 nm(如图1所示)。以β-谷甾醇标准溶液质量浓度为横坐标,以吸光值为纵坐标,绘制标准曲线,得到回归方程y=0.229x+0.032(R2=0.998 8),其中y 为吸光值A;x 为β-谷甾醇标准溶液质量浓度(如图2)。

图1 β-谷甾醇标准品的全波长扫描图Fig.1 Scanning diagram of full wavelength of β-sitosterol sample

图2 β-谷甾醇标准曲线Fig.2 The standard curve of β-sitosterol
2.2 单因素试验结果与分析
2.2.1 溶剂配比对甾醇粗制品得率的影响
溶剂配比对甾醇粗制品得率的影响见图3。

图3 溶剂配比对甾醇粗制品得率的影响Fig.3 Effects of solvent ratio on the yield of sterol crude products
由图3可以看出,溶剂50%KOH-无水乙醇配比为1∶10(体积比)时,甾醇粗制品得率达到最大,随溶剂配比进一步增大,得率有小幅度下降。原因是当溶剂配比较低时,皂化不够充分,导致得率较低;溶剂配比过高时,增加了水洗难度[10]。所以溶剂配比1∶10(体积比)为最佳。
2.2.2 料液比对甾醇粗制品得率的影响
料液比对甾醇粗制品得率的影响见图4。

图4 料液比对甾醇粗制品得率的影响Fig.4 Effects of solid-liquid ratio on the yield of sterol crude products
由图4可知,当料液比1∶15(g/mL)时,甾醇粗制品得率最高。这是由于料液比较低时,提取不够充分,导致得率较低;料液比较高时,水洗过程中KOH 与甾醇分离不完全,同时也增加了试剂用量的需求和后期浓缩的难度[10]。所以料液比1∶15(g/mL)最为合适。
2.2.3 皂化时间对甾醇粗制品得率的影响
皂化时间对甾醇粗制品得率的影响见图5。

图5 皂化时间对甾醇粗制品得率的影响Fig.5 Effects of saponification time on the yield of sterol crude products
由图5可知,随皂化时间的延长,甾醇粗制品得率呈现先增后降的趋势。最佳皂化时间确定为2 h。皂化时间过短,导致皂化不完全。皂化时间过长,不易萃取分离,且会增加生产成本,降低生产效率。因此,最佳皂化时间为2 h。
2.2.4 皂化温度对甾醇粗制品得率的影响
皂化温度对甾醇粗制品得率的影响见图6。
由图6可知,甾醇粗制品得率由于皂化温度不同,呈现一定幅度的变化,且最适皂化温度为90 ℃。随皂化温度上升,得率下降,原因是温度升高可加速溶质的扩散和溶剂的渗透,使β-谷甾醇不断溶出;但温度过高会加快杂质的溶出,影响β-谷甾醇粗制品得率。所以最佳皂化温度为90 ℃。

图6 皂化温度对甾醇粗制品得率的影响Fig.6 Effects of saponification temperature on the yield of sterol crude products
2.3 正交试验结果与分析
以溶剂配比、液料比、皂化温度、皂化时间为考察因素,以甾醇粗制品得率为评价指标,采用L9(34)设计四因素三水平正交试验,优化甾醇粗制品提取工艺,试验结果见表2。
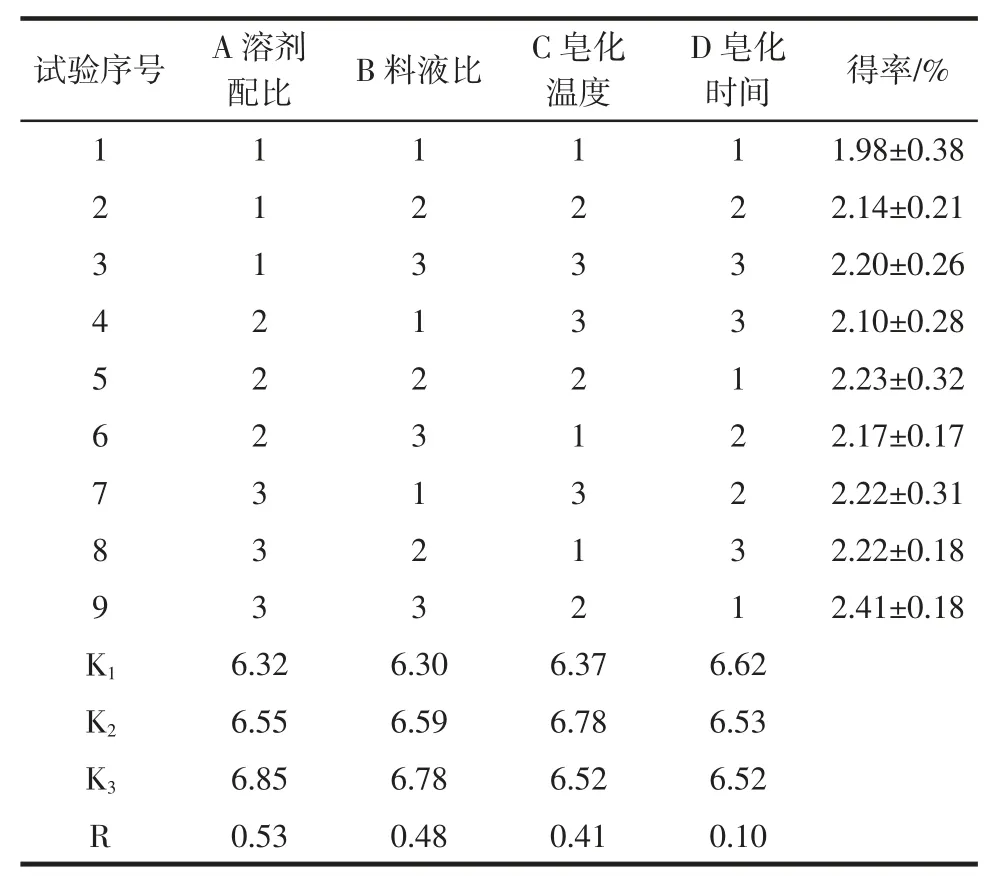
表2 正交试验方案及结果Table 2 Results and scheme of orthogonal experiment
根据表2,由极差分析可知,对β-谷甾醇粗制品得率产生影响的的主次因素:溶剂配比>料液比>皂化温度>皂化时间。优选组合为A3B3C2D1,即溶剂配比1∶12.5(体积比)、料液比1∶17.5(g/mL)、皂化温度90 ℃、皂化时间1.5 h。在此条件下甾醇粗制品的得率为(2.41±0.18)%。在验证试验中,按照最佳工艺条件制得的晶体中,β-谷甾醇的含量达到(91.41±0.21)%。
2.4 重结晶次数对β-谷甾醇纯度的影响结果
重结晶次数对β-谷甾醇纯度的影响结果见图7。
由图7可知,样品中β-谷甾醇纯度随重结晶次数增加而下降,第一次结晶得到的晶体中,β-谷甾醇含量为(91.41±0.75)%;第二次得到的晶体中,β-谷甾醇的含量为(72.81±0.12)%,第三次得到的晶体中,β-谷甾醇的含量为(56.03±1.39)%。
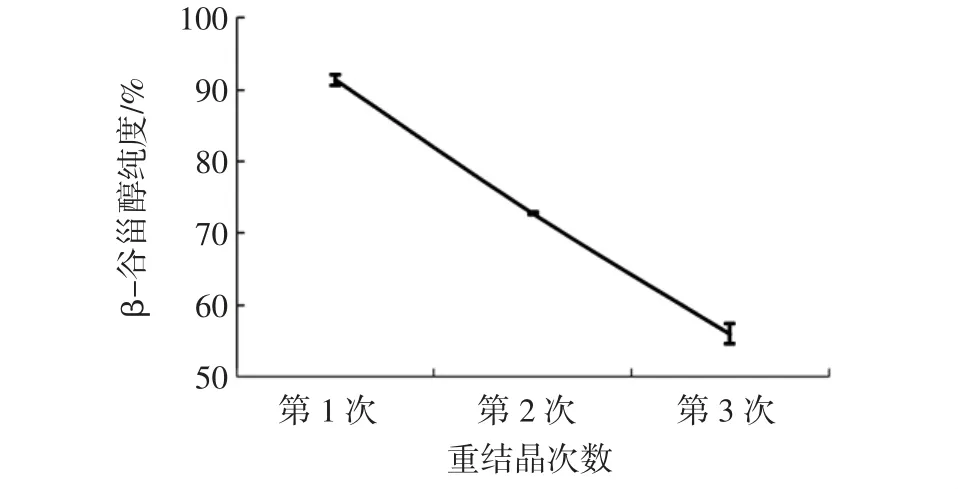
图7 重结晶次数对β-谷甾醇纯度的影响Fig.7 Influence of recrystallization number on the purity of βsitosterol
2.5 大孔吸附树脂纯化结果
洗脱时间对β-谷甾醇纯度影响的结果见图8
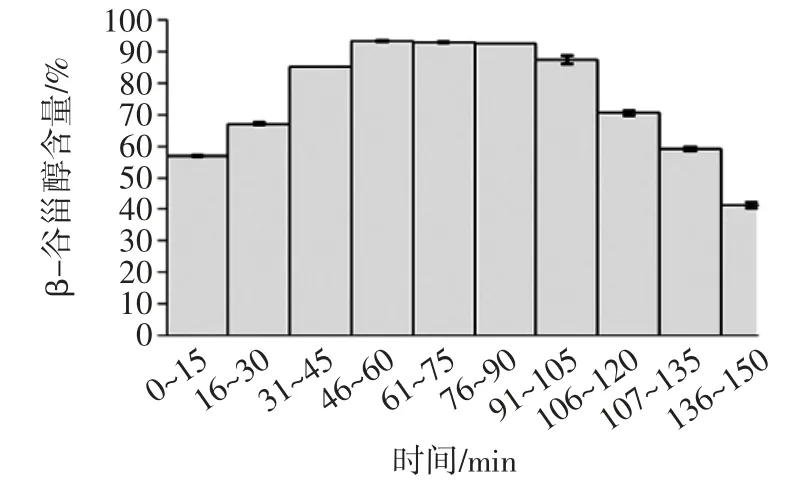
图8 洗脱时间对β-谷甾醇纯度的影响Fig.8 Influence of elution time on the purity of β-sitosterol
由图8可知,用解吸液进行洗脱时,随时间的延长,β-谷甾醇的纯度呈现先上升后下降的走势。在46 min~60 min 的时间段内,收集液中β-谷甾醇含量的含量最高,干制后产品中β-谷甾醇含量为(93.54±0.18)%;在46 min~90 min 内,β-谷甾醇百分含量均在92%以上,达到了一定的纯化效果。
2.6 薄层色谱鉴定结果与分析
对纯化后的沙棘β-谷甾醇的采用薄层色谱进行鉴定,鉴定结果见图9。

图9 薄层色谱鉴定图Fig.9 Chart of TLC identification
由图9可知,纯化前后的样品中都只有一种组分,且该组分与β-谷甾醇标准品有相同的比移值(Rf=0.29±0.01),因此,可以推断该混合物的组分为β-谷甾醇。
3 讨论
在试验中,采用皂化法提取沙棘籽油中甾醇化合物,通过单因素试验与正交优化设计确定了提取最佳工艺条件为:溶剂50%KOH-无水乙醇配比1∶12.5(体积比)、料液比1∶17.5(g/mL)、皂化温度90 ℃、皂化时间1.5 h。在此条件下甾醇粗制品得率为2.41%。这为今后沙棘籽油中甾醇成分的研究提供参考。由于皂化法的弊端,使得沙棘籽油在经过皂化完成后无法再次利用,因此,优化或开发新的甾醇提取分离方法将是今后的一个研究重点与难点。
由图7可知,重结晶过程中,β-谷甾醇纯度可达(91.41±0.75)%,这是由于温度降低时,β-谷甾醇的溶解度急剧下降,而其他种类甾醇的溶解度变化不明显[17],从而达到精制效果。许文林等[18]研究发现在结晶时间20 h 时,β-谷甾醇纯度最高,与本试验结果基本吻合。
由图8可知,随着洗脱时间的延长,β-谷甾醇纯度先上升后下降。原因是在开始洗脱时,由于β-谷甾醇未完全溶解到解吸液中,导致初始阶段的收集液中β-谷甾醇浓度偏低[19];在46 min~90 min 时,β-谷甾醇纯度达到92%以上。这将为今后沙棘功能活性成分(β-谷甾醇)高附加值产品的研发提供理论依据。
4 结论
皂化法制备甾醇粗制品的最佳工艺条件为:料液比1∶17.5(g/mL)、溶剂50 % KOH:无水乙醇配比1∶12.5(体积比)、皂化时间1.5 h、皂化温度90 ℃,得率为2.41%。通过重结晶法精制,β-谷甾醇纯度可达91.41 %。利用大孔吸附树脂法纯化时,洗脱时间在46 min~60 min 内,β-谷甾醇纯度达到93.54%,经薄层色谱法鉴定,纯化后的沙棘甾醇为β-谷甾醇。
