猫细小病毒抗体ELISA检测方法建立与初步应用
2019-04-28闫文卓胡建华刘铁龙张圆圆赵丽丽陈洪岩陆涛峰
闫文卓,周 洁,胡建华,刘铁龙,张圆圆,赵丽丽, 陈洪岩*,陆涛峰*
(1.黑龙江省实验动物与比较医学重点实验室,中国农业科学院哈尔滨兽医研究所,哈尔滨 100193;2.上海实验动物研究中心,上海 201203;3.河南省济源市动物卫生监督所,河南 济源 454650)
实验动物新资源开发与利用,一直是实验动物科技工作者的长期坚持的任务[1]。实验猫常被用于脑神经的生理及病理学实验,也是药理学实验和动物疾病模型中常用的动物[2],但是由于在饲料、饲养、繁殖和疫病净化等方面存在难题,猫的实验动物化进展缓慢[3]。国外很多国家已经建立了实验猫的繁育基地,有的国家通过疫病净化已培育出SPF猫和无菌猫,而我国目前尚无权威的猫保种和繁育基地,多数用于实验的猫多来自于宠物猫或捕获的野猫,安全隐患突显。
猫细小病毒(feline panleukopenia virus, FPV)又称猫泛白细胞减少综合征病毒、猫传染性肠炎病毒或猫瘟病毒,主要感染猫科和鼬科等多种动物,是目前肉食动物细小病毒属中感染范围最广、致病性最强的一种病毒[4],能引起以高热、呕吐、肠炎和白细胞严重减少为特征的急性、高度接触性传染病,死亡率一般为50%~60%。该病在世界范围内存在,我国多地均有本病发生,对猫及其它猫科动物危害极大[5-7]。针对该病免疫,有多种商品化疫苗(荷兰英特威、美国辉瑞和法国维克等)可以选择,但是针对该病的诊断试剂却参差不齐,因此,建立一种快速、准确、特异和灵敏的诊断方法不仅对于猫群体疫病净化有重要意义,更有利于推动我国实验猫的实验动物化进程。
1 材料和方法
1.1 病毒及样品
猫细小病毒(feline panleukopenia virus, FPV)由吉林大学任文陟老师惠赠。F81细胞由本实验室保存。山羊抗猫IgG-HRP购自Abcam公司。商品化FPV抗体ELISA试剂盒,猫疱疹病毒1型(FHV-1)和猫杯状病毒(FCV)阴、阳性对照血清均购自荷兰的BV European Veterinary Laboratory(EVL)公司。75份猫血清采自上海、大连和黑龙江等地。本实验过程遵循3R原则及动物福利伦理相关要求。
1.2 主要仪器
酶标仪使用美国Biotek公司产品,CO2培养箱使用Heal force公司产品,超速离心机使用Beckman公司产品。
1.3 实验方法
1.3.1 病毒滴度(TCID50)测定
将获得的病毒液进行10倍梯度稀释(10-1~10-8,共8个梯度)接种到F81细胞,每个梯度8个重复,72 h后观察细胞病变情况,按照Reed-Muench法[8]计算病毒滴度。
1.3.2 抗原制备及浓缩纯化
培养F81细胞,待细胞生长至80%汇合,按照感染复数(Multiplicity of Infection)为1的比例接种FPV病毒,待培养72 h后收集病毒液,反复冻融3次。收集的病毒液利用超速离心法浓缩纯化抗原。首先将病毒液4℃,4000 r/min离心20 min去除细胞碎片,收集上清,再重复一次;再将收集的上清使用32 Ti超速离心机转子,28 000 r/min于4℃离心2 h浓缩病毒;最后沉淀用500 μL PBS重悬,充分混匀,并用紫外分光光度法测定抗原蛋白含量。
1.3.3 最佳工作浓度的确定
以制备的抗原为包被抗原,用碳酸盐缓冲液倍比稀释为40 μg/mL、20 μg/mL、10 μg/mL、5 μg/mL、2.5 μg/mL和0 μg/mL包被酶标板,以1∶100倍稀释的FPV阳性血清为待检血清,将酶标抗体(山羊抗猫IgG-HRP)分别以1∶6000,1∶8000,1∶10000,1∶16000稀释,采用方阵法确定抗原和酶标抗体的最佳工作浓度。
以5 μg/mL的抗原浓度包被酶标板,优化封闭液和封闭时间。封闭液主要选择5%脱脂奶粉、5%胎牛血清和5% BSA,封闭时间选择37℃ 1 h、37℃ 2 h和4℃过夜。
1.3.4 判定标准的确定
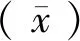
1.3.5 特异性试验
以优化的最佳检测条件,用制备的抗原包被酶标板,将FPV、FHV-1和FCV的阳性对照血清进行1∶100倍稀释进行检测,检验该方法的特异性。
1.3.6 敏感性试验
先将FPV阳性血清做50倍稀释,然后进行2倍梯度倍比稀释(1∶100~1∶6400),用建立的ELISA方法进行检测,根据判定标准,将最大稀释比例为阳性的稀释度判定为该方法的灵敏度。
1.3.7 重复性试验
为了测定批内重复性,随机选择5份猫血清样品,使用同一批包被的酶标板重复测定3次,计算批内变异系数(coefficient of variation, CV)。为了测定批间重复性,随机选择5份猫血清样品,使用不同批次包被的酶标板重复测定3次,计算批间变异系数(CV)。
1.3.8 初步应用及比较研究
用建立的ELISA方法和EVL试剂盒同时检测收集的75份猫血清,通过比较判定该方法的符合率。符合率=(阳性样品数+阴性样品数)/样品总数×100%。
2 结果
2.1 病毒滴度的确定
采用Reed-Muench法,测定获得FPV的滴度为5.76 lgTCID50/0.1 mL。
2.2 最佳工作条件的确定
通过方阵法,最终确定的抗原和酶标抗体的最佳工作浓度分别为5 μg/mL和1∶6000。通过优化封闭液发现5%脱脂奶粉具有良好的封闭效果,封闭时间三组之间差异不显著,鉴于37℃1 h能节省时间,因此选择5%脱脂奶粉于37℃封闭1 h为最佳封闭条件。
2.3 判定标准的确定
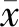
2.4 特异性实验
以优化的最佳检测条件,检测FPV、FHV-1和FCV的阳性对照血清,结果显示只有FPV阳性血清的观测值大于0.401,判定为阳性,而FHV-1和FCV阳性血清的观测值均低于0.401,判定为均为阴性,表明该方法具有良好的特异性。
2.5 敏感性实验
利用建立的抗体ELISA方法,分别对EVL试剂盒阳性对照和临床阳性血清进行梯度稀释,以测定该方法的敏感性。结果如图2所示,EVL试剂盒阳性对照在稀释度大于1∶800时观测值低于0.401,而临床阳性血清在稀释度大于1∶5000是观测值低于0.401,表明建立的抗体ELISA方法检测临床阳性血清的敏感性为1∶5000。另外,在实验中研究人员发现EVL的试剂盒阳性对照的OD450值相对于临床血清测得的OD450值偏低,说明利用本方法检测临床样品的敏感性良好。
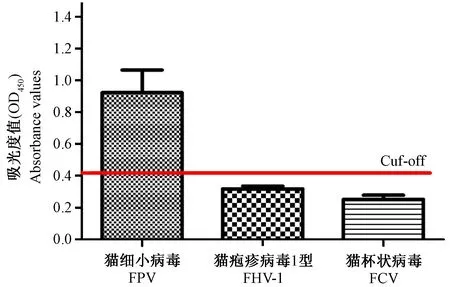
注:图中红色横线表示Cut-off值。图1 特异性实验Note. The red line in the figure represents the cut-off value.Figure 1 Specificity experiment

注:图中红色横线表示Cut-off值。图2 敏感性实验Note. The red line in the figure represents the cut-off value.Figure 2 Sensitivity experiment
2.6 重复性实验
分别采用同批次和不同批次包被的酶标板,分别检测5份猫血清样品,每份样品重复3次,结果如表1所示,批次内和批次间的变异系数分别为8.68%和7.14%,除2份阴性血清的变异系数稍大外(12%和13.9%),阳性血清在批次间和批次内的重复性均良好(<10%)。分析原因,阴性样品测定变异系数偏大可能是仪器测定误差所导致的。
2.7 临床样品检测
利用建立的ELISA方法和EVL试剂盒检测收集的75份猫血清,阴阳性判定结果如表2所示,计算符合率为90.7%(68/75)。因此建立的FPV抗体检测方法与EVL公司试剂盒的符合率为90.7%。

表1 重复性实验

表2 临床样品检测
3 讨论
猫是药理学实验和动物疾病模型中常用的动物,中国药典也规定了猫作为降压药检测的实验动物,但由于缺乏检测试剂,多数用于实验的猫多为未经检测的宠物猫或捕获的野猫,安全隐患突显。为了推动我国实验猫质量改善,提高实验猫实验动物化水平,本团队一直致力于实验猫诊断制剂的开发。FPV是侵害猫的重要病原微生物,该病的发病率和死亡率均较高,严重影响猫的健康。虽然已有多种针对猫细小病毒的疫苗可以用于该病的防控,但该病的抗体检测试剂盒一直没有实现商品化,严重制约实验猫的质量提高。虽然早在1990年就有猫细小病毒间接ELISA方法的报道[9],也有多篇文献[10-13]报道了FPV抗体检测方法的建立和应用,但一直没有可以真正应用于临床检测的产品出现,也缺乏FPV的相关国家标准的实施。因此,本研究致力于建立一种FPV抗体检测方法,并应用于进一步试剂盒的开发。
为了提高检测方法的敏感性,本研究利用纯化的FPV作为包被抗原,通过优化抗原浓度、封闭液、封闭时间、待检血清稀释度和酶标抗体的浓度,建立了特异性、敏感性、稳定性良好的FPV抗体检测方法。该方法批次内和批次间的变异系数分别为8.68%和7.14%,检测临床血清的灵敏度大于1∶5000,与国外试剂盒符合率达到90.7%。值得提到的是,在实验过程中,研究人员比较了国内某品牌试剂盒和国外试剂盒与该方法的差异,发现国内的某个检测产品完全不能工作,国外试剂盒虽然与本方法符合率较好,但其阳性对照一直不稳定,也存在一定缺陷。此外,利用该方法检测临床猫血清样品发现血清阳性率达84%(63/75),高于其他研究的73%(44/60),由于大部分猫的来源、疫苗免疫状况等不甚清楚,所以无法确定抗体阳性个体是接种疫苗产生抗体,还是自然感染产生的抗体,但也从一定程度反映了FPV感染的风险。由于猫阴性血清的不易得,因此在本方法的Cut-off值判定中仅选择了12个阴性样品,这种状况也反映了猫实验动物化的重要性。
综上,本研究建立了猫FPV抗体ELISA检测方法,该方法特异性、敏感性、稳定性良好,而且操作简便、快速,从而为猫FPV抗体ELISA检测试剂盒的研发奠定基础。
