肠胃宁胶囊安全性评价研究
2019-04-28戴晓莉马玉奎
刘 丽,戴晓莉,孙 超,马玉奎*
(1. 山东仙河药业有限公司,山东 东营 2572311; 2. 山东省药学科学院新药评价中心, 济南 250100)
肠胃宁胶囊是由党参、白术、黄芪、赤石脂、干姜(炭)、木香、砂仁、补骨脂、葛根、防风、白芍、延胡索、当归、儿茶、罂粟壳、甘草(炙)等组成的中药复方制剂,具有健脾益肾、温中止痛及涩肠止泻的功效。该制剂主要用于脾肾阳虚所致的泄泻,症见大便不调、五更泄泻、时带黏液、伴腹胀腹痛、胃脘不舒和小腹坠胀等[1-2]。近年来,随着中药在临床上的广泛应用,不良反应事件频发,中药的安全性越来越受到重视,但因其成分复杂,给不良反应的监控带来了诸多困难[3]。故需要反过来从基础研究入手,进一步研究中药的安全性。因肠胃宁胶囊上市前未开展毒理学评价研究,国内无相关临床前安全性信息,为保证临床用药的安全性,指导临床合理用药,保障适用人群的用药安全,故对肠胃宁胶囊的临床前安全性重新评价。本文在GLP条件下,利用SPF级小鼠、大鼠为实验动物,经单次和重复给药,对其进行了临床前安全性评价研究,为该药品的临床应用提供参考。
1 材料和方法
1.1 实验动物
SPF级昆明小鼠40只,体重(20±2)g,SPF级SD大鼠120只,体重(210±10)g,均购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。实验动物饲养于山东省药学科学院新药评价中心SPF级动物房[SYXK(鲁)2014-0008],环境温度20℃~26℃,日温差≤4℃,湿度40%~70%,换气次数每小时8~10次,动物自由饮食饮水。本实验遵循实验动物使用的3R原则,对动物给予人道主义关怀[IACUC审批编号:IACUC-059]。
1.2 主要试剂与仪器
肠胃宁胶囊(山东仙河药业有限公司,批号:80930D4)。戊巴比妥钠(德国默克公司,批号:170108);生化分析仪所用试剂盒(上海执诚生物技术有限公司);生化分析仪、血液分析仪所用质控液(英国RANDOX实验室有限公司);电解质分析所用试剂、质控液(日立仪器(苏州)有限公司);凝血酶原时间、凝血酶时间试剂(上海太阳生物技术有限公司);凝血质控血浆(Siemens Healthcare Diagnostics Products GmbH公司);血液分析仪所用试剂(Sysmex Corporation公司)。
SYSMEX XT-2000IV全自动血球计数仪(日本Sysmex公司)、日立7180全自动生化分析仪(日本株式会社日立高新技术)、JY2001型电子天平(奥豪斯仪器常州有限公司)、TDL-5台式低速大容量离心机(江苏金坛市医疗仪器厂);NP-B型生物组织包埋机(湖北诺普医疗器械有限公司);TK-218摊烤片机(湖北泰维医疗器械有限公司);樱花VIP-6型生物组织脱水机(日本樱花公司);RM2235切片机、DMLS2显微镜(德国Leica公司)。
1.3 实验方法
1.3.1 小鼠单次给药毒性试验
(一)剂量设计依据
根据药物非临床安全性研究技术指导原则确定试验剂量[4]。肠胃宁胶囊临床用药剂量为一日3次,一次4~5粒,每粒0.3 g,故人用日最大剂量为4.5 g,按照成人体重为60 kg计算,为0.075 g/ kg。按照等效剂量折算系数计算小鼠等效剂量约为0.7 g/kg。
肠胃宁胶囊内容物最大溶解度为0.4 g/mL,小鼠最大灌胃体积为40 mL/kg,故可采用最大给药浓度和最大给药体积给予小鼠,即单次给药16 g/kg,一日给药2次,总剂量为32 g/kg。
(二)实验方法
SPF小鼠40只,给药前禁食约12 h,空腹后按体重均衡原则分为2组,即空白对照组和肠胃宁胶囊组。肠胃宁胶囊组按照40 mL/kg给药容积灌胃给予0.4 g/mL浓度的药物混悬液,给药2次,间隔约6 h,空白对照组给予等容积的纯水。给药后详细观察动物的外观反应,分别于药后3、7、10、14 d称量动物体重,每天观察1次,连续观察14 d。观察结束,戊巴比妥钠安乐处死小鼠后剖检,肉眼观察心脏、肝脏、脾脏、肺脏、肾脏等主要脏器有无分泌物(或渗出物)、淤血、出血、水肿、坏死等肉眼可见病变,如有病变组织需进行毒性病理学检查。
1.3.2 大鼠重复给药毒性试验
(一)剂量设计依据
根据药物临床前研究技术指导原则确定试验剂量[4]。肠胃宁胶囊临床用药剂量为一日3次,一次4~5粒,每粒0.3 g,故人用日最大剂量为4.5 g,按照成人体重为60 kg计算,为0.075 g/kg。按照等效剂量折算系数计算大鼠的等效剂量约为0.5 g/kg。重复给药毒性试验目的为尽可能暴露药物的毒性,故考虑到本品毒性较小及给药可操作性,高剂量可采用0.3 g/mL给药浓度和15 mL/kg给药容积,一日2次灌胃给药。选用高剂量的1/3和1/9作为则中、低剂量,三个剂量分别为9、3、1 g/kg,分别相当于药效学剂量的18、6和2倍,临床人用剂量的120、40和13倍。
(二)实验方法
SPF大鼠120只,按体重均衡原则[5-6]分为4组,即空白对照组和肠胃宁胶囊9、3、1 g/kg三个剂量组,每组30只动物,雌雄各半。各组灌胃给予相应剂量的药物混悬液15 mL/kg,空白对照组给予等容积的纯水。大鼠上下午各给药1次,间隔约6 h,连续给药13周,停药恢复4周。每次给药前后详细观察动物的外观反应,每周称量1次体重和摄食量。给药13周结束各组取20只大鼠,恢复4周结束各组取剩余10只大鼠,戊巴比妥钠麻醉后腹主动脉采血,进行血液学及血液生化学检查。剖检摘取各脏器,其中心脏、肝脏、脾脏、肾脏、脑、睾丸、附睾、子宫、卵巢、肾上腺、胸腺主要脏器需称量。所有脏器中性甲醛溶液固定后进行毒性病理学检查。
1.3.3 检测指标
血液学指标:白细胞(WBC)、红细胞(RBC)、血红蛋白 (HGB)、红细胞压积(HCT)、血小板(PLT)、平均血小板体积(MPV)、血小板压积(PCT)、红细胞平均体积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、中性细胞比率(NEUT%)、淋巴细胞比率(LYMPH%)、嗜酸性粒细胞比率(EO%)、嗜碱性粒细胞比率(BASO%)、单核细胞比率(MONO%)、红细胞分布宽度-变异系数(RDW-CV)、网织红细胞比率 (RET%)、凝血酶时间(TT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)。
血液生化学指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、总蛋白(TP)、总胆固醇(TC)、碱性磷酸酶(ALP)、总胆红素(TBIL)、白蛋白(ALB)、肌酐(CR)、葡萄糖(GLU)、甘油三酯(TG)、肌酸激酶(CK)、钠离子(Na+)、钾离子(K+)、氯离子(Cl-)。
病理检查器官或组织:脑、心脏、肝、脾、肺、肾、肾上腺、胸腺、睾丸、附睾、甲状腺、胸骨、脊髓(颈、胸、腰段)、甲状旁腺、食管、气管、颌下腺、胃、小肠、大肠、直肠、胰腺、主动脉、淋巴结、坐骨神经、膀胱、前列腺、垂体。
1.4 统计学方法
2 结果
2.1 小鼠单次给药毒性试验
小鼠灌胃给予肠胃宁胶囊后当日及连续观察14 d内未见明显毒性反应,肠胃宁胶囊各剂量组动物体重增长与同期空白对照组基本一致。观察期结束后剖检小鼠,各主要脏器色泽、形态均正常,触及无结节,均未发现肉眼可见异常,故未进行组织病理学检查。故本试验条件下,小鼠最大给药量为32 g/kg。小鼠体重数据见下表1。
2.2 大鼠重复给药毒性试
试验结果显示,所有动物均未出现任何毒性反应。大鼠连续灌胃给药13周及恢复4周检测结果显示,与空白对照组比较,肠胃宁胶囊9、3、1 g/kg三个剂量组大鼠体重、摄食量、血液学、血液生化学及脏器相对重量均无明显差异(P>0.05)。病理学检查结果显示,所有大鼠所有脏器均未出现药物相关性病理组织学病变。给药13周大鼠主要检测指标见表2和表3,肝、肾病理图片见图1。
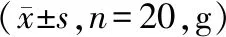
表1 肠胃宁胶囊对小鼠体重的影响
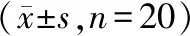
表2 肠胃宁胶囊重复给药13周对SD大鼠血液学的影响
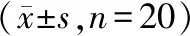
表3 肠胃宁胶囊重复给药13周对SD大鼠血液生化学的影响
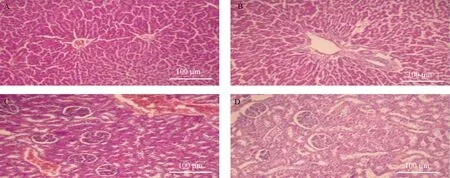
注:A:肠胃宁胶囊高剂量组-肝;B:空白对照组-肝;C:肠胃宁胶囊高剂量组-肾;D空白对照组-肾。图1 给药13周时小鼠肠胃宁胶囊高剂量组及空白对照组组织病理学图片(×10,HE染色)Note. A,High dosage of Chang Wei Ning capsule group,liver. B,Normal control group,liver. C,High dosage of Chang Wei Ning capsule group,kidney.D,Normal control group,kidney.Figure 1 Histopathological images of Chang Wei Ning capsule and normal control mice during 13week administration(HE staining)
3 讨论
单次给药毒性(急性毒性,single dose toxicity)是指一天内一次或者多次将受试药物给予动物后产生的毒性反应。其目的是初步探索药物的毒性作用和毒性靶器官。临床上药物过量导致的急性中毒相关信息可从此试验研究结果中获得。单次给药毒性试验研究常用LD50法、最大耐受量、最大给药量、限度试验等方法[6]。对于毒性较小的药物,最常用的方法为最大给药量法,是指动物单次或24 h内多次(2~3次)给药所采用的最大给药剂量。肠胃宁胶囊内容物最大溶解度为0.4 g/mL,小鼠最大灌胃体积为40 mL/kg,故可给予小鼠的最大给药量为16 g/kg,一日可给药2次。本试验结果显示,本品在日最大给药量(MFD)32 g/kg时小鼠未见任何不良反应,相当于小鼠药效学等效剂量的46倍左右,临床人用剂量的427倍左右。
重复给药毒性试验研究(repeated dose toxicity)是药物临床前安全性评价最主要内容,通过将药物按照临床用药途径大剂量重复多次给予动物,密切检测动物产生的毒性反应和中毒靶组织器官,能够获得毒性产生的量效和时效关系,预测药物在临床上可能出现的毒性反应性质及发生率,对药物的临床应用具有重要的参考意义[4,7]。本文SD大鼠重复给药毒性试验结果表明,肠胃宁胶囊9、3、1 g/kg三个剂量下对大鼠体重、摄食量、血液学、血液生化学及脏器相对重量均无明显影响。病理学检查结果亦显示,以上剂量下未见明显的毒性靶器官。从试验结果可得大鼠重复给药13周最大无毒反应剂量(NOAEL)大于9 g/kg,此剂量相当于大鼠药效学等效剂量的18倍,临床人用剂量的120倍。
综上所述,通过本研究结果可得肠胃宁胶囊小鼠单次给药最大给药量(MFD)为32 g/kg;大鼠重复给药13周最大无毒反应剂量(NOAEL)大于9 g/kg。提示本品临床应用安全范围较大,安全窗较宽。
