高蛋白高钙饮食合并限制饮水建立鹌鹑痛风模型初探
2019-04-28王海鸽林志健李高玺
王海鸽,林志健,张 冰,李高玺,王 笑
(北京中医药大学中药学院,北京 100029)
人类在进化过程中发生了基因突变,缺乏尿酸氧化酶,以尿酸为嘌呤代谢终产物,使得人类血尿酸水平远高于其他哺乳动物,从而易患高尿酸血症及痛风[1]。而禽类肝不含精氨酸酶和氨甲酰磷酸合成酶,摄入的蛋白质最终也以尿酸的形式自肾排出,与人类尿酸代谢更加接近。禽痛风是一种发病率较高的禽类常见疾病[2-3],国内外多有报道,高蛋白、高钙的营养性因素可引发禽类痛风,导致禽类出现关节肿胀、运动障碍、内脏尿酸盐沉积甚或大批量死亡等[4-6]。实验常用的啮齿类动物等具有尿酸酶,可将尿酸降解成尿囊素排出体外,尿酸酶缺失鼠造价昂贵。常用的实验模型仅能模拟关节痛风症状[7],与人类痛风发病机理不相一致。以禽类作为痛风模型动物,建立模拟临床饮食诱导的鹌鹑痛风模型,从尿酸代谢途径的相似性、操作的简便性、经济性等方面均具有优势。
本实验模拟临床发病病因,以酵母、骨粉作为高蛋白、高钙日粮添加剂饲喂迪法克鹌鹑,并对比自由饮水和限制饮水,探讨高蛋白高钙日粮及饮水量对鹌鹑尿酸代谢及痛风发生的影响,以期建立稳定持久、操作简便、适合大批量实验的痛风模型,为痛风的基础及药物开发研究提供参考。
1 材料和方法
1.1 实验动物
普通级雄性迪法克鹌鹑36只,30日龄,体重(150±10)g,均购自北京市徳岭鹌鹑养殖场[SCXK(京)110113600218082]。鹌鹑购入后,饲养于北京中医药大学普通级动物实验室[SYXF(京)2016-0038]。并按实验动物使用的3R原则给予人道的关怀。伦理审查证号:1100000013479。饲养环境:室温20℃~25℃,相对湿度40%~60%,光照12 h明,12 h暗。
1.2 主要试剂与仪器
造模添加剂:酵母浸膏粉(批号:1349145-02;500 g),购自北京化学试剂公司;骨粉(批号:20180301;500 g),购自衡水爱宠商贸有限公司。
检测试剂盒:尿酸测定试剂盒(批号:181361;100T;生产时间:20180109),购自中生北生物科技股份有限公司;尿素氮测定试剂盒(批号:20180408;96T;生产时间:20180408)、肌酐测定试剂盒(批号:20171124;96T;生产时间:20171124),均购自南京建成生物工程研究所;尿酸盐染色试剂盒(批号:20180604;4×50 mL;生产时间:20180604),购自北京索莱宝科技有限公司。
SHZ88-1型台式水浴恒温震荡器,北京医疗设备厂;3K1S低温高速离心机,德国Sigma公司;sunrise酶标仪,瑞士TECAN公司;DHG-9070A电热恒温鼓风干燥箱,北京鸿达天矩试验设备有限公司;Reichert Histo STAT石蜡组织切片机,美国AO公司;Olympus BX53显微镜,日本奥林巴斯;Himadzu B1-220H电子天平,日本岛津公司。
1.3 实验方法
1.3.1 造模方法
对实验鹌鹑按鹌鹑免疫程序进行免疫,选取36只经常规免疫接种的雄性30日龄、体重相近、血尿酸水平相近的迪法克鹌鹑开展实验研究(购自北京种禽公司德岭鹌鹑场)。随机分为3组,每组12只,即对照组、模型Ⅰ组、模型Ⅱ组。
对照组鹌鹑饲喂基础日粮(日粮粗蛋白含量21.7%,钙含量1%),模型Ⅰ组和模型Ⅱ组饲喂高蛋白高钙日粮(日粮粗蛋白含量29.5%,钙含量7.8%),对照组和模型Ⅰ组鹌鹑自由饮水,模型Ⅱ组鹌鹑每日限制饮水4 h。日粮除嘌呤和钙水平之外,其余营养成分均符合美国NRC家禽营养需要标准[8]。日粮组成和主要营养成分见表1。实验鹌鹑笼养,每日定时喂饲料,并清洁鹌鹑舍。每10 d称取一次鹌鹑体质量,并于晚8点禁食,于次日早8点颈静脉取血一次,检测血清生化指标。每20 d给鹌鹑放入代谢笼,收取24 h鹌鹑粪尿混合物,检测粪尿上清液生化指标。实验第50天,鹌鹑颈静脉取血1.5 mL后处死,取各组鹌鹑肾脏组织固定、石蜡包埋。控制动物房室温20℃~25℃,湿度40%~60%。光照12 h明,12 h暗。
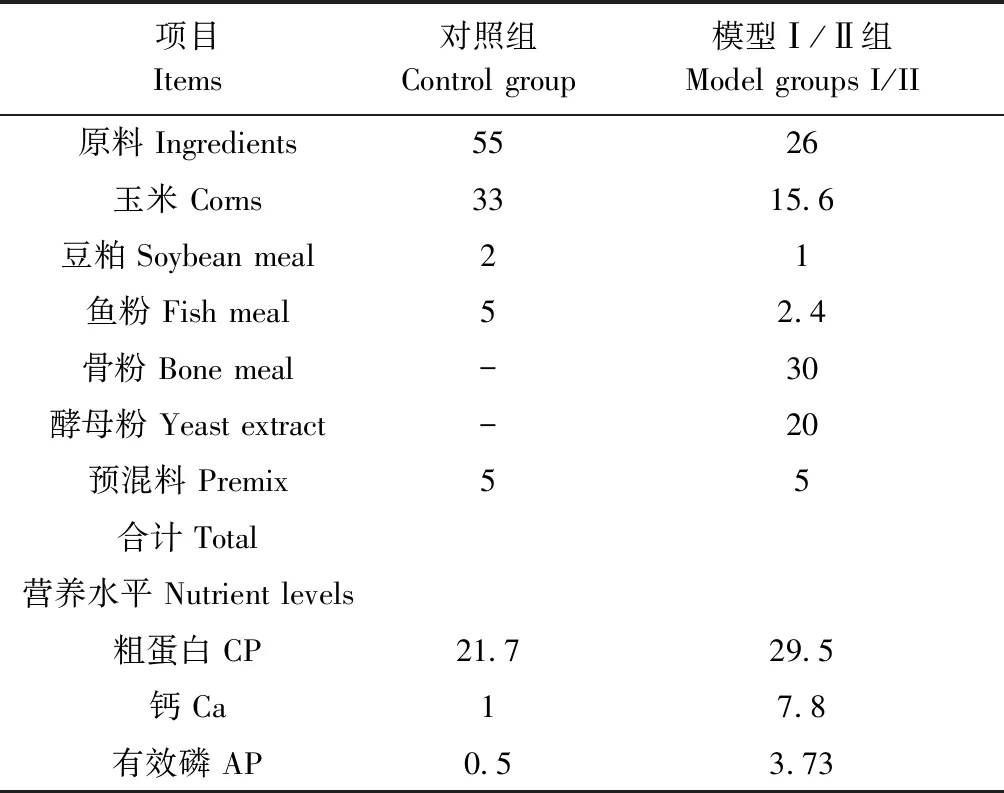
表1 造模剂配比及营养水平(风干基础,%)
注:预混料为每千克饲粮提供:维生素A 200000 IU,维生素D3 60000 IU,维生素E 380 mg,维生素K3 56 mg,维生素B1 56 mg,维生素B2 200 mg,维生素B6 60 mg,维生素B12 300 μg,生物素 3 mg,烟酸 600 mg,泛酸钙 240 mg,叶酸 30 mg,铜 0.2 g,铁 1.8 g,锰 1.4 g,锌 1.1 g,硒 6 mg,碘 8.5 g,磷 15~60 g,钙 100~250 g,氯化钠 50~150 g,氨基酸 28 g。
Note. The premix provides the following nutrients per kg diets: VA 200000 IU, VD3 60000 IU,VE 380 mg, VK3 56 mg,VB1 56 mg,VB2 200 mg, VB6 60 mg,VB12 300 μg,biotin 3 mg,niacin 600 mg,pantothenic acid 240 mg,folic acid 30 mg,Cu 0.2 g,Fe 1.8 g,Mn 1.4 g,Zn 1.1 g,Se 6 mg,I 8.5 mg,P 15~60 g, Ca 100~250 g,NaCl 50~150 g, amino acids 28 g.
1.3.2 一般状态观察
实验期间每天定时称量耗料量;每10 d称重一次,每次称重时间保持一致;每10 d测量一次动物踝关节周径,用软线环绕鹌鹑踝关节三周,连续测量3次,保证每次测量时间及位置一致,以测量区软线长度平均值的1/3作为鹌鹑踝关节周径。踝关节肿胀度(%)=(测量日踝关节周径-实验前踝关节周径)/实验前踝关节周径×100%。计算各组鹌鹑平均采食量、体重和关节肿胀度。实验期间每日观察鹌鹑的精神状态、食欲、粪便情况、运动状态等。
1.3.3 肾病理变化及尿酸盐沉积
实验持续30 d结束,对动物禁食不禁水12 h后,空腹采血2 mL,处死动物,取动物肾样本,进行固定、包埋、切片、HE染色、尿酸盐染色。观察动物肾病理形态及尿酸盐沉积状况。
1.3.4 血清生化指标
实验开始前采集鹌鹑血液,检测血清尿酸水平,记录鹌鹑初始尿酸水平。实验期间,以10 d作为一个周期动态观测鹌鹑血清尿酸、肌酐、尿素氮水平。即每10 d对动物禁食不进水12 h后,空腹颈静脉采血1.0 mL,静置3 h后,4℃ 3500 r/min离心10 min,分离血清。在半自动生化仪上,以酶比色法测定鹌鹑血清尿酸、尿素氮、肌酐水平。
1.3.5 粪尿生化指标
实验第20天对鹌鹑进行一次代谢收集,收集其粪尿混合物,充分震荡,4℃ 3500 r/min离心10 min,分离上清液。在半自动生化仪上,以酶比色法测定鹌鹑血清尿酸水平。
1.4 统计学方法:
2 结果:
2.1 造模期间鹌鹑痛风症状
由表2、表3、表4、图1可知,实验期间对照组鹌鹑体重、日均采食量平稳上涨;踝关节未见明显肿胀;毛色鲜亮、有光泽;鸣叫声嘹亮;活泼好动,其精神状态、行为状态良好。模型Ⅰ组鹌鹑体重较对照组高,一般状态良好,与对照组相较无显著性差异。模型Ⅱ组鹌鹑鹌鹑体重、日均采食量平稳上涨;可见踝关节明显肿胀,实验第10天,显著性高于对照组(P<0.05),实验第20~50天踝关节肿胀度极显著性高于对照组(P<0.01);毛色鲜亮、有光泽;鸣叫声嘶哑;部分鹌鹑出现懒动喜卧、跛足、足趾变型等症状。
2.2 造模后鹌鹑肾病理变化及尿酸盐沉积状况:
鹌鹑肾脏病理切片HE染色400倍光学显微镜下可见对照组鹌鹑肾组织结构清晰,细胞核蓝染,细胞浆均匀红染,肾小球、肾小管结构正常。模型Ⅰ组鹌鹑肾组织结构未见明显异常,组织结构清晰,肾小管上皮细胞形态正常。模型Ⅱ组鹌鹑肾组织结构清晰,细胞浆疏松、不均匀红染,部分肾小球萎缩,肾小管管腔扩张。见图2。
鹌鹑肾尿酸盐染色400倍光学显微镜下可见,对照组鹌鹑肾组织未见黑色尿酸盐结晶。模型Ⅰ组鹌鹑肾组织明显可见黑色的尿酸盐结晶沉积于肾小管周围。模型Ⅱ组鹌鹑肾组织显著可见大量黑色尿酸盐结晶沉积于肾小管周围。见图3。
2.3 造模期间鹌鹑尿酸水平
由表5、表6可见,实验期间,与对照组相比,模型Ⅰ组鹌鹑于实验第20 d血清尿酸水平显著性高于对照组(P<0.05),实验第30~50天血清尿酸水平均极显著性高于对照组(P<0.01);模型Ⅱ组鹌鹑于实验第10~50天血清尿酸水平均极显著性高于对照组(P<0.01)。其余各组血清尿酸水平与对照组相比无显著性差异(P>0.05)。
实验期间,与对照组相比,模型Ⅰ组鹌鹑于实验第20天粪尿尿酸水平显著性低于对照组(P<0.05);模型Ⅱ组鹌鹑于实验第40天粪尿尿酸水平显著性低于对照组(P<0.05),实验第20天粪尿尿酸水平极显著性低于对照组(P<0.01)。

表2 高蛋白高钙日粮对鹌鹑体重的影响
表3 高蛋白高钙日粮对鹌鹑采食量的影响
注:与同期对照组比较,*P<0.05,**P<0.01。下表同。
Note: Compared with the control group at the same day,*P<0.05,**P<0.01.The same in the following tables.

表4 实验期间各组鹌鹑右足踝关节肿胀度(%,n=12)

表5 高蛋白高钙日粮对鹌鹑血清尿酸水平的影响

组别Groups20天20 d 40天40 d对照组 Control group33281.32±6344.9318412.57±4528.81模型Ⅰ组 Model group I24443.98±11095.04∗16726.30±4641.35模型Ⅱ组 Model group II16730.43±11415.54∗∗14102.99±4388.33∗
注:与同期对照组比较,*P<0.05,**P<0.01。
Note. Compared with the control group of the same at the same day,*P<0.05,**P<0.01.
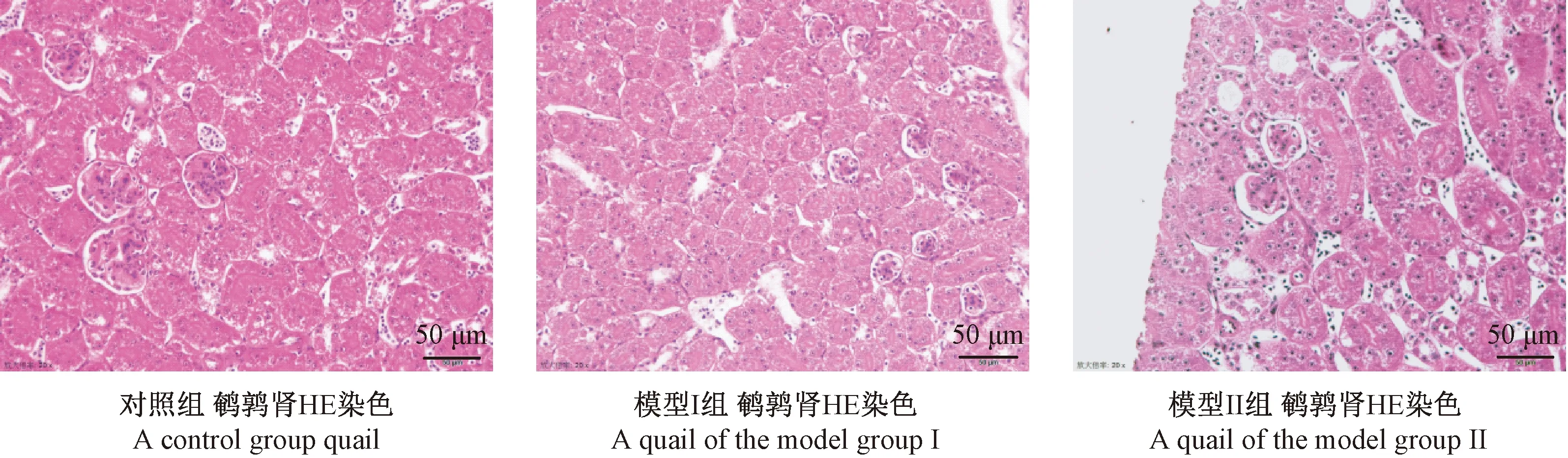
图2 鹌鹑肾HE染色病理切片(×400)Figure 2 Histological changes of the quail renal tissues(HE staining)
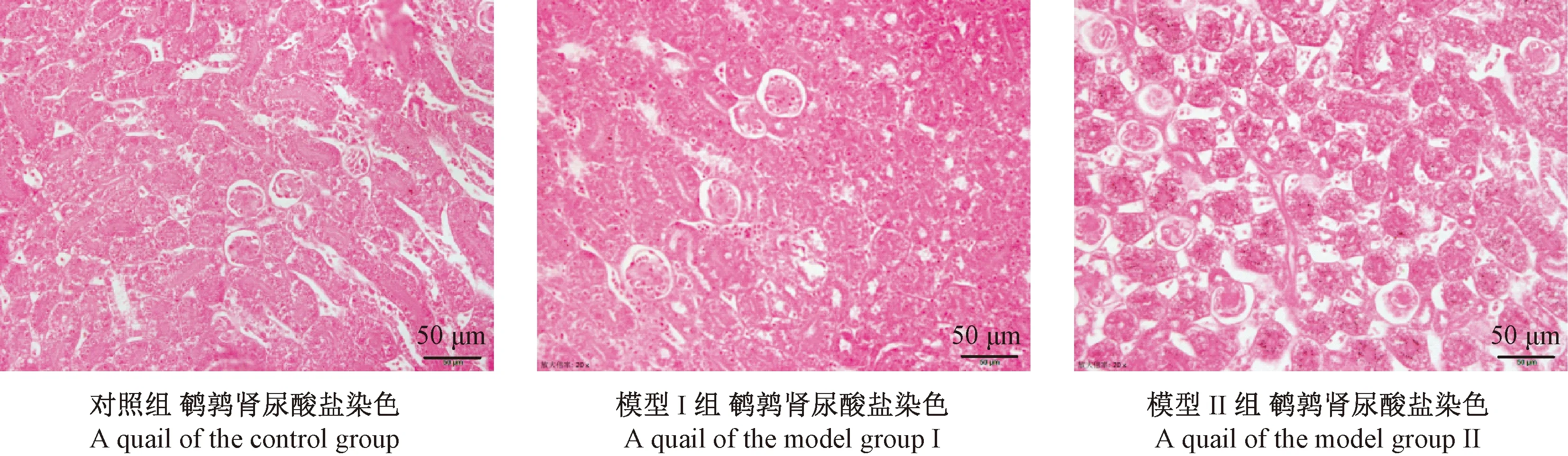
图3 鹌鹑肾尿酸盐染色病理切片(×400)Figure 3 Pathological changes of the quail renal tissues(Urate staining)
表7 高蛋白高钙日粮对50 d鹌鹑血清炎性
2.4 鹌鹑血清炎性因子表达情况
由表7可见,实验第50天模型Ⅱ组鹌鹑血清炎性因子IL-1β和TNF-α水平显著性高于对照组(P<0.05),模型Ⅰ组鹌鹑血清IL-1β和TNF-α水平与对照组无显著差异。
2.5 造模期间鹌鹑血清肌酐、尿素氮水平
由表8和表9可见,与对照组相比,模型Ⅰ组血清尿素氮水平无显著性差异(P>0.05)。模型Ⅱ组鹌鹑于实验第30天、40天,血清尿素氮水平显著性高于对照组(P<0.05)。
表8 高蛋白高钙日粮对鹌鹑血清尿素氮水平的影响

表9 高蛋白高钙日粮对鹌鹑血清肌酐水平的影响
实验期间,与对照组相比,模型Ⅰ组血清肌酐水平无显著性差异(P>0.05);模型Ⅱ组鹌鹑于实验第40天、50天血清肌酐水平显著性高于对照组(P<0.05)。
3 讨论
3.1 高蛋白高钙摄食合并限制饮水诱导鹌鹑痛风的影响
实验研究表明实验期间对照组鹌鹑体重、日均采食量平稳上涨,一般状态良好。对鹌鹑肾组织切片进行尿酸盐染色(六胺银法),阳性反应时尿酸盐结晶被染成黑色,底色为粉红色。由图3可见,对照组鹌鹑肾组织未见黑色尿酸盐沉积。
模型Ⅰ组以高蛋白高钙日粮结合自由饮水干预鹌鹑。该组鹌鹑一般状态与对照组无明显差异,未见明显痛风症状。血清尿酸水平显著升高,同时粪尿尿酸水平显著降低。该组鹌鹑肾组织可见少量尿酸盐沉积于肾小管周围。因为鹌鹑肝缺少精氨酸酶,蛋白质只能通过嘌呤核苷酸循环生成嘌呤,而后在黄嘌呤氧化酶的作用下以尿酸作为代谢终产物排出体外[9]。以酵母浸膏作为高蛋白食饵饲喂鹌鹑,为尿酸的合成提供的更多的原料,引发鹌鹑高尿酸血症。鹌鹑具有特殊的生理结构,消化管、输尿管和生殖管末端汇合于泄殖腔,故鹌鹑粪尿排泄物中尿酸含量可反映鹌鹑排泄尿酸的能力,由于在血尿酸水升高同时粪尿尿酸水平降低,认为高蛋白高钙日粮对尿酸的排泄有抑制作用。肾是鹌鹑排泄尿酸的唯一通道,肾脏结构功能的改变直接影响尿酸排泄,长期处在高钙环境下会引起肾小球肿大、数量减少、肾小管急性细胞损伤等[10-11],因此认为高钙日粮的添加可能通过造成鹌鹑肾损伤进而抑制尿酸排泄。因此在实验期间内,鹌鹑摄食蛋白质含量为29.5%,钙含量为7.8%的高蛋白高钙日粮,可增加鹌鹑尿酸生成、减少排泄,导致鹌鹑高尿酸血症并有少量尿酸盐沉积于肾,未见明显痛风症状。
模型Ⅱ组鹌鹑摄食高蛋白高钙日粮结合限制饮水。鹌鹑体重、日均采食量平稳上涨,踝关节肿胀明显,部分鹌鹑出现懒动喜卧、跛足、足趾变型等痛风症状。限制饮水后,其血清尿酸水平极显著高于对照组,同时粪尿尿酸水平降低。炎性因子白介素-1β和肿瘤坏死因子α显著升高。病理切片染色后可见肾小管周围密布黑色尿酸盐沉积,沉积现象较严重。结合血清肌酐、尿素氮结果推测高蛋白高钙日粮结合限制饮水能导致鹌鹑肾损伤,这可能与肾小管大量尿酸盐沉积相关。以上结果表明该方法可诱导鹌鹑痛风。尿酸难溶于水而易于与血液中钙、钠离子结合形成尿酸盐,尿酸盐具有胶体性质在血液中受大量血浆蛋白保护而保持稳定性,但当血液中尿酸水平和钙离子水平过高时,产生大量尿酸盐使尿酸盐溶液的稳定性遭到破坏而发生沉积[12]。饮水量多少与高尿酸血症及痛风的发生率成反比,饮水量增加、尿量增加,有利于尿酸的排泄从而维持血尿酸浓度稳定。在机体相对缺水状态下,血液浓缩,会加剧血尿酸浓度升高;尿液浓缩,粪尿排泄量减少,抑制尿酸排泄加剧鹌鹑血尿酸水平的升高;当给鹌鹑摄入相同高蛋白高钙日粮时,限制饮水后能使鹌鹑血尿酸、血钙浓度更高,容易聚集在器官、关节等部位形成沉积,诱发痛风发作[13-14]。实验结果表明,与单纯给予高蛋白高钙日粮的鹌鹑相比,限制饮水之后能使鹌鹑血尿酸水平更高、粪尿尿酸水平更低、肾脏尿酸盐沉积更显著,证实限制饮水量之后对鹌鹑尿酸排泄抑制作用更明显,促进尿酸盐沉积作用更显著,可见足够的饮水量有助于减缓尿酸盐沉积,减少痛风的发生。匡红艳等[15]对鸡饲喂高钙日粮、高蛋白日粮、高蛋白高钙日粮并限制饮水7周,而后改为正常自由饮水,通过对比同一组鸡限制饮水前后病理改变也证实限制饮水能导致血尿酸水平升高更显著,与本实验结果相一致。
作者前期通过给鹌鹑饲喂含有一定比例酵母浸膏粉和石粉的高蛋白高钙日粮拟诱导鹌鹑痛风[16],但实验结果表明该方法对鹌鹑状态影响较大,导致鹌鹑一般状态差甚或死亡的现象,且造模不稳定,仅有部分鹌鹑出现关节肿大等症状。而本实验所造模型较稳定,从踝关节周径可知模型Ⅱ组鹌鹑踝关节肿大,从血尿酸水平及肾脏尿酸盐沉积可知模型Ⅱ组血尿酸升高更显著、尿酸盐沉积程度更明显。因此,当给予鹌鹑高蛋白高钙日粮并同时限制饮水时可诱发鹌鹑痛风。
3.2 鹌鹑痛风模型研究的思考
痛风是长期嘌呤代谢障碍、血尿酸增高引起组织损伤的一组异质性疾病。随着社会经济的发展和人民生活水平的提高,国民饮食中蛋白质、嘌呤含量的增加,高尿酸血症和痛风的发病率呈上升趋势,且呈年轻化趋势,与多种疾病相关,其发病机理及治疗方法的研究成为人们的关注点。建立理想的痛风动物模型是痛风病的病理机制与药物筛选研究的基础,国内外学者对此进行了长期的研究,目前已有多种用于研究痛风的动物模型,但至今尚无符合人类痛风发病特点、能反应其病理过程的动物模型,虽然有些灵长类与人类代谢过程十分接近,但在实际情况下,由于条件限制,很难在大规模实验研究中使用。禽类动物痛风与人类痛风具有高度的相似性,若以禽类作为模型动物研究建立禽痛风模型,对人类尿酸盐沉积造成的病理损伤、痛风的发病机制及治疗药物筛选研究具有重要意义。
以高蛋白高钙日粮塑造的鹌鹑痛风实验模型与人类痛风具有较高的相似性:① 发病原因的相似性。禽类动物痛风与人类痛风均由尿酸生成增多或尿酸排泄减少导致尿酸盐沉积而引起[17]。均受遗传、饮食、环境等因素影响,当富含蛋白质、嘌呤等食物摄入过多可引起尿酸生成增多进而易以钠盐、钙盐等形式沉积,形成痛风。② 临床表现上的相似性。在临床表现上,尤其是禽类关节型痛风与人类痛风极为相似,均表现为关节肿胀,且疼痛肿胀多发生于末梢关节,如足趾关节、趾前关节,也可侵害腕关节、腕前关节等处。③ 病理基础的相似性。禽类与人类均缺少尿酸酶,无法像大多数哺乳动物那样将嘌呤代谢为可溶性尿素排出体外,均以尿酸为代谢终产物,尿酸难溶于水而易于以尿酸盐的形式沉积形成痛风。并且禽痛风是一种常见禽病,有较高的发病率和死亡率,因此本实验欲参照禽痛风的发病规律建立有效、简便、稳定、经济的禽痛风模型。
鹌鹑具有体型较小、易于操作,节省空间、适合大规模饲养,价格低廉等优势。本实验通过模拟临床高蛋白高钙饮食,合并限制饮水,成功诱导出鹌鹑痛风,证明该方法塑造鹌鹑痛风动物模型。但目前实验塑造的鹌鹑痛风模型尚不稳定,仍需要在操作方法、造模剂种类及剂量的筛选上进一步研究。其次鹌鹑尚未建立微生物控制标准及分级,这在一定程度上阻碍了禽类模型的应用[16]。因此对鹌鹑痛风模型的塑造还需要进一步研究。
致谢衷心感谢导师张冰教授和指导组林志健老师对我的研究思路、实验操作以及论文撰写给予的指导和帮助!衷心感谢本课题组李高玺、王雨、白云飞、李凡等同门们在实验方面给予我的帮助!感谢父母家人对我的关心、支持和理解!
