二甲双胍与有氧运动对2型糖尿病大鼠血管氧化应激的影响
2019-04-28冯丽洁
冯丽洁,李 俊
(南京信息工程大学体育部,南京 210044)
血管并发症是糖尿病致残、致死的主要原因,动脉粥样硬化是引起血管并发症的直接原因。研究显示,氧化应激在血管损伤及动脉粥样硬化形成过程中发挥关键的作用[1]。糖尿病状态下高血糖和脂质代谢紊乱对血管内皮的损伤主要是通过氧化应激实现的。因此,降低氧化应激对防止血管内皮损伤,预防和治疗血管并发症具有十分重要意义。
目前对糖尿病的临床治疗主要以控制血糖为主,二甲双胍是治疗2型糖尿病最常用的双胍类药物,具有降低血糖,改善胰岛素抵抗,降低氧化应激等作用[2]。除了临床干预外,生活方式改变尤其是运动已被认为是预防和治疗2型糖尿病的推荐方法。规律性有氧运动可以调节血糖代谢,提高机体抗氧化能力,降低慢性炎症,对心血管具有保护作用[3],但其作用效果还并不十分明确。本研究拟通过对2型糖尿病大鼠进行8周二甲双胍和有氧运动干预,评价二甲双胍、有氧运动及两者联合干预对2型糖尿病大鼠血管氧化应激的影响。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠,6周龄共46只,体重220~270 g,由吴氏实验动物中心提供[SCXK(闽)2012-0001],饲养在福建师范大学实验动物中心[SYXK(闽)2015-0004]。环境温度:22oC ~24℃,湿度:50%~70%,光照:12 h∶12 h。大鼠分笼饲养,自由饮食。随机抽取6只作为正常对照组,并给予正常饲料喂养,其余大鼠用于制作2型糖尿病模型。实验过程按照实验动物的使用3R原则给予人道主义关怀。
1.2 主要试剂与仪器
二甲双胍(上海生工生物工程公司);胰岛素(insulin)、肿瘤坏死因子-α(TNF-α)和血管细胞粘附分子-1(VCAM-1)Elisa试剂盒(南京建成生物工程研究所);NADPH 氧化酶(nicotinamide adenine dinucleotide phosphate oxidase 4, NOX4)4抗体、GADPH抗体、核因子相关因子2(nuclear factor-e2-related factor 2, Nrf2)抗体、血红素氧合酶-1(heme oxygenase-1, HO-1)抗体(Abcam 英国);超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测试盒、总抗氧化能力(T-AOC)测定试剂盒(南京建成生物工程研究所)。低温高速离心机(Eppendorf 德国);血糖仪(罗氏 美国);凝胶电泳仪、转膜槽(Bio-Rad 美国);凝胶电泳成像分析仪(ProteinSimple美国);酶标仪(Tecan美国);分光光度计(Bio-Rad美国)。
1.3 实验方法
1.3.1 2型糖尿病模型构建
采用高脂饮食,小剂量链脲佐菌素(streptozotocin, STZ)诱导2型糖尿病模型。40只大鼠高脂饲料(15%蔗糖,15%猪油,5蛋黄粉,0.2%胆酸钠,64.8%基础饲料)喂养四周后,禁食12 h,腹腔注射STZ(溶于0.1 mol/L柠檬酸缓冲液;剂量30 mg/kg)[4-5],正常对照组注射相应容量的柠檬酸缓冲液。STZ注射2周后,空腹血糖值持续大于11.1 mmol/L,确定为2型糖尿病模型,最终符合糖尿病模型大鼠共32只。
1.3.2 实验分组
将大鼠分为5组:正常对照组(NC, n=6);糖尿病对照组(DC, n=7);糖尿病运动组(DS, n=9),有氧运动干预;糖尿病二甲双胍干预组(DM, n=7),进行二甲双胍处理;糖尿病二甲双胍+运动联合干预组(DMS, n=9),同时给予二甲双胍和有氧运动处理。干预时间共8周。
1.3.3 给药方法
二甲双胍溶入饮水中给予大鼠摄取,药物剂量参考已有的研究[6],第1周剂量为150 mg/(kg·d),第2周为300 mg/(kg·d),第3周调整为450 mg/(kg·d),该剂量一直保持到实验结束。监控大鼠体重和饮水量变化,每周根据体重变化调整一次药物剂量。
1.3.4 运动方案
运动组大鼠采用游泳运动方式,每天1 h,每周5 d,共8周。1~4周大鼠无负重进行游泳,5~8周负重1%体重(重物系尾部)。游泳池为圆形塑料桶(直径60 cm×高75 cm),水深不低于45 cm,水温控制在32℃~34℃,每桶同时容纳3只大鼠。时刻监控大鼠游泳状况,以防大鼠溺水。
1.3.5 样本制备
最后一次运动结束后24 h处死。血液样本以4℃, 3500 r/min离心10 min,取上清液,-20℃保存。迅速剥离主动脉,取小部分放入4%多聚甲醛中固定,其余放置-80℃冰箱中保存待用。
1.3.6 生化指标检测
大鼠禁食12 h后尾部取血,使用血糖仪和试纸检测大鼠血糖浓度。采用生物素双抗体夹心酶联免疫吸附法检测大鼠血清insulin、TNF-α和VCAM-1浓度。
1.3.7 病理标本制备
从固定液中取出主动脉组织,进行脱水、透明和石蜡包埋。组织切片4 μm,脱蜡复水、HE染色、脱水、透明、树胶封片,最后显微镜拍照。
1.3.8 大鼠血管组织SOD和MDA检测
将主动脉按1∶9比例加入生理盐水研磨制作组织匀浆液;然后采用BCA法测量匀浆液的蛋白浓度,最后按照试剂盒检测说明书进行操作,并根据公式计算出组织匀浆液SOD活性和MDA浓度。
1.3.9 Western blotting
先提取主动脉总蛋白并检测蛋白浓度。95℃加热变性后放入-80℃ 保存备用。制备分离胶和浓缩胶,上样,打开电源,直到溴酚蓝到达电泳槽底部。电泳完成后转膜1.5 h。转膜后5%脱脂奶粉封闭1 h, 4℃ 孵育过夜,洗膜,二抗室温孵育1 h,洗膜。ECL化学发光显色、拍照,并进行蛋白条带灰度检测。
1.4 统计学方法
2 结果
2.1 大鼠血糖代谢相关指标
图1显示了8周干预后大鼠血糖代谢指标变化。从图中看出,糖尿病大鼠空腹血糖(FBG)均显著高于正常组(P<0.01),其中DC组空腹血糖值最高,DM和DMS组大鼠空腹血糖显著低于DC组(P<0.01)。DC组空腹胰岛素(FINS)显著高于NC组(P<0.01),DS、DM和DMS组与DC组相比,空腹胰岛素有了明显的降低(P<0.01)。
2.2 大鼠主动脉血管形态
镜下观察显示8周干预后大鼠主动脉的结构形态(图2)。NC组大鼠主动脉内壁光滑,内皮细胞完整,平滑肌细胞排列整齐。DC组与NC组相比,血管内壁粗糙,内皮细胞破损相对严重,平滑肌细胞排列凌乱。DS、DM和DMS组血管内皮细胞具有一定程度的损伤,但与DC组相比,血管病变有所缓解,其中DMS组大鼠主动脉结构保持相对完整。

注:与NC组比较,aP<0.05, AP<0.01;与DC组比较,b P<0.05, BP<0.01。图1 大鼠空腹血糖和空腹胰岛素Note. Compared with the NC group, aP<0.05, AP<0.01;compared with the DC group,b P<0.05, BP<0.01.Figure 1 Fasting blood glucose and fasting insulin levels in the rats
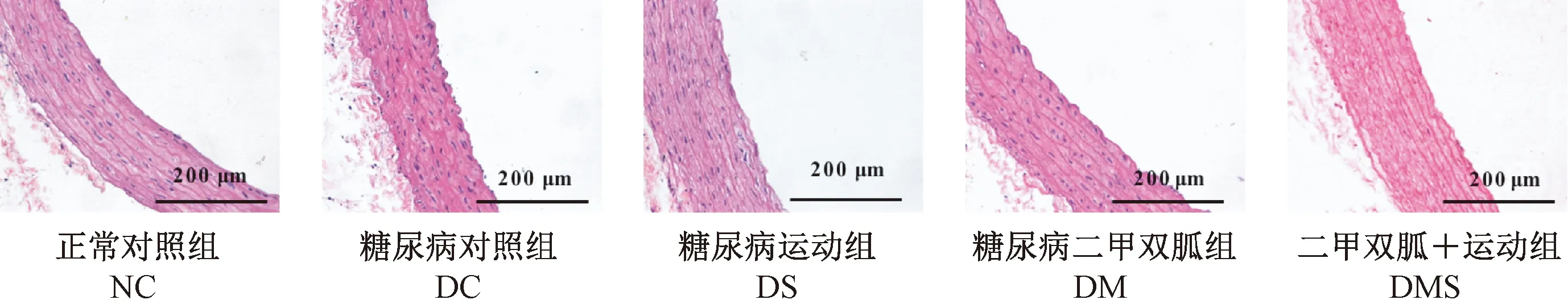
图2 大鼠主动脉的病理改变(HE染色,×200)Figure 2 Histological changes of the rat aortas(HE staining)
2.3 大鼠血管Nrf2、HO-1、SOD指标
图3显示了8周二甲双胍和有氧运动干预后大鼠血管抗氧化水平。从图A中可以看出,NC和DC组Nrf2蛋白表达较低,而DS、DM、DMS组表达显著性升高(P<0.01),给予二甲双胍处理的两个组Nrf2表达水平均高于DS组,其中DMS组与DS组相比,具有统计意义(P<0.05)。从图B中看出,DC组血管HO-1蛋白表达显著低于NC组(P<0.01)。三组干预组表达水平均显著高于DC组(P<0.01),DM和DMS组HO-1蛋白表达水平不仅高于DC组,而且还明显高于NC和DS组(P<0.01,P<0.05)。图C显示了大鼠血管SOD水平。DC组SOD水平最低,三个干预组SOD水平均高于DC组,其中DS和DMS组SOD水平与DC组相比具有统计性意义(P<0.05)。
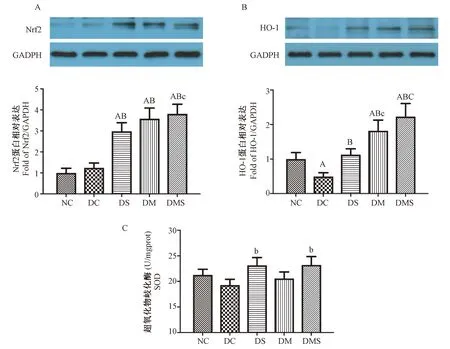
注:A:Nrf2蛋白表达;B:HO-1蛋白表达;C:SOD活性。与NC组比较,aP<0.05, AP<0.01;与DC组比较,bP<0.05, BP<0.01;与DS组比较,c P<0.05, C P<0.01。图3 大鼠主动脉组织中的Nrf2、HO-1蛋白表达和SOD活性Note. A, Protein expression of Nrf2; B, Protein expression of HO-1; C, Activity of SOD. Compared with the NC group, aP<0.05, AP<0.01. Compared with the DC group, bP<0.05, BP<0.01. Compared with the DS group,cP<0.05, CP<0.01.Figure 3 The expression of Nrf2 and HO-1 proteins and activity of SOD in the rat aorta tissues
2.4 大鼠血管NOX4和MDA指标
图4反映了糖尿病大鼠血管氧化水平。从图A中可以看出,糖尿病组血管NOX4蛋白表达水平均明显高于正常对照组(P<0.01,P<0.05),其中,DC组表达量最高。三组干预组NOX4表达水平均显著低于DC组(P<0.01),其中DM组最低,与DS组相比,有统计性差异(P<0.05)。从图B可以看出,DC组血管组织MDA水平明显高于NC照组(P<0.05)。8周干预后,DM组和DMS组血管MDA水平均显著低于DC组(P<0.05)。DS组MDA水平低于DC组,但没有统计学意义。
2.5 大鼠血清TNF-α和VCAM-1指标

注:A:NOX4蛋白表达,B:MDA浓度. 与NC组比较,aP<0.05, AP<0.01;与DC组比较,bP<0.05, BP<0.01;与DS组比较,c P<0.05,C P<0.01。图4 大鼠主动脉组织中的NOX4蛋白表达和MDA浓度Note. A, Protein expression of NOX4. B, Concentration of MDA. Compared with the NC group, aP<0.05, AP<0.01. Compared with the DC group, bP<0.05, BP<0.01. Compared with the DS group,cP<0.05,C P<0.01.Figure 4 Expression of NOX4 protein and concentration of MDA in the rat aorta tissues
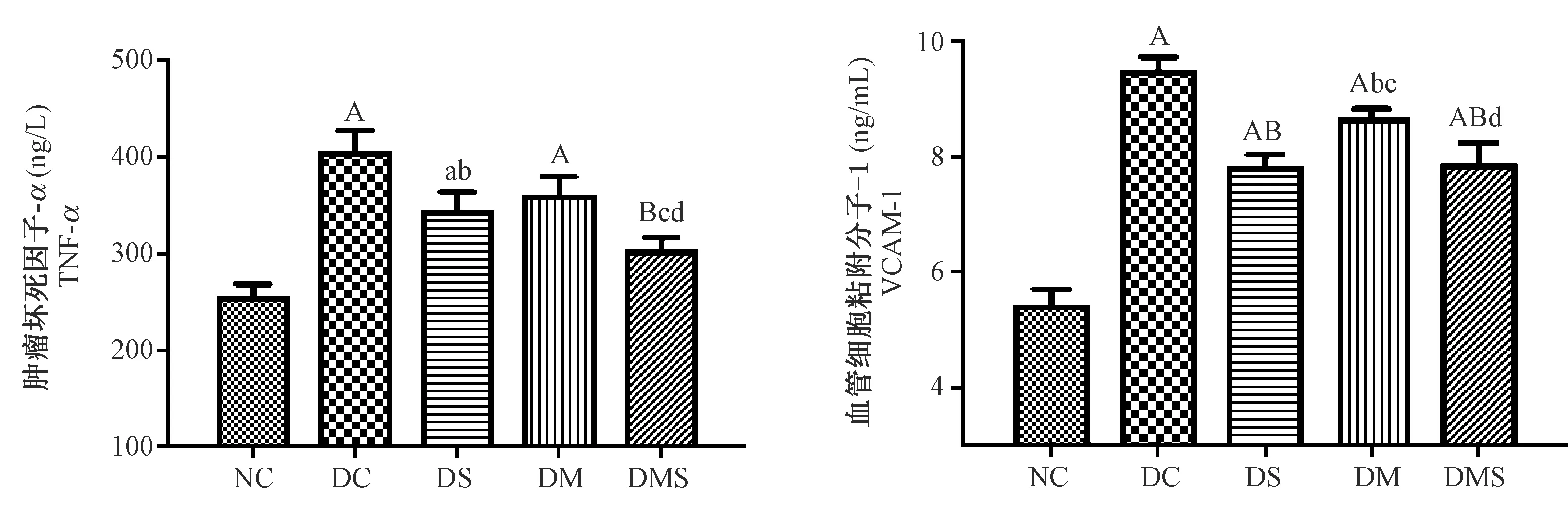
注:与NC组比较,aP<0.05, AP<0.01;与DC组比较,bP<0.05, BP<0.01;与DS组比较,c P<0.05,C P<0.01;与DM组比较,d P<0.05,D P<0.01。图5 大鼠血清TNF-α和VCAM-1浓度Note. Compared with the NC group, aP<0.05, AP<0.01. Compared with the DC group, bP<0.05, BP<0.01. Compared with the DS group,cP<0.05, CP<0.01.Figure 5 Serum concentrations of TNF-α and VCAM-1 in the rats
图5显示了大鼠血清炎症标志物度浓度水平。从图中可以看出所有糖尿病组TNF-α浓度均高于正常对照组,其中,DC组浓度最高。三个干预组TNF-α浓度都有下降的趋势,其中,DS组明显低于DC组(P<0.05),DMS组TNF-α浓度最低,并显著低于其他三个糖尿病组(P<0.05,P<0.01)。为了进一步了解主动脉血管炎症状态,对大鼠血清VCAM-1浓度进行了检测,糖尿病大鼠血清VCAM-1浓度明显高于正常对照组(P<0.01),其中DC组最高。DS、DM和DMS组VCAM-1水平都明显低于DC组(P<0.01,P<0.05),其中DS和DMS组水平明显低于DM组(P<0.05)。
3 讨论
大量的研究表明,有氧运动可以改善糖尿病患者胰岛素抵抗,降低血糖[7-10],美国糖尿病协会已将运动作为治疗糖尿病的推荐方法[11]。本实验研究结果显示,二甲双胍和有氧运动均可以降低糖尿病大鼠空腹血糖,但联合干预的控糖效果更为显著。二甲双胍主要是通过抑制肝脏糖异生作用,增加外周组织对胰岛素敏感性来控制血糖。有氧运动可以增加骨骼肌含量,促进骨骼肌对对血糖的吸收,除此之外,运动过程中肌源性IL-6浓度增加能够刺激GLUT4转运,促进外周组织对葡萄糖的吸收[12]。二甲双胍与有氧运动联合干预在降低胰岛素水平,提高胰岛素敏感性上的效果要优于单纯二甲双胍或有氧运动的治疗效果,说明二甲双胍和有氧运动可能分别通过不同的信号途径来提高胰岛素敏感性,从而使得联合干预在改善胰岛素敏感性具有叠加效应。
在脉管系统中,氧化应激与许多血管损伤的病理过程有关,过多的ROS能够导致血管发生紊乱。本实验研究显示,二甲双胍和有氧运动均能有效缓解糖尿病大鼠血管内皮损伤,这可能与降低血糖和血管氧化应激有关。NOX4是心血管系统中ROS最主要的来源之一,其主要表达在血管内皮细胞和平滑肌细胞[13]。在血管内皮细胞中,多种细胞应激包括血流切应力,糖基化蛋白,TNF-α等都可以上调NOX4表达,NOX4增加反过来损伤内皮细胞[14]。本实验研究显示,糖尿病对照组大鼠血管NOX4蛋白表达比正常组高达接近3倍的水平,MDA浓度也显著高于正常组。8周二甲双胍和有氧运动干预下调血管NOX4蛋白表达水平,同时MDA水平也同步下降,说明二甲双胍和有氧运动可能通过降低血管NOX4表达以及MDA水平来缓解血管氧化应激。二甲双胍同样具有抗氧化功能,Sato等[15]研究显示二甲双胍可以通过抑制NOX4来缓解肺纤维化的发展。但本实验研究数据发现,给予二甲双胍处理组大鼠NOX4表达明显低于运动组,而运动和联合干预也并没有比二甲双胍干预产生更好的效果,运动可能反而阻碍了二甲双胍的抗氧化效用。这是否与运动激活机体的氧化系统有关,这还需要进行进一步的实验研究。
Nrf2是维持细胞内氧化还原平衡的重要调节器,与内源性抗氧化反应元件(ARE)结合,促进下游NQO1、HO-1、SOD等抗氧化酶基因的表达[16]。除此之外,Nrf2还能通过其下游HO-1发挥对血管的保护作用。本实验研究显示,二甲双胍和有氧运动不仅上调糖尿病大鼠血管Nrf2蛋白水平,同时还增加了下游因子HO-1蛋白表达和SOD活性,说明二甲双胍和有氧运动可能激活糖尿病大鼠血管Nrf2/ARE信号通路。目前研究已经证明运动能够提高机体抗氧化能力,且许多研究认为运动的抗氧化效应可能是通过Nrf2实现的[17],本研究结果与之前研究较为相似。近年来许多报道显示了二甲双胍的抗氧化特性[18]。Zhou等[19]研究发现给予4周二甲双胍处理能明显上调胰岛素抵抗小鼠肝脏和骨骼肌Nrf2及NQO1和HO-1蛋白表达。因此,可以推测,二甲双胍与有氧运动可能通过激活Nrf2信号及下游抗氧化酶基因表达来增加糖尿病大鼠血管抗氧化能力。
氧化应激在许多疾病的发病机制中发挥重要的作用。糖尿病状态下长期高血糖诱导机体产生过多的ROS,损伤血管内皮细胞,同时激活相关炎症信号通路,促进VCAM-1和TNF-α等炎症基因的表达,促使血管发生病变[20-21]。研究数据显示,二甲双胍和有氧运动均能有效降低糖尿病大鼠血清TNF-α和VCAM-1浓度。VCAM-1主要表达于血管组织,是血管炎症的主要标志[22],说明二甲双胍和有氧运动能够缓解糖尿病大鼠血管炎症。近年来有证据表明,二甲双胍除了具有调节血糖平衡外,还能够降低炎症[23-24]。长期有氧运动能够促进肌源性IL-6的分泌,改善循环血液的抗炎环境[25]。二甲双胍与有氧运动的抗炎作用主要是通过降低氧化应激途径实现,这与上述的研究结果一致。
综上所述,二甲双胍和有氧运动能够调节糖尿病大鼠血糖代谢平衡,缓解糖尿病大鼠血管氧化应激和炎症反应。二甲双胍和有氧运动可能是通过激活Nrf2信号,增加下游抗氧化酶表达,抑制NOX4表达,降低ROS生成来降低糖尿病大鼠血管氧化应激。
