中药健脾益肺方对EAAT2表达的影响
2019-04-28李惠珍任展能李雅青杨碧莹杜宝新
李惠珍, 任展能, 李雅青, 杨碧莹*, 杜宝新
(1.广州中医药大学 第二临床医学院, 广州 510000;2.广东省中医院, 广州 510000)
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS),又名运动神经元病,是一种破坏性的神经退行性疾病,引起上、下运动神经元损害,运动功能丧失,最终导致患者死亡。目前该疾病病因未明,关于其发病存在较多假说,现阶段普遍接受的是谷氨酸介导的兴奋性神经毒性;JPYF方是广东省中医院脑病四科杜宝新主任团队研发治疗ALS的经验复方,本课题组数十年的前期临床研究发现,JPYF方从肺脾论之对ALS患者有改善疾病预后的趋势,一定程度上延缓疾病进展;前期的基础研究发现,JPYF方对ALS转基因小鼠起到延缓体重下降,延缓临床发病时间,延长生存期,改善运动能力的作用,但均未进一步阐明其分子生物学机制。近30年来,多数学者认为谷氨酸的兴奋性毒性是导致神经元退行性变性、死亡的核心内容[1]。谷氨酸是中枢神经系统含量最高、分布最广、作用最强的兴奋性神经递质,其合成、释放和回收均依靠谷氨酸转运体及其相关分子完成谷氨酸-谷氨酰胺这一循环[2]。EAAT2是清除突触间隙谷氨酸的主力军,在维持谷氨酸稳态和保护神经元起重要作用。研究发现,EAAT2的下调或功能失调,将引起多种神经变性疾病,如癫痫、AD、ALS等[3]。为进一步探讨谷氨酸兴奋性毒性在ALS发病机制中的作用,本研究拟通过观察JPYF方对谷氨酸诱导幼鼠皮层星形胶质细胞EAAT2的表达及对元代脊髓神经元的影响,探讨ALS的发病机制及JPYF方的作用机理。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
孕14~16 d SPF级SD母鼠(15只),体重290~350 g,由南方医科大学实验动物中心提供[SYXK(粤)2013-0094],待产,取新生24 h内幼鼠以提取大脑皮层星形胶质细胞;取胎鼠以提取脊髓神经元。无菌手术在广东省中医院科学院动物实验中心生物安全柜进行[SCXK(粤) 2013-0002]。本实验由广东省中医院动物伦理中心审核动物伦理:伦理编号2017039。
1.1.2 JPYF方组成及冻干粉制备
黄芪30 g,党参15 g,云苓10 g,白术15 g,五味子10 g,菟丝子10 g,麦冬10 g,陈皮5 g,法夏6 g,制马钱子0.2 g,甘草6 g等均来自本院中药房,购于康美药业。双蒸水(没过药物)浸泡3 h,煮沸1 h,10层纱布过滤,收集滤液;再加双蒸水(没过药渣),煮沸40 min,10层纱布过滤后合并滤液,滤液回旋冷凝浓缩,收集浓缩液,冷冻干燥得冻干粉,以两剂生药(222.4 g),制得206.2 g冻干粉;-80℃保存,备用。体外实验药液配制:称取1 g中药冻干粉加入20 mL无血清DMEM/F12培养基中,配置浓度为50 g/L的母液,震荡至完全溶解,0.22 μm针头滤器过滤,4℃保存备用,每次母液使用周期不超过1周。
1.2 主要试剂与仪器
NeurobasalTMMedium培养基、谷氨酰胺、多聚赖氨酸(10888022、25030081、P1399)购自SIGMA;B-27(17504044)购自LIFE;FBS(1600044)购自GIBCO;马血清(SH30074.03)购自Hyclone;GFAP、EAAT2、ChAT抗体(ab7260、ab41621、ab18736)购自Abcam;NEUN抗体(MAB377)购自Chemicon millipore公司;谷氨酸试剂盒(A074)购自南京建成;培养基A配制:89% DMEM/F12+10% FBS+1%双抗;培养基B配制:90% DMEM/F12+5% FBS+4%马血清+1%双抗;培养基C配制:96.5% NeurobasalTM+2% B27+1%谷氨酰胺+0.5%双抗。
冷冻干燥机ALPHA2-4/LSC(德国 Martin Christ公司); Countstar 型细胞计数仪 (美国 Inno-Alliance Biotech 公司);多功能酶标仪Victor X5(美国Perkin Elme公司);奥林巴斯光学显微镜SZ61(日本Olympus光学工业株式会社);TS-1000 型脱色摇床(其林贝尔仪器制造有限公司)。
1.3 实验方法
1.3.1 星形胶质细胞、神经元原代分离、提取与培养
取新生24 h内SD幼鼠,断头处死,仔细提取大脑皮质组织;胰酶+DNA酶消化20 min,取上清经200目细胞筛过滤,重复3次;收集滤液,离心,悬液;差速贴壁30 min,取上清,重悬后调整密度到1×106/mL,于含有培养基A的培养瓶中培养,每3 d换液。培养至10 d左右将细胞至于37℃恒温摇床24 h,去除小胶质细胞及其他杂质细胞,收集纯化细胞传代备用。
取胎龄16天的SD孕鼠,麻醉、消毒,立即取出串珠样子宫放入预冷培养基B中;参考上述步骤取胎鼠脊髓,调节密度1×105/mL,每孔0.1 mL接种到96孔板,每孔7×105接种于6孔板细胞爬片上(取材前一天用50 μmol/mL多聚赖氨酸包被4 h,晾干,PBS洗3次后烘干备用),2 h后补足培养液,4~6 h后更换培养基C;之后每3 d半量换液。
1.3.2 IF法鉴定星形胶质细胞、神经元
收集对数生长期的星形胶质细胞种板于共聚焦培养皿中(或培养至6~7 d的神经元细胞爬片),次日PBS摇洗3次,每次10 min,4%多聚甲醛固定,0.3%曲通室温通透20 min,摇洗,10%山羊血清室温封闭60 min;一抗(星形胶质:GFAP (1∶1500);神经元:ChAT(1∶500))4℃过夜;复温,摇洗后,加入对应种属二抗(FITC(1∶200)和cy3(1∶300))37℃孵育1 h;DAPI染核5 min,摇洗;风干,滴加荧光淬灭剂,晾干后共聚焦显微镜下观察。
1.3.3 MTT法检测星形胶质细胞活力
调整星形胶质细胞密度每孔1×104接种于96孔板,24 h后,吸去培养液,加入含JPYF方的培养液A预处理24 h(终浓度0.25、0.5、1 g/L) 分别为B、C、D组, PBS冲洗后处理同A组;谷氨酸(A)组:加入含谷氨酸培养液(250 μmoL/L培养4 h;对照(E)组:正常培养相应时间的星形胶质细胞,每组均6个复孔。药物作用足够时间后,去培养液,加入每孔110 μL含5% MTT的培养基,4 h后,吸去培养基加入每孔150 μL DMSO,震荡混匀10 min,570 nm 波长检测吸光度A,按照以下公式:细胞存活率=(A加药组-A空白组) /(A正常组-A空白组) ×100%计算细胞活力。
1.3.4 IF法检测EAAT2的荧光强度
将星形胶质细胞每孔2万接种于共聚焦培养皿,48 h后,分组处理同MTT法,药物作用时间足够后,进行IF法检测,(一抗EAAT2 (1∶500)),二抗(cy3(1∶500))。
1.3.5 Western blot法检测EAAT2蛋白的表达
将星形胶质细胞以每孔5×105接种于6孔板,分组处理同MTT法。药物作用时间足够后,吸去原培养液,PBS冲洗2次,每孔加入30 μL裂解液,充分裂解,刮板,收集裂解液,涡旋离心取上清,BCA测蛋白浓度,按每孔40 μg蛋白样品,加入10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中电泳,转膜,5%牛奶封闭60 min,洗净封闭液,加入一抗(1∶1000)4℃过夜。次日加入二抗(1∶2000)孵育60 min。在PVDF膜上加入适量ECL显影液,用Image Lab显影成像并进行数据分析。
1.3.6 紫外比色法测定谷氨酸浓度
将星形胶质细胞以每孔5×105接种于6孔板,分组处理同MTT法。药物作用时间足够后,收集各组上清培养液;严格按照谷氨酸试剂盒操作方法,取各组上清液、双蒸水、谷氨酸标准应用液各50 μL于96孔板,每组6个复孔,加入按比例配置好的工作液150 μL,混匀,340 nm 波长检测各孔吸光度A1,每孔加入2 μL配置好的试剂五,充分混匀后,37℃孵育40 min,340 nm 波长检测各孔吸光度A2;按照以下公式:谷氨酸浓度(μmol/L)=(测定A2值-测定A1值)-(空白A2值-空白A1值)/(标准A2值-标准A1值)-(空白A2值-空白A1值)*标准品浓度(200 μmoL/L)*样品测试前稀释倍数。
1.3.7 IF法检测神经元存活情况
取各组培养基上清作用于培养至6~7 d的神经元,培养4 h后,按IF法检测各组神经元存活情况。
1.4 统计学方法
采用SPSS 23.0统计学软件先进行方差分析和齐性检验,当满足正态分布及方差齐性时,采用单因素方差分析;若不满足采用非参数检验。以P<0.05为差异有统计学意义,所有指标至少重复3次。
2 结果
2.1 IF法鉴定原代星形胶质细胞和神经元细胞
传至第三代的星胶细胞,核呈圆球形常位于中央,胞突丰富,分支长而多,细胞之间联系紧密;运用GFAP特异性染色,FITC标记成绿色所占DAPI核染比例为96%以上,结果见图1。
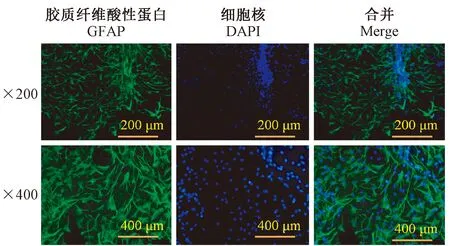
图1 荧光镜下观察、鉴定原代星形胶质细胞(IF, × 200,×400)Figure 1 Observation and identification of primary astrocytes under a fluorescence microscope
培养至6 d的脊髓神经元,细胞数量稳定,核大而圆,胞体饱满,立体感强,折光性好,突起细长,各细胞之前有聚集生长趋势,轴突紧密联系,Cy3标记红色所占DAPI核染比例为90%以上,结果见图2。
2.2 MTT法检测星形胶质细胞活力
与正常组比较,谷氨酸造模组细胞存活率明显降低(P<0.01),与造模组比较,不同浓度的JPYF方预处理组差异均具有统计学意义(P<0.01),并在0.25~1 g/L浓度范围内呈浓度依赖,详见表1、图3。

图2 荧光镜下观察、鉴定原代神经元细胞(IF, × 200)Figure 2 Observation and identification of primary neuronal cells under a fluorescence microscope

表1 不同分组星形胶质细胞存活率
注:与正常组比较,bP<0.01;与模型组比较,dP<0.01。
Note. Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.

注:与正常组比较,bP<0.01;与模型组比较, dP<0.01。图3 谷氨酸对星形胶质细胞活力的影响Note.Compared with the normal group, bP<0.01. Compared with the model group, dP<0.01.Figure 3 Effect of glutamate on the astrocyte viability
2.3 EAAT2蛋白表达情况
2.3.1 IF法检测EAAT2蛋白荧光强度
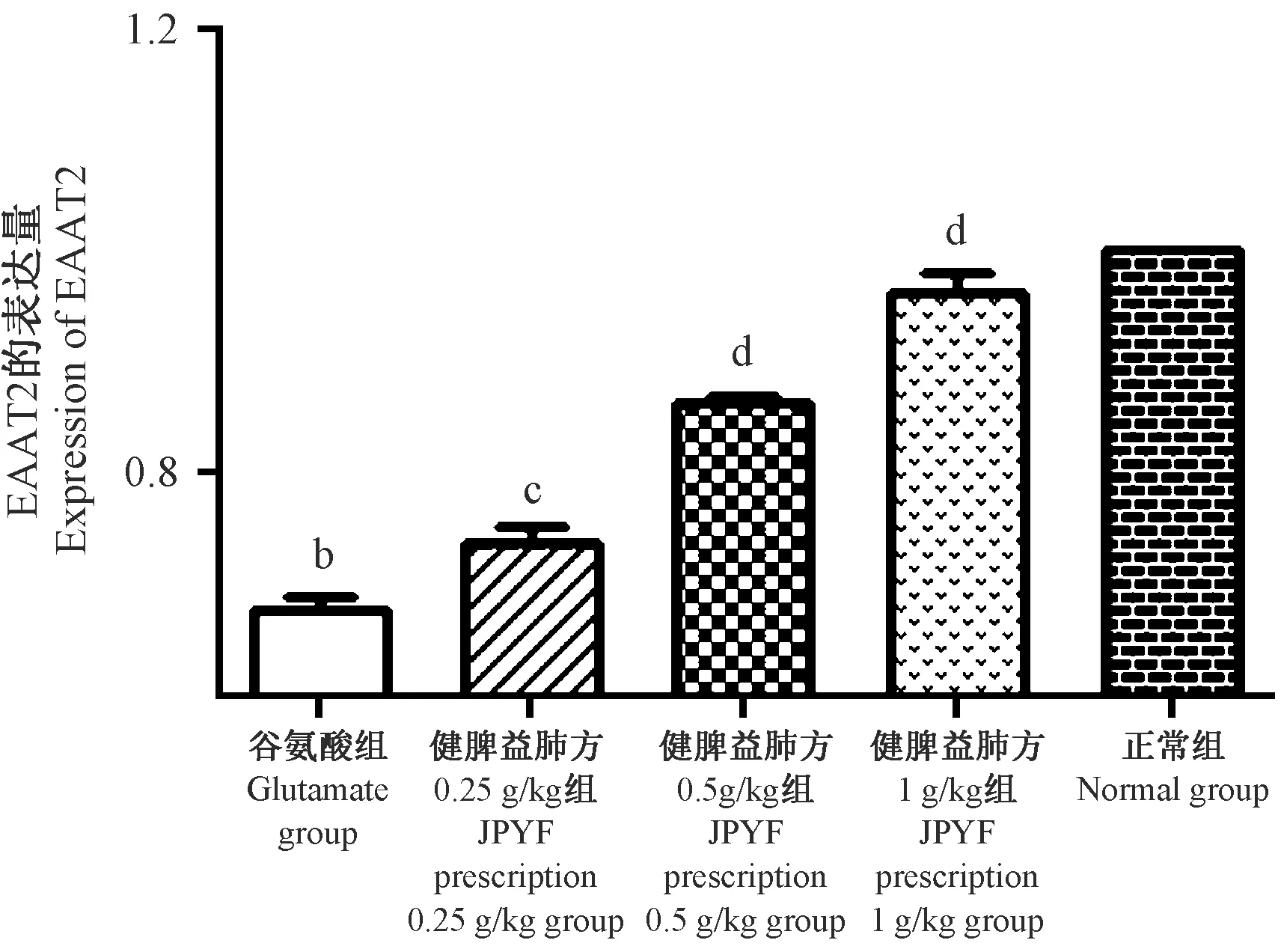
与造模组比较,不同浓度JPYF方预处理组蛋白荧光强度比差异均具有统计学意义(P<0.05,P<0.01),提示JPYF方可增加EAAT2蛋白的表达。详见表2,图4。
2.3.2 Western blot法检测EAAT2蛋白表达
JPYF方预处理24 h,谷氨酸作用4 h后,对照组EAAT2蛋白有一定基础表达,JPYF方组从0.25 g/L开始,随着浓度增加,EAAT2蛋白表达依次提高,差异均具有统计学意义(P<0.01),提示JPYF方可提高EAAT2蛋白水平。详见图5、图6。
2.4 各组星形胶质细胞培养基上清谷氨酸浓度测定
与谷氨酸组比较, JPYF方预处理组上清谷氨酸浓度随JPYF方浓度增高而下降,差异具有统计学意义(P<0.05,P<0.01),但均高于正常组。详见表3、图7。

表2 IF法检测EAAT2蛋白荧光强度
注:与正常组比较,bP<0.01;与模型组比较,dP<0.01。
Note. Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.

图4 荧光镜下观察各组EAAT2蛋白表达Figure 4 Expression of EAAT2 protein in each group was observed under a fluorescence microscope
注:与正常组比较,bP<0.01;与模型组比较,cP<0.05, dP<0.01。图5 Western blot法检测EAAT2蛋白表达水平Note. Compared with the normal group,bP<0.01.Compared with the model group,cP<0.05, dP<0.01.Figure 5 Determination of EAAT2 protein expression levels by Western blotting
2.5 各组星形胶质细胞培养基上清对原代脊髓神经元细胞的影响
与造模组比较,不同浓度JPYF方预处理组神经元存活个数差异均具有统计学意义(P<0.05,P<0.01),提示健脾益肺方可提高EAAT2活性及蛋白水平,降低细胞外液谷氨酸含量,减少谷氨酸兴奋性毒性,从而保护神经元。详见表4、图8。
3 讨论
本课题组结合自身临床经验及查阅ALS相关古籍发现该病以肺脾两虚为主者居多,中医认为“脾主肌肉,主四肢”,“肺主气,司呼吸”, 脾为肺之母,肺为脾之子,故参考《脾胃论》补中益气汤和《备急千金要方》补肺汤自拟治疗ALS的经验方;JPYF方以黄芪、党参为君,补益肺脾之气缓解临床出现肢体肌无力、肌萎缩,气短的患者,臣以白术、茯苓、麦冬补脾气而生肺气;佐以健脾理气化痰之陈皮、
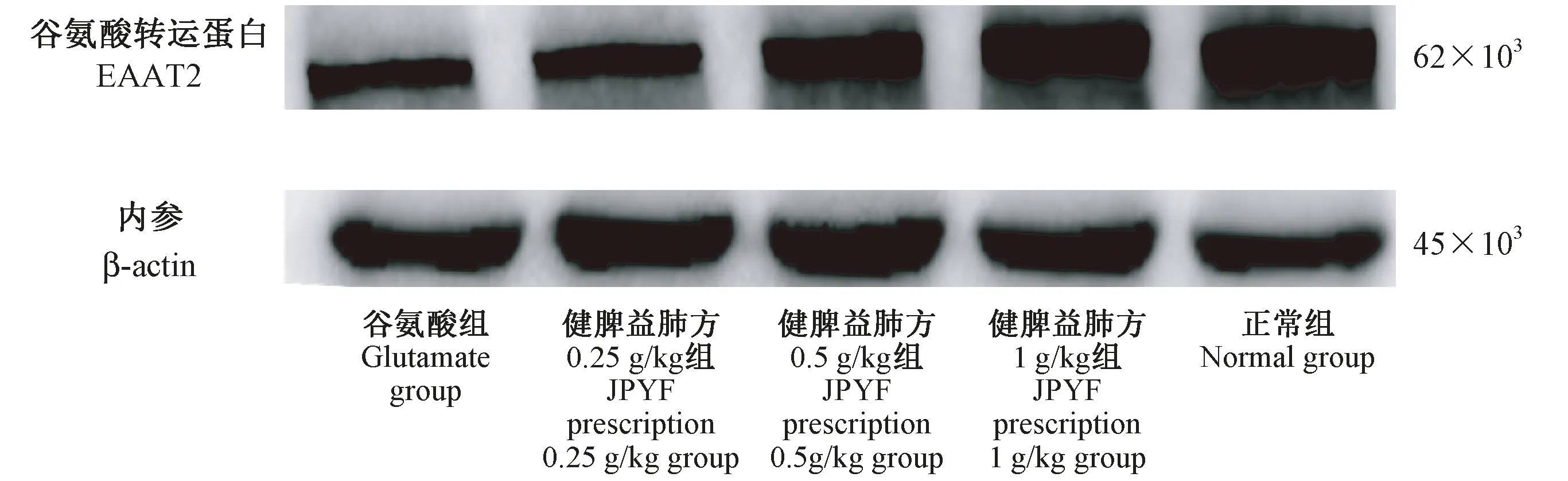
图6 星形胶质细胞EAAT2蛋白的表达Figure 6 Expression of EAAT2 protein in the astrocytes
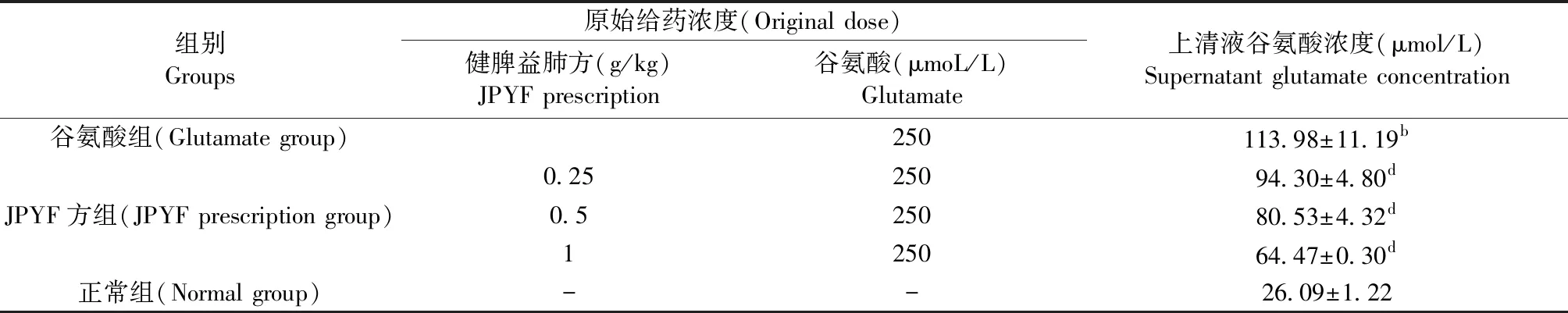
组别Groups 原始给药浓度(Original dose)健脾益肺方(g/kg) JPYF prescription谷氨酸(μmoL/L)Glutamate 上清液谷氨酸浓度(μmol/L)Supernatant glutamate concentration 谷氨酸组(Glutamate group)250113.98±11.19b0.2525094.30±4.80dJPYF方组(JPYF prescription group)0.525080.53±4.32d125064.47±0.30d正常组(Normal group)--26.09±1.22
注:与正常组比较,bP<0.01;与模型组比较,dP<0.01。
Note.Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.
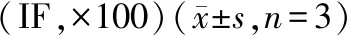
表4 荧光镜下观察不同原始给药浓度组上清液对脊髓神经元细胞影响
注:与正常组比较,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
Note.Compared with the normal group,bP<0.01. Compared with the model group,cP<0.05,dP<0.01.
法夏,使补而不腻,射干、杏仁宣肺利咽、开音散结,马钱子健脾益气,强肌,诸药合用,已达健脾补肺强肌之效,前期临床及基础研究多有见效[4-6];现代研究证明,中药可减轻谷氨酸兴奋性毒性,黄芪可明显改善谷氨酸损伤后细胞的活性[7],黄芪益母草注射液、人参皂甙R均可减轻神经兴奋毒性[8-9]。
肌萎缩侧索硬化是一种主要累及上、下运动神经元的进行性致死性神经变性疾病,病变主要损害脊髓前角细胞、脑干运动神经元,临床表现为进行性加重的肌萎缩、无力,80%~90%的患者于发病后3~5年因呼吸衰竭死亡[10]。目前该病发病机制尚不清楚,有学者发现ALS 患者血浆和脑脊液中谷氨酸水平较正常人高[1],在 ALS 模型小鼠的脊髓中也发现谷氨酸水平升高的情况[11],认为ALS的发病与谷氨酸兴奋性毒性密切相关。谷氨酸是中枢神经系统中主要的兴奋性神经递质,胞外谷氨酸的代谢再循环只能依靠谷氨酸转运体(EAATs)来完成,EAATs分子的作用是通过再摄取来调节胞外谷氨酸的浓度,并因此保持胞外静息状态1~3 μmol/L的谷氨酸浓度[12]。EAAT2 是脑内兴奋性氨基酸转运体中最主要的转运蛋白,负责中枢神经系统90%的谷氨酸再摄取,其表达主要在星形胶质细胞胞膜上[13]。研究发现通过翻译活化提高EAAT2表达,可以保护培养的神经元免受谷氨酸介导的兴奋毒性损伤和死亡,延迟ALS动物模型运动功能的下降和延长其寿命[14]。Rothstein等表示在ALS患者的尸解中谷氨酸盐的功能性运输减少和EAAT2免疫反应性降低[15-16],并且转基因小鼠中EAAT2的消耗会直接导致神经元死亡[17]。Chen等组合编码EAAT2、GDH2和NRF2的慢病毒三者协同作用可延缓ALS转基因小鼠的疾病发展及改善小鼠运动功能和神经科量表评分[18]。
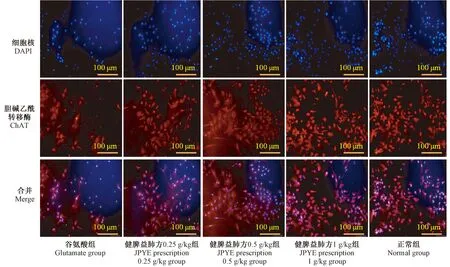
图8 上清液处理后脊髓神经元存活情况Figure 8 Survival of the spinal cord neurons after supernatant treatment
因此,本课题组不断从转运体的角度研究能够调节谷氨酸水平的方药,提高谷氨酸转运体的表达并维持其功能,从而有利于神经元的保护。通过建立谷氨酸诱导的体外星形胶质细胞损伤模型探索JPYF方对谷氨酸转运蛋白-2(EAAT2)表达的影响及可能机制。结果发现,JPYF方在一定范围内可显著保护星形胶质细胞,提高谷氨酸转运蛋白2的表达,降低细胞外液谷氨酸浓度,减少神经元损害;然而,在实验中发现,在诱导体外星形胶质细胞损伤模型时,给予人体正常胞外水平的谷氨酸浓度并不能成功建立星形胶质细胞损害模型,与正常组比较,细胞存活情况、形态及EAAT2的表达与正常组比较均无显著差异,这与相关文献报道提示突触传递过程中,囊泡释放的Glu可使突触间隙的浓度由静息的1 μmoL/L升高到1.1 mmol/L,而维持在此峰值的时间仅约为1.2 ms相符合[19];故研究人员筛选出适合本课题组实验的最佳给药时间4 h及浓度250 μmoL/L;星形胶质细胞和神经元细胞均表达摄取谷氨酸的载体,星形胶质细胞的摄取是清除突触间隙谷氨酸的主要途径,只有当谷氨酸溢出时,神经元的谷氨酸载体才发挥作用,引起谷氨酸兴奋性毒性;本课题组在检测培养基上清谷氨酸浓度时发现正常组谷氨酸浓度高于体内正常胞外静息状态水平,这可能与基础培养基谷氨酸水平含量相关,而该浓度仍在溢出浓度之内。
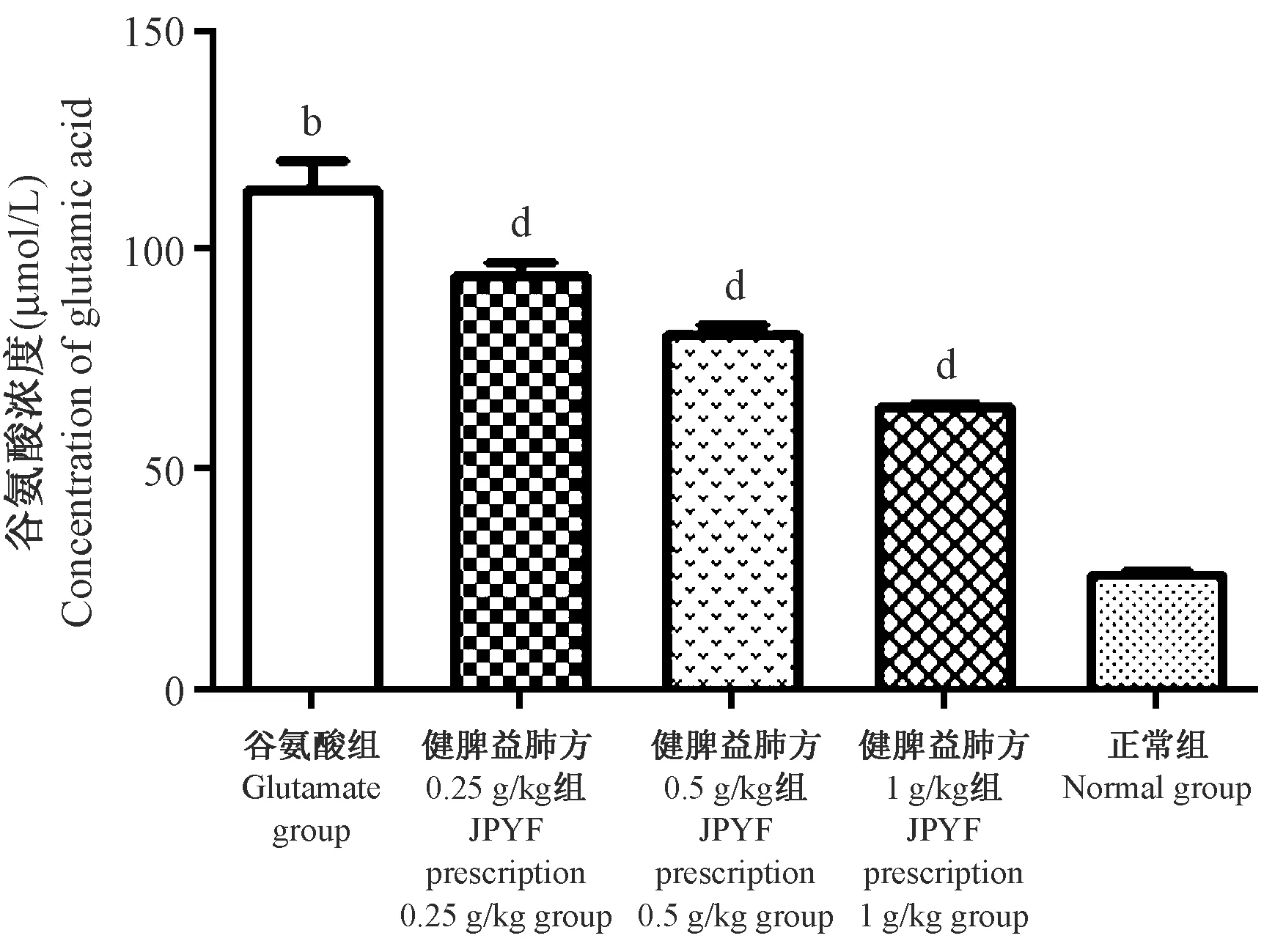
图7 紫外比色法检测各组培养基上清谷氨酸浓度Figure 7 Concentrations of glutamic acid in each medium determined by UV colorimetric assay
综上所述,JPYF方(0.25~1 g/L)呈浓度依赖的增加谷氨酸诱导的星形胶质细胞膜上EAAT2蛋白水平,降低谷氨酸浓度,保护培养的神经元免受谷氨酸介导的兴奋毒性损伤和死亡。在今后的实验研究中,本课题组将会深入探索健脾益肺方对ALS的作用机制,期望研究成果为临床应用提供理论与实验基础,为ALS患者的综合治疗提供新的选择。
