抑制巨噬细胞Act 1表达对黑色素瘤肺转移的影响
2019-04-28黎冰林王丽京杨永霞
王 佳,李 丽,黎冰林,卢 鑫,王丽京,杨永霞
(1.广东药科大学 生命科学与生物制药学院,广州 510006; 2.广东药科大学 医药信息工程学院, 510006)
黑色素瘤是高度恶性的肿瘤,在肿瘤发生的早期就会发生远端转移[1]。在我国,虽然黑色素瘤的发生率较低,但其远处转移预后很差,5年生存率低于5%[2]。侵袭与转移是恶性肿瘤最显著的生物学特征,在肿瘤的治疗过程中,阻止肿瘤细胞的侵袭与转移尤为重要,这也是治疗肿瘤成败的关键因素。小鼠黑色素瘤细胞B16-F10具有高转移特性,已被广泛地用于研究肿瘤发生、转移过程的相关参数,是研究肿瘤侵袭转移的理想模型[3]。
越来越多的研究表明,机体体内微环境的改变与肿瘤的发生与发展密切相关[4-5]。TAM (肿瘤相关巨噬细胞)被认为是肿瘤发生、发展和侵袭、转移最为重要的细胞之一[6]。近几年来的研究发现,TAM可以分泌多种炎症因子、生长刺激因子、蛋白水解酶和一些细胞因子[7],这些因子既能降解肿瘤细胞外基质,还能促进肿瘤中血管的形成[8]。TAM可构成实体瘤细胞群体的50% ~ 80%,TAM浸润与乳腺癌、结直肠癌、肝癌、宫颈癌和肺癌的不良预后密切相关[9]。NF-κB活化因子1(NF-κB activator 1,Act 1)在机体免疫反应的作用极为广泛,是NF-κB和C/EBP介导的炎症反应下游信号通路的重要分子[10]。而NF-κB 在炎症、先天免疫和癌症中起着至关重要的作用[11],且NF-κB信号通路能促进癌细胞的生长和生存[12]。已有文献表明NF-κB信号通路与肿瘤相关,且都强调了这种转录因子在癌症研究中的重要性[13]。Act 1主要介导IL-17信号通路的活化并参与炎症反应。Welte等研究发现,IL-17能够促进乳腺癌的发生与发展[14]。此外已有研究发现,通过IL-17B/IL-17BR信号传导,能够促进人的骨髓干细胞与乳腺癌肿瘤细胞的转移[15]。Act 1的缺少会抑制IL-17诱导的NF-κB通路被激活[16]。且通过小鼠过敏性哮喘模型发现,上皮细胞中Act 1的缺失能减轻IL-25引起的Th2型免疫反应和肺部炎症[17]。
鉴于NF-κB信号能够促进癌细胞的生长,且巨噬细胞与肿瘤的发生与发展密切相关。目前,Act 1在肿瘤中的作用研究很少。因此,本研究以巨噬细胞Act 1表达被靶向抑制的小鼠(anti-Act 1)为研究对象,采用尾静脉注射B16-F10细胞,诱导小鼠肺转移模型,探讨巨噬细胞Act 1在肿瘤转移过程中的作用。
1 材料和方法
1.1 实验材料
Anti-Act 1小鼠构建于C57BL/6背景,由中国科学院上海细胞生物学研究所构建并赠送[18]。6~8周龄雄性C57BL/6小鼠24只(体重18~22 g)从广东省医学实验动物中心[SCXK(粤)2013-0002]购买,饲养于广东药科大学SPF级动物中心[SYXK(粤)2017-0125]。所有的动物实验都是按照中国动物实验指南及其他相关国际准则进行的实验[动物福利伦理审批号:gdpulac2017026]。小鼠恶性黑色素瘤B16-F10细胞系(B16,ATCC,CCL-247)从密歇根大学耿建国实验室获得。
1.2 实验方法
1.2.1 实验动物anti-Act 1小鼠的鉴定
剪取anti-Act 1小鼠的尾部,提取DNA,PCR扩增目的片段基因,PCR引物1:5′-CTG GTG CAG ACA GCC TAG CTG-3′,引物2: 5′-CCT GCG AGC TAAAGT CCT GGA-3′ (Invitrogen),基因扩增产物条带为250 bp。对基因鉴定为阳性的小鼠,提取腹腔巨噬细胞,采用Western blot法检测巨噬细胞上Act 1的表达情况。化学发光显影仪避光显影和拍摄。实验所用抗体为Act 1 (Santa Cruz)、β-actin(Bioworld)。
1.2.2 细胞培养
小鼠恶性黑色素瘤B16-F10细胞系(B16,ATCC,CCL-247)在DMEM培养基(10%胎牛血清、200 mg/mL链霉素和200 U/mL青霉素),温度37℃,5% CO2/95%的培养箱中维持生长。
1.2.3 体内肺转移模型的建立
C57BL/6和anti-Act 1雄性小鼠各12只,分别设为对照组和实验组,参照Qi等[19]的方法建立体内肺转移模型。将B16-F10细胞(1×105/0.2 mL)通过尾静脉的注射方法,分别注射到C57BL/6和anti-Act 1的体内。20 d后腹腔注射氯胺酮10 mg/kg、阿托品1 mg/kg、盐酸西拉嗪20 mg/kg麻醉,颈部脱臼处死小鼠。
1.2.4 肺组织病理组织学观察
处死C57BL/6和anti-Act 1小鼠后,取肺组织,平铺在滤纸上,观察肺组织转移的结节数。再将其置于4%的多聚甲醛液中固定过夜,脱水后石蜡包埋,切片,HE染色。显微镜下观察肺组织肿瘤转移的情况。
1.2.5 免疫组化法检测肺组织Ki67、CD45、CD68的表达
采用常规石蜡切片(3 μm),通过Ki67(Abcam)、CD45 (Proteintech) 和CD68 (Proteintech) 对肺、肺转移灶部位进行特异性染色,显微镜下观察肿瘤细胞的增殖情况和炎症浸润程度。石蜡切片脱蜡后,高温高压抗原修复8 min,3% H2O2-甲醇溶液中孵育30 min,10% BSA阻滞1 h,切片用兔抗鼠Ki67(Abcam)、CD45 (Proteintech) 和CD68 (Proteintech) 进行抗体孵育,4℃过夜,孵育二抗(兔抗,中杉金桥),DAB染色,苏木素复染。光学显微镜拍摄并记录分析。并运用免疫荧光法检测肺组织转移灶上巨噬细胞Act 1的表达情况,荧光显微镜避光拍摄。实验所用抗体为兔抗鼠CD68 (Proteintech)、Act 1 (Santa Cruz)、FITC(Life Technologies)标记二抗。
1.3 统计学数据分析
对上述所得实验数据,采用SPSS软件进行统计分析。以P< 0.05为差异有统计学意义。
2 结果
2.1 anti-Act 1小鼠的鉴定
Anti-Act 1小鼠基因鉴定的目的条带为250 bp,如图1 A所示。基因鉴定为阳性的小鼠,提取腹腔巨噬细胞,提取细胞的蛋白,采用Western blot技术检测Act 1的表达,结果如图1B所示,与C57小鼠相比,anti-Act 1小鼠的腹腔巨噬细胞中Act 1的表达有明显的下调趋势。
2.2 靶向抑制巨噬细胞Act 1对小鼠肺转移的影响
造模20 d后,处死小鼠。解剖取材,肉眼大体观察肺组织的转移情况。结果如图2所示,与C57小鼠相比,anti-Act 1小鼠肺表面转移灶较少。通过统计学分析,具有明显的下调趋势且有统计学意义(P< 0.01)。通过HE染色,在显微镜下观察转移灶,证实了它们与B16细胞的同源性。
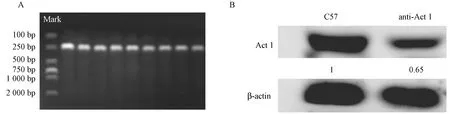
图1 (A) Anti-Act 1 小鼠基因型鉴定;(B) Western blot 技术检测小鼠腹腔巨噬细胞Act 1的表达Figure 1 (A) Genotype characterization of the anti-Act 1 mice;(B) Act 1 expression in peritoneal macrophages as determined by western blotting
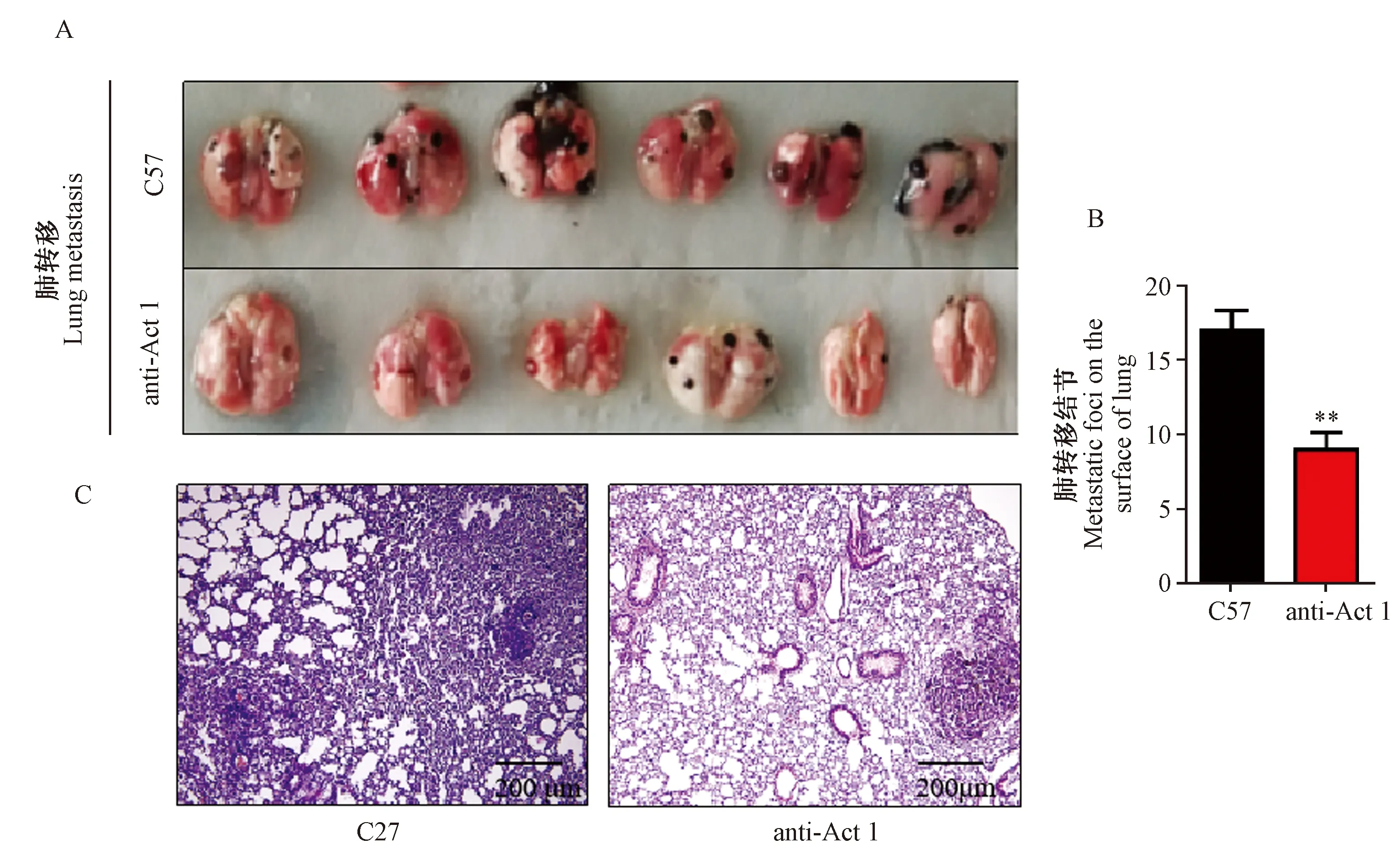
注:与C57小鼠相比,anti-Act 1小鼠体内肺结节数减小,**P<0.01。图2 C57和anti-Act 1小鼠肺部肿瘤转移的情况(×10)Note.Compared with C57 mice, the number of lung nodules in anti-Act 1 mice were decreased, **P< 0.01.Figure 2 Comparison of lung metastasis in the lung tissues of C57 and anti-Act 1 mice
2.3 靶向抑制巨噬细胞Act 1对小鼠肺组织B16-F10肿瘤细胞增殖的影响
细胞增殖指数是评价肿瘤严重程度的关键因素,Ki67可以反映细胞增殖的情况。免疫组化的结果如图3所示,与C57小鼠相比,anti-Act 1小鼠的Ki67的表达量明显减少。通过统计增殖指数(阳性细胞数/总细胞数),结果显示anti-Act 1小鼠的肿瘤细胞增殖程度低于C57小鼠,且具有统计学差异(P< 0.01)。
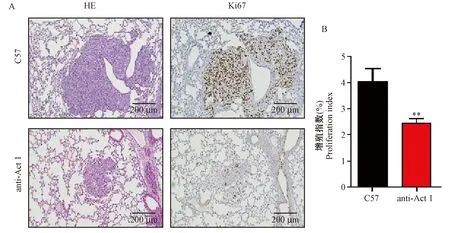
注:与C57小鼠相比,anti-Act 1小鼠体内Ki67表达量下降,**P< 0.01。图3 C57和anti-Act 1小鼠肺部肿瘤细胞增殖情况(×10)Note.Compared with C57 mice, the expression of Ki67 in the anti-Act 1 micewere decreased, **P< 0.01.Figure 3 Tumor cell proliferation in the metastatic lung lesions of C57 and anti-Act 1 mice
2.4 靶向抑制巨噬细胞Act 1对小鼠肺组织炎症细胞浸润的影响
免疫组化的结果如图4所示,白细胞标记物CD45和巨噬细胞标记物CD68主要表达于肺转移灶的肿瘤实质部位。与C57小鼠相比,anti-Act 1小鼠的CD45和CD68的表达量明显减少,且均具有明显的统计学差异(P< 0.01)。结果提示,白细胞和巨噬细胞在肿瘤转移部位的浸润数量明显减小。免疫荧光的结果如图5所示,在C57小鼠肺转移灶中,Act1与巨噬细胞的标记物CD68均有表达,且有大量共定位;然而,在anti-Act 1小鼠中,两者的共定位甚少。进一步证明,在anti-Act 1小鼠的巨噬细胞上Act 1的表达被靶向抑制了,且此类巨噬细胞在肿瘤转移部位的浸润数量明显减小。
3 讨论
肿瘤一旦发生转移,就会对包括化疗、放疗和免疫疗法在内的大多数疗法产生耐药性。远端转移的黑色素瘤患者预后极差,中位生存时间仅为8个月[20]。转移是导致癌症相关死亡最主要的原因之一。肿瘤的发生发展与肿瘤细胞所处环境有密切关联,肿瘤微环境涉及多种免疫细胞和炎症因子,巨噬细胞参与其中且与多种肿瘤发生与发展密切相关[21]。Act 1作为IL-17信号通路必需的衔接蛋白,可与IL-17RA和TRAF6形成复合体,活化NF-κB等信号通路[22]。本研究利用巨噬细胞Act 1表达被靶向抑制的小鼠(anti-Act 1)为研究对象,探讨与研究了与NF-κB活化相关的Act 1对黑色素瘤肺转移的影响。
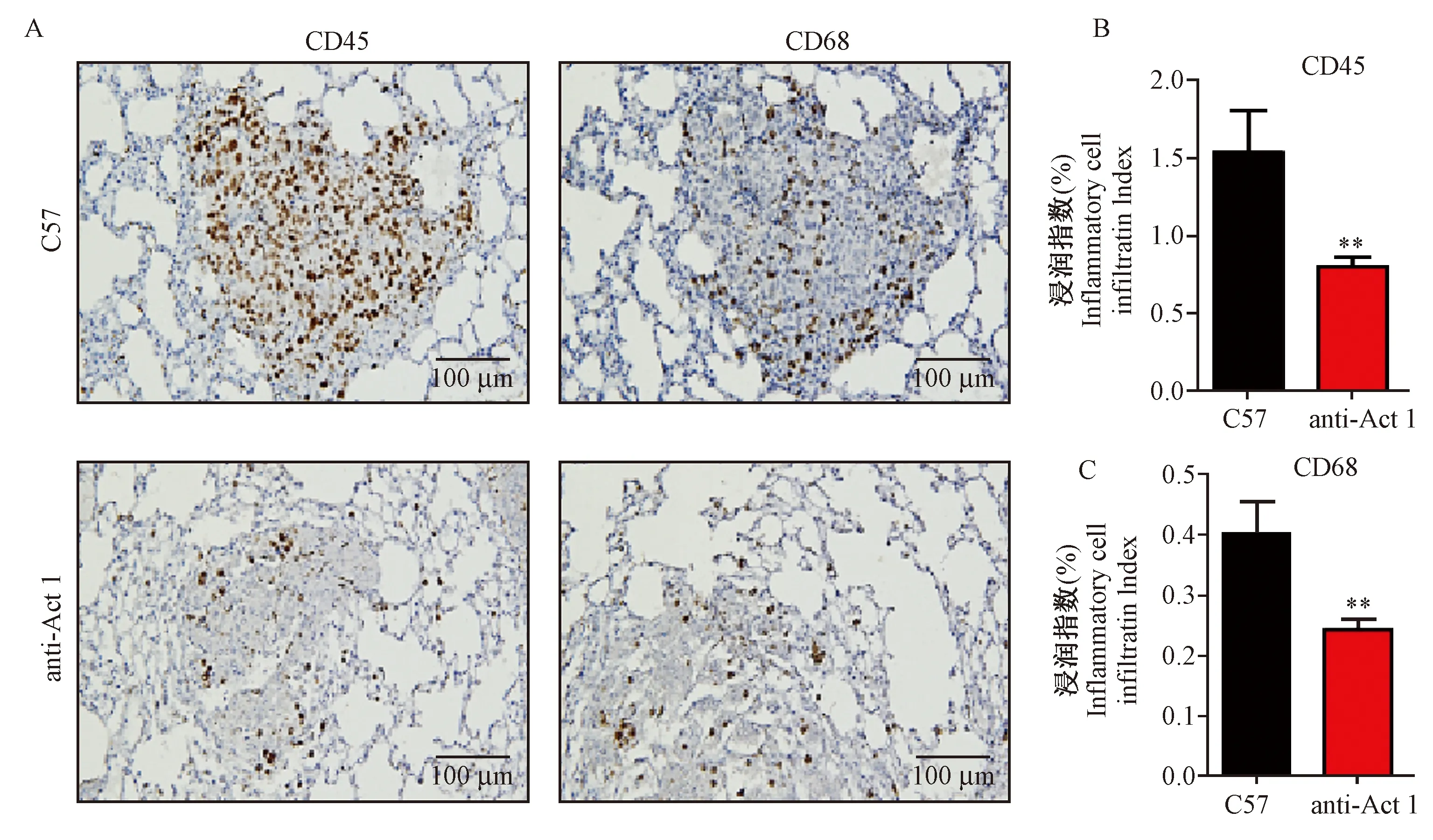
注:与C57小鼠相比,anti-Act 1小鼠体内CD45、CD68表达量均下降,**P< 0.01。图4 C57和anti-Act 1小鼠肺部炎症细胞浸润情况(×20)Note.Compared with C57 mice, the expressions of CD45 and CD68 were decreased in anti-Act 1 mice, **P< 0.01.Figure 4 Inflammatory cell infiltration in the lung tissues of C57 and anti-Act 1 mice
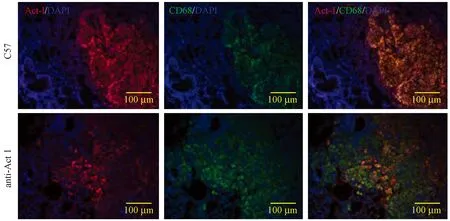
图5 免疫荧光法检测小鼠肺转移灶中巨噬细胞与Act 1的共表达情况(×20)Figure 5 Act 1 expression in the lung-resident macrophages. Immunofluorescence staining
本实验研究结果表明,在B16-F10的人工肺转移实验中,与C57小鼠相比,Anti-Act 1小鼠可显著抑制转移灶的数目,同时通过HE染色,显微镜下观察发现,Anti-Act 1小鼠的转移灶肿瘤组织面积小,片状坏死部位少,提示靶向抑制巨噬细胞Act 1的表达,具有抗恶性肿瘤转移的能力。细胞增殖指数是评价肿瘤严重程度的关键因素,ki67可以反映细胞增殖情况。在anti-Act 1小鼠的肺部转移灶的肿瘤部位,ki67的表达量明显降低,表明抑制巨噬细胞Act 1的表达能明显抑制肿瘤转移部位的细胞增殖。Anti-Act 1小鼠肿瘤的恶化程度较低,这也进一步说明了抑制巨噬细胞Act 1的表达能在一定程度上减慢肿瘤细胞向肺转移的速度。肿瘤组织中TAM浸润与肿瘤发展以及不良预后相关,TAM可分泌TNF-α、EGF、IL-6等因子促进肿瘤细胞的增殖与存活[23]。同时,也观察到,在肿瘤转移灶部位及其周围,白细胞和巨噬细胞的浸润明显减少。实验结果表明抑制巨噬细胞Act 1的表达,能够减缓肿瘤微环境中炎症细胞的浸润。
综上所述,靶向抑制巨噬细胞Act 1的表达具有抗黑色素瘤肺转移的效应,这种效应可能是由于抑制了肿瘤细胞的侵袭性和增殖能力,减弱了炎症因子的浸润能力。本研究结果为临床上抗肿瘤转移治疗提供了理论基础。但其抑制肿瘤细胞侵袭和转移的分子机制还有待深入研究。
