嫁接对网纹甜瓜幼苗叶片氮代谢及转录因子CmHY5表达的影响
2019-04-27王志冉王红艳张海旺张海兵陈丽娟许传强
王志冉,王红艳,张海旺,张 颖,张海兵,康 倩,陈丽娟,许传强
(沈阳农业大学 园艺学院/设施园艺省部共建教育部重点实验室/环渤海湾地区设施园艺蔬菜优质高效生产协同创新中心/北方园艺设施设计与应用技术国家地方联合工程研究中心,沈阳110161)
甜瓜(Cucumis melo L.)属于葫芦科甜瓜属一年生蔓性草本植物,在世界园艺作物生产中占有重要地位。近年来,随着甜瓜栽培面积的增加,生产中出现的化肥过量施用、重茬等现象造成了土壤耕层破坏、肥力下降、土传病害和连作障碍严重等一系列问题,而嫁接技术在甜瓜生产上的应用在一定程度上缓解了施肥和产量之间的矛盾,并可有效地防治土传病害,缓解土壤连作障碍[1-4]。
氮代谢是植物体内的重要物质代谢,在生命活动中具有特殊作用。氮素不仅影响植物新陈代谢,而且影响资源分配及所有水平上的发育[5]。植物吸收氮素的主要形式为NO3-和NH4+,其硝酸盐含量和硝酸还原酶活性是生长发育、氨基酸和蛋白质含量的重要限制因素[6]。植物对硝态氮、铵态氮的吸收与运输主要是通过硝酸盐转运蛋白(nitrate translocator,NRT)和铵盐转运蛋白(ammonium translocator,AMT)进行调节的,它们是细胞在氮素同化过程中起到重要作用的离子载体[7-11]。HY5(elongated hypocotyl5)是光响应的bZIP(亮氨酸拉链)类的转录因子,也是调控植物碳氮平衡的重要因子,它对促进植物氮素的吸收、运转和同化具有十分重要的作用[12-16]。已有研究表明,嫁接能够增强甜瓜硝态盐的吸收和利用,提高植株中硝态氮含量[17-19]。但对于嫁接能够提高氮素运转、同化能力的原因目前尚未见报道,其内在的分子机制仍然不清楚。本试验以网纹甜瓜为试材,探究嫁接对不同叶龄网纹甜瓜幼苗氮素吸收、运转和同化的生理特性及分子响应的影响,并系统分析嫁接对氮素代谢的关键调控因子CmHY5时空表达特性的影响,以期探寻影响嫁接甜瓜幼苗氮素代谢的关键因素,为进一步明确嫁接影响甜瓜幼苗氮素代谢的生理和分子机制提供理论依据。
1 材料与方法
1.1 材料
本试验在沈阳农业大学园艺学院北山科研基地进行。供试接穗品种为网纹甜瓜京玉5号,由京研益农(北京)种业科技有限公司提供;砧木品种为白籽南瓜圣砧1号,由沈阳圣地亚农业高科技有限公司提供。
供试超纯RNA提取试剂盒(UItrapure RNA Kit)为康为世纪提供;反转录酶(M-MLV Reverse of Transcriptase)为Promega公司提供。供试照度计型号为TPJ-14。
1.2 方法
以嫁接网纹甜瓜幼苗为处理(G),自根网纹甜瓜幼苗为对照(CK),贴接法嫁接。分别在植株长至5、6、7、8、9叶期时进行取样。每次取样时,在晴天的 9∶00~11∶00进行,选择苗龄相同,长势一致的甜瓜幼苗,取其功能叶片(6叶期时取其植株根、茎、叶。叶片为自上而下取第3、第4片叶)。用喷壶冲洗,洗净后擦干,称重并放入液氮中速冻,在-80℃冰箱内保存。3次生物学重复。
光照处理:弱光使用遮阳网进行遮光处理,黑暗处理是将植物放入外白内黑的塑料薄膜覆盖的暗室内。甜瓜幼苗长至5叶期时,8∶00开始处理,次日8∶00进行取样。使用照度计测量不同光照条件下的光强(图 1)。
1.2.1 地上部生物量测定 将不同叶龄的甜瓜幼苗从嫁接接口处剪下,对照则选择相同的位置进行取样,称量地上部分的鲜重,然后将植株的地上部分用牛皮纸的档案袋装好,放入60℃的烘箱中杀青,时间为30min,然后在65℃下烘大约3d,烘至恒重,并测定植株干物质的重量。相对含水量 (relative water content,RWC)=(鲜重-干重)/鲜重。
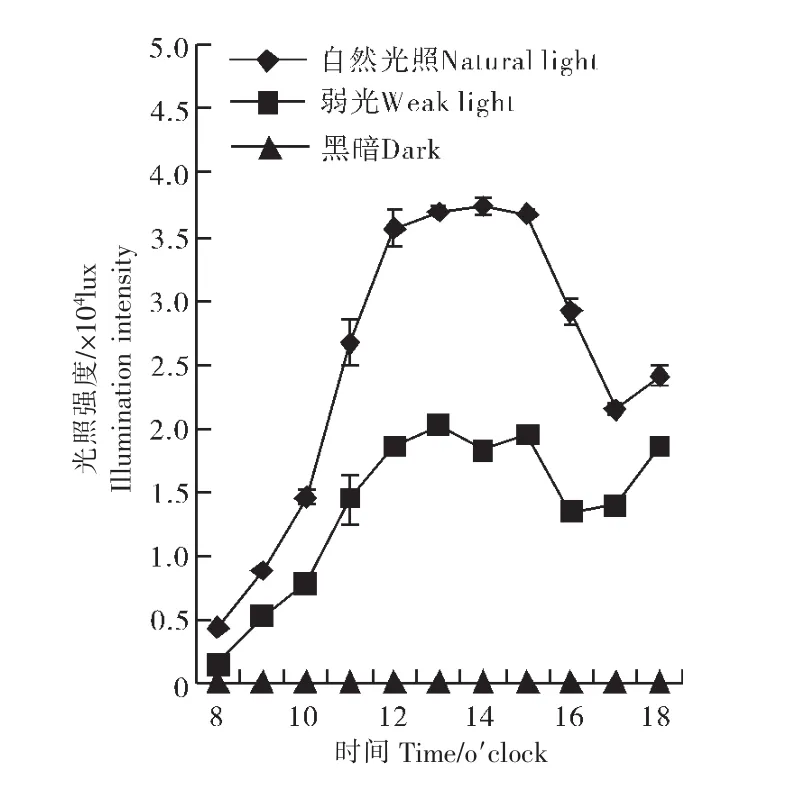
图1 不同光照条件下的光强Figure 1 Illumination intensity of different lighting treatments
1.2.2 硝态氮(NO3--N)和铵态氮(NH4+-N)含量测定 硝态氮(NO3--N)含量测定参考王学奎等[22]的方法。铵态氮(NH4+-N)含量测定采用改良茚三酮测定法[22]。
1.2.3 氮代谢相关酶活性的测定 硝酸还原酶(nitrate reductase,NR)活性、谷氨酰胺合成酶(glutamine synthetase,GS)活性测定参考付新星[20]的方法。
1.2.4 氮代谢相关酶基因表达量检测 使用超纯RNA提取试剂盒,参考说明书步骤进行RNA的提取。反转录用到的试剂是由Promega公司提供的反转录酶 (M-MLV Reverse of Transcriptase)。使用TIANGEN公司的SYBR Green荧光定量试剂盒进行RNA表达量检测,使用仪器Applied Biosystems 7500(USA)进行检测。
1.3 数据处理与统计分析
试验所得数据结果采用Microsoft Excel(2007)软件进行处理并绘制相应图表;采用DPS5.0软件进行差异显著性分析。

表1 荧光定量PCR检测中使用的特异性引物Table 1 List of specific primers used in fluorescence quantitative PCR detection
2 结果与分析
2.1 嫁接对网纹甜瓜幼苗地上部生物量的影响
由表2可知,随苗龄增长,嫁接与自根对照(CK)幼苗地上部的干重和鲜重都呈现逐渐上升的趋势。鲜重除6叶期,干重除5叶期外,嫁接处理幼苗地上部生物量均显著高于对照。嫁接处理幼苗相对含水量也高于对照。可见,嫁接促进了网纹甜瓜幼苗地上部的生长,增强了网纹甜瓜幼苗生长势,使网纹甜瓜幼苗接穗相对含水量有所增加。
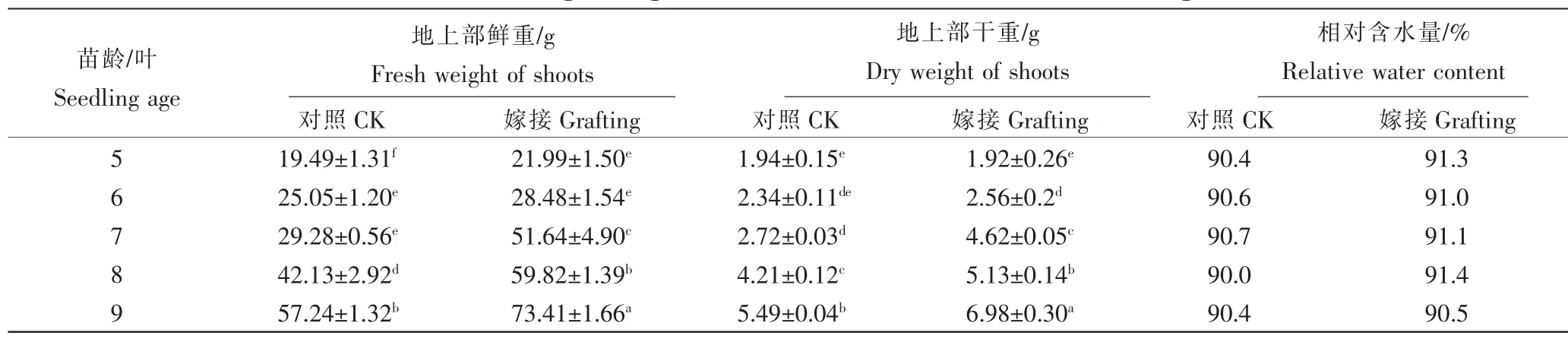
表2 嫁接对网纹甜瓜幼苗地上部生物量的影响Table 2 Effects of grafting on the biomass of muskmelon seedling shoots
2.2 嫁接对网纹甜瓜幼苗叶片中硝态氮(NO3--N)和铵态氮(NH4+-N)含量的影响
由图2可以看出,随着网纹甜瓜幼苗的生长,嫁接处理与对照网纹甜瓜幼苗叶片中的NO3--N和NH4+-N含量均呈现逐渐上升趋势。除7叶期外,各时期嫁接处理叶片中NO3--N和NH4+-N含量均显著高于对照。可见,嫁接显著提高了网纹甜瓜幼苗叶片中NO3--N和NH4+-N含量。
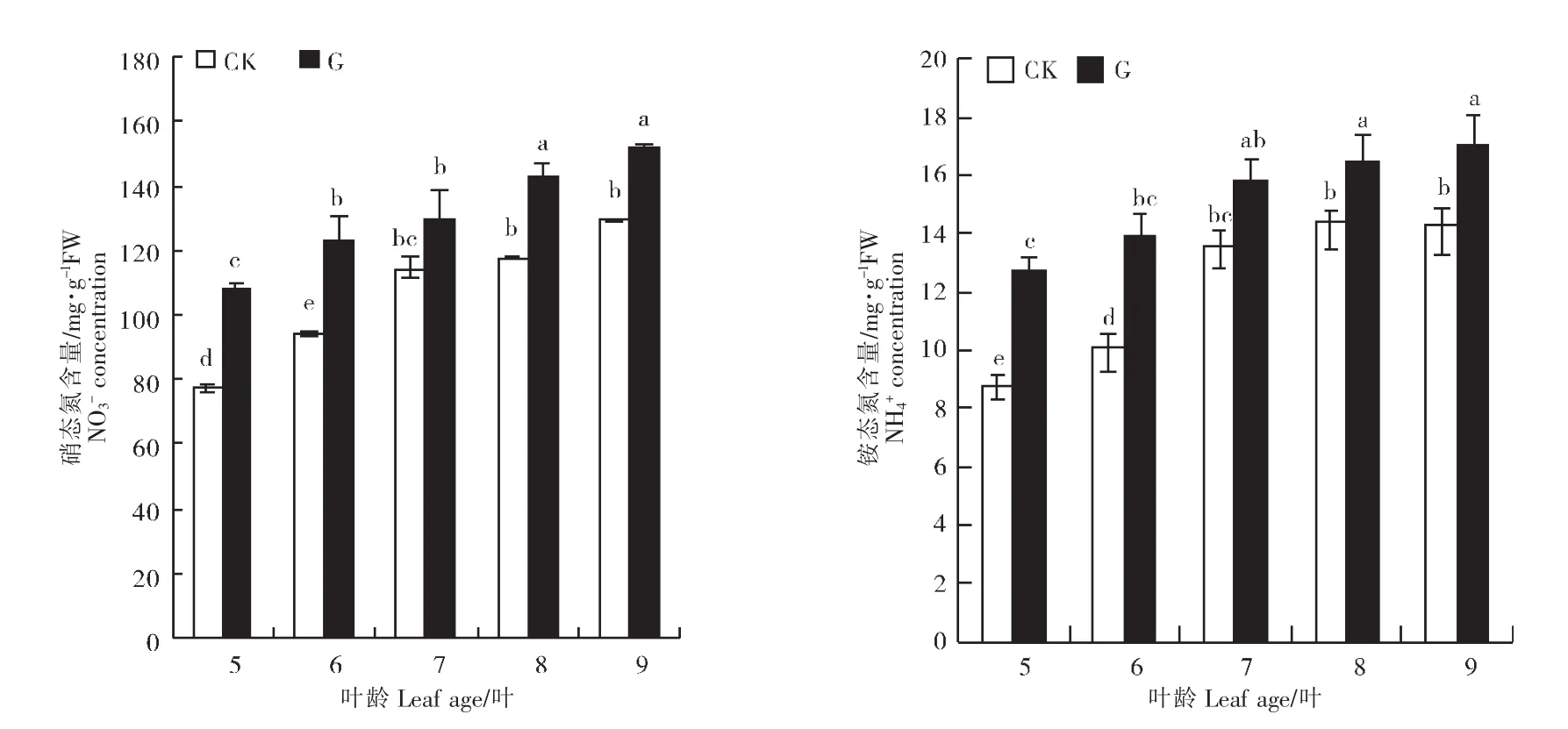
图2 嫁接对网纹甜瓜幼苗叶片中硝态氮和铵态氮含量的影响Figure 2 Effects of grafting on NO3--N and NH4+-N contents of muskmelon seedling leaves
2.3 嫁接对网纹甜瓜幼苗叶片氮代谢相关酶活性的影响
硝酸还原酶(NR)和谷氨酰胺合成酶(GS)是植物氮代谢的关键酶,对作物的产量和品质都具有重要的作用[21-23]。由图3可知,嫁接与自根网纹甜瓜幼苗叶片中NR活性变化总体趋势基本一致,均呈现上升趋势。但各时期嫁接处理叶片中NR活性均显著高于对照。嫁接处理与对照网纹甜瓜幼苗叶片中GS活性变化趋势相同。5~8叶期,嫁接处理和对照网纹甜瓜幼苗叶片中GS活性变化均不明显,无显著差异。9叶期时,嫁接处理网纹甜瓜幼苗叶片中GS活性显著高于其他各时期,而对照网纹甜瓜叶片中GS活性显著高于5叶期。5~9叶期,嫁接处理叶片中GS活性均显著高于对照。可见,嫁接能够显著提高网纹甜瓜叶片中NR和GS活性。
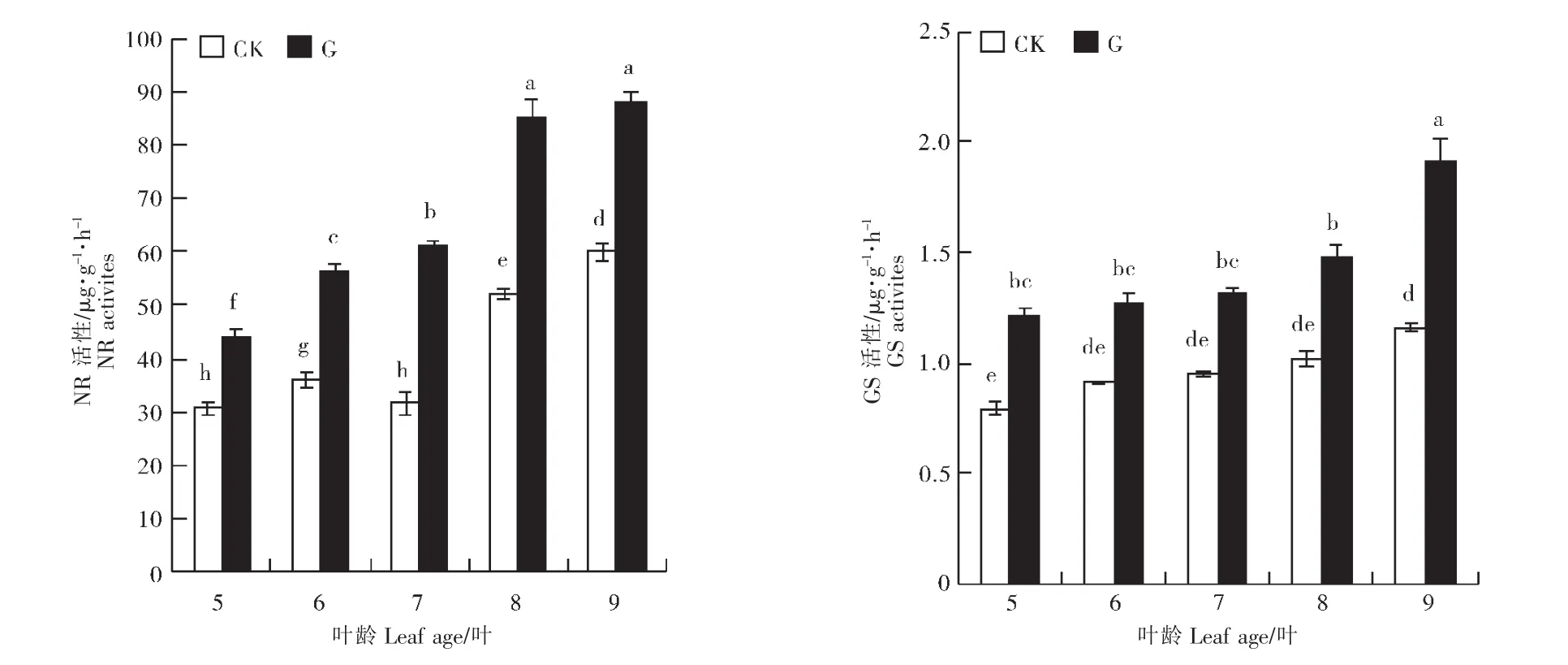
图3 嫁接对网纹甜瓜幼苗叶片氮代谢相关酶活性的影响Figure 3 Effects of grafting on enzyme activities involved in nitrogen metabolism of muskmelon seedling leaves
2.4 嫁接对网纹甜瓜幼苗叶片氮代谢相关酶基因的影响
由图4可知,随着网纹甜瓜幼苗的生长,嫁接处理与对照网纹甜瓜幼苗叶片中CmNR和CmGS相对表达量变化均呈现上升趋势,且与其NR和GS活性变化趋势基本一致。5~7叶期,对照网纹甜瓜幼苗叶片中CmNR相对表达量无显著变化;8~9叶期,其相对表达量显著增加。5~9叶期,嫁接网纹甜瓜幼苗叶片中CmNR相对表达量迅速增加,各时期差异显著,且均显著高于对照。除5叶期外,嫁接网纹甜瓜幼苗叶片中CmGS相对表达量均显著高于对照。可见,嫁接处理能够显著诱导氮代谢相关酶基因CmNR和CmGS上调表达。
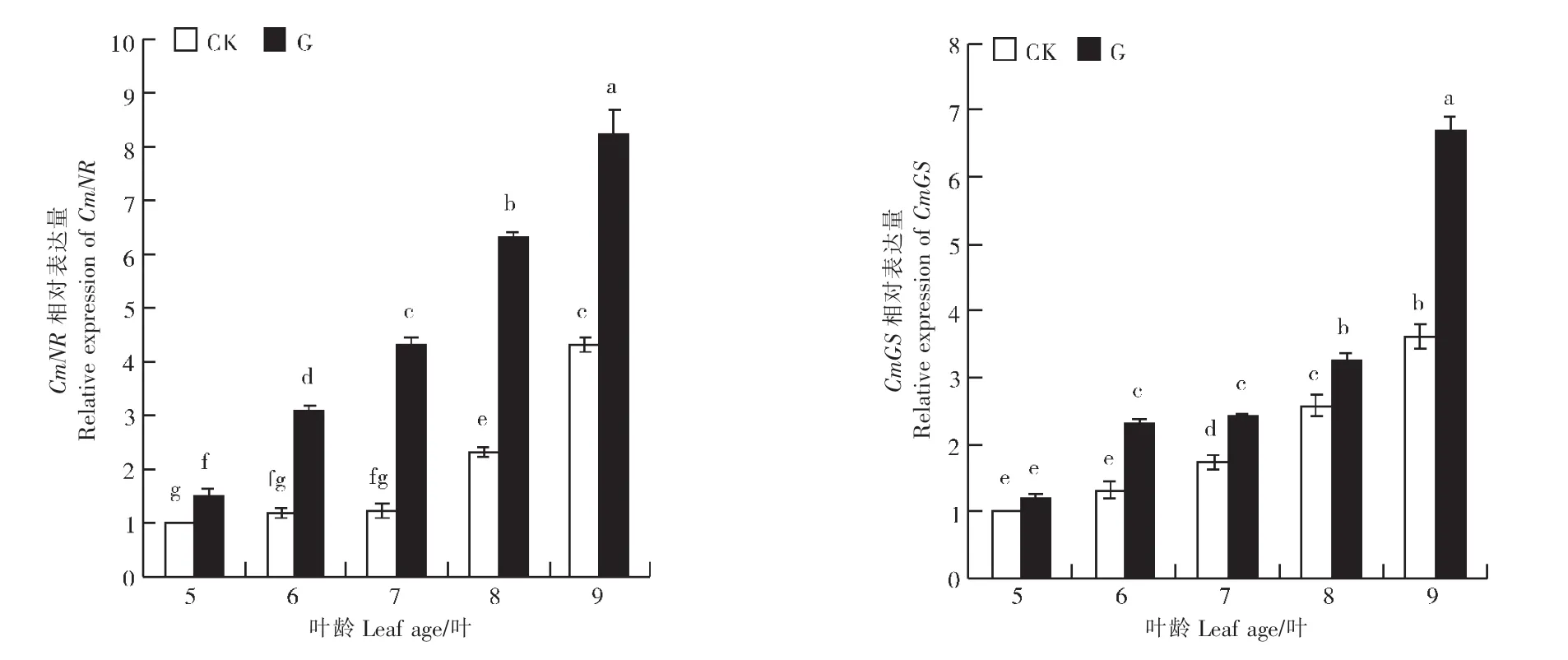
图4 嫁接对网纹甜瓜幼苗叶片氮代谢相关酶基因表达的影响Figure 4 Effects of grafting on relative enzyme genes expression involved in nitrogen metabolism of muskmelon seedling leaves
2.5 嫁接对网纹甜瓜幼苗叶片中氮素转运蛋白基因表达的影响
随着网纹甜瓜幼苗的生长,嫁接处理与对照网纹甜瓜幼苗中氮素转运蛋白相关基因CmNRT2.4、CmNRT2.5、CmAMT2、CmAMT3相对表达量均呈现上升趋势。由图5可知,嫁接处理显著提高了CmNRT2.4相对表达量。在5~6叶期时,嫁接处理对CmNRT2.5相对表达量影响较为显著,其相对表达量显著高于对照。总体来看,嫁接处理CmAMT2、CmAMT3相对表达量均显著高于对照。可见,嫁接处理网纹甜瓜幼苗叶片中氮素转运蛋白相关基因显著上调表达。
2.6 不同光照条件下嫁接对网纹甜瓜幼苗叶片CmHY5基因表达的影响
由图6可知,光照条件显著影响了嫁接网纹甜瓜叶片中CmHY5表达,其相对表达量随光照强度的减弱而显著降低。自然光照条件下,嫁接处理显著促进CmHY5表达,其相对表达量为对照的2.68倍,但在弱光和黑暗条件下,嫁接处理与对照间无显著差异。可见,CmHY5表达受光照诱导,且嫁接处理能够在自然光照条件下显著诱导CmHY5上调表达。
2.7 CmHY5时空差异表达
6叶期时,嫁接处理与对照网纹甜瓜植株根、茎、叶中CmHY5相对表达量变化趋势基本一致。嫁接处理与对照植株叶片中CmHY5相对表达量显著高于根和茎。其中,嫁接处理叶片中的相对表达量是对照的5.98倍,且嫁接处理显著提高了CmHY5在植株根、茎、叶中的相对表达量。5~9叶期时,嫁接处理叶片中CmHY5相对表达量也显著高于对照(图7)。可见,嫁接处理能够显著提高CmHY5在网纹甜瓜幼苗植株根、茎、叶中表达。
3 讨论与结论
3.1 嫁接对网纹甜瓜幼苗氮素代谢和转运的影响
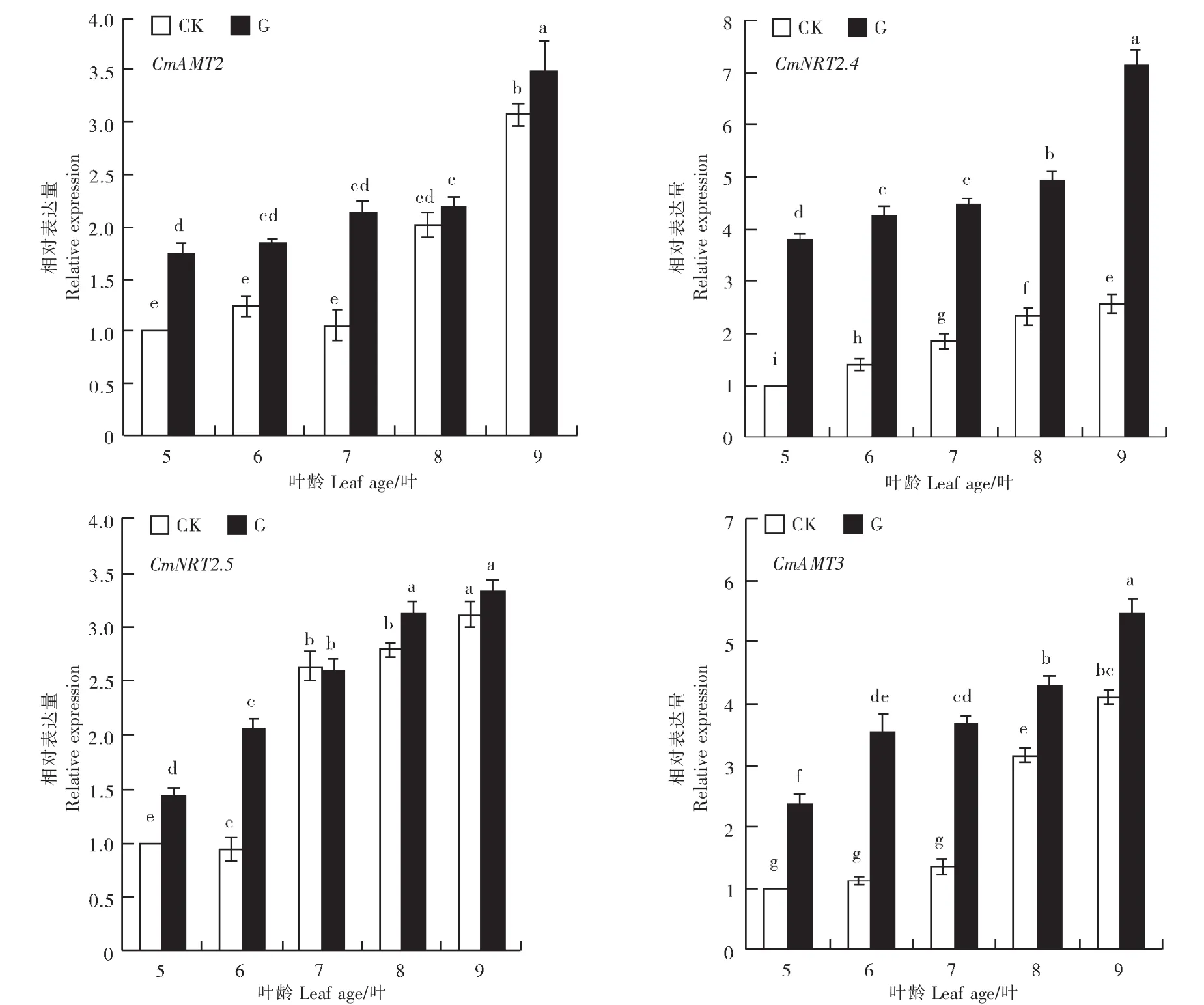
图5 嫁接对网纹甜瓜幼苗叶片中氮素转运蛋白基因表达的影响Figure 5 Effects of grafting on nitrogen translocator genes expression of muskmelon seedling leaves
已有研究表明,嫁接植株根系发达,能够从土壤中获得更多的水分[24-27],同时嫁接植株光合能力显著增强,光合产物积累增加[28-31]。本研究结果发现,嫁接能够增加网纹甜瓜幼苗地上部的生物量,植株干鲜重均显著增加。另外,嫁接网纹甜瓜幼苗的相对含水量也要高于对照。可见,嫁接处理能够提高网纹甜瓜植株生长势,增加其干物质积累。同时,嫁接也显著提高了网纹甜瓜幼苗叶片中的NO3--N和NH4+-N的含量及氮代谢关键酶(NR、GS)活性,这与在嫁接黄瓜[17]、嫁接茄子[32]等作物上的研究结果一致。通过对CmNR和CmGS表达量的分析发现,嫁接处理显著提高网纹甜瓜幼苗中CmNR和CmGS相对表达量。且与NR、GS酶活性变化趋势基本一致。可见,嫁接处理能够上调表达CmNR和 CmGS,提高氮代谢关键酶(NR、GS)活性,从而促进了网纹甜瓜叶片的氮素代谢。此外,嫁接处理也使硝酸转运蛋白基因 NRT(CmNRT2.4、CmNRT2.5)和铵盐转运蛋白基因 AMT(CmAMT2、CmAMT3)的相对表达量显著上调。氮素运转蛋白基因表达量的上调表明转运铵根离子和硝酸根离子的载体增多,嫁接网纹甜瓜叶片氮素的运转能力增强。
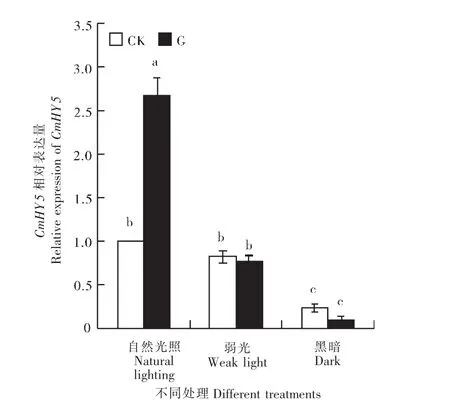
图6 不同光照条件下嫁接对网纹甜瓜幼苗叶片CmHY5基因表达的影响Figure 6 Effects of grafting on CmHY5 gene expression of muskmelon seedling leaves under different lighting conditions
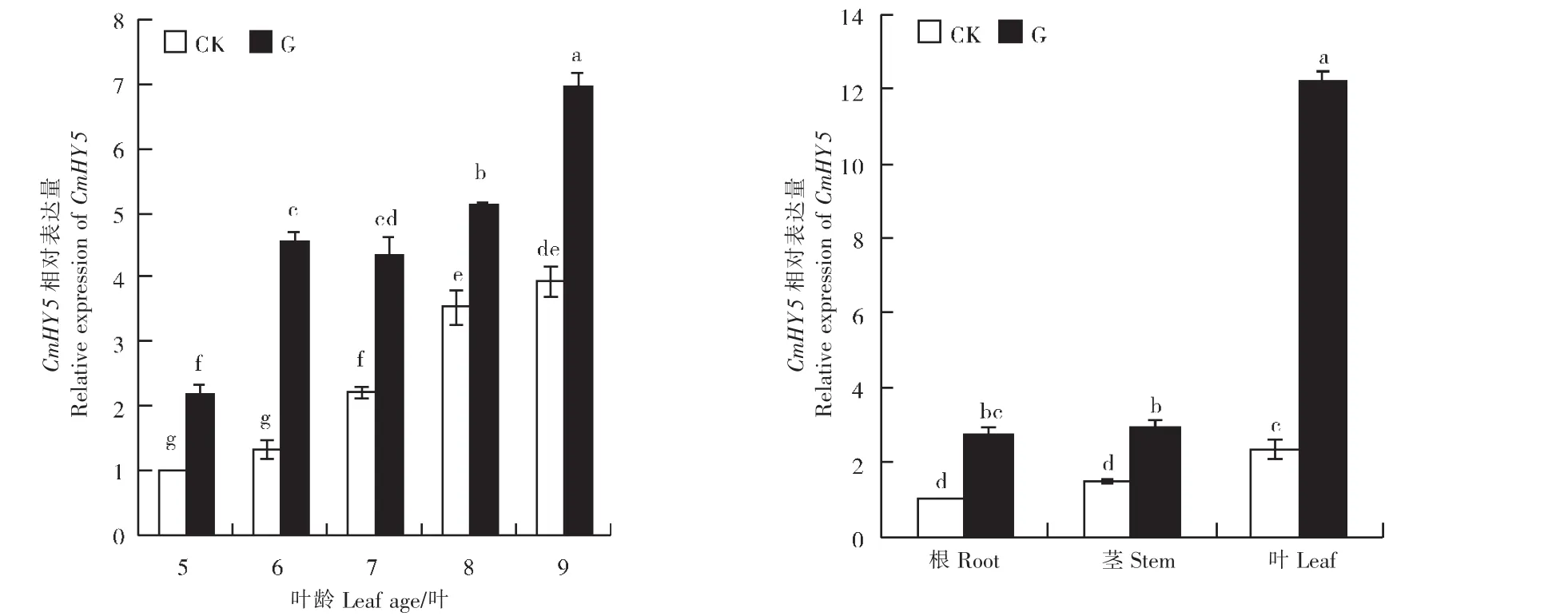
图7 嫁接对网纹甜瓜幼苗CmHY5基因时空表达的影响Figure 7 Effects of grafting on spatio-temporal expression of CmHY5 gene of musk melon seedling leaves
3.2 嫁接诱导CmHY5表达及其在氮素代谢过程中的调控作用
HY5是能够从地上部移动到根系的长距离运输的转录因子[33],也是光形态建成的核心因子[34-37]。本试验结果表明,嫁接处理能够显著诱导转录因子CmHY5表达。正常光照条件下,嫁接网纹甜瓜幼苗叶片中CmHY5基因相对表达量显著高于自根网纹甜瓜;在弱光和黑暗条件下,CmHY5相对表达量与自根网纹甜瓜无显著差异。并且,从CmHY5时空表达分析中也发现,嫁接处理显著提高了网纹甜瓜植株不同部位(根、茎、叶)及不同叶龄(5~9叶龄)叶片中CmHY5相对表达量。大量的研究证明,转录因子HY5能够促进氮素在植物体内的运输。转录因子HY5可与NRT家族的基因作用,促进NO3--N形式的氮素的运输[12],也可与AMT家族的基因作用,调控NH4+-N形式的氮素的运输[14]。并且,转录因子HY5对氮代谢关键酶基因也具有调控作用。利用DNA芯片杂交技术发现NR启动子中有HY5的2个假定结合位点[38]。通过分析拟南芥hy5功能缺失突变体发现转录因子HY5对NR酶活性的增强是十分重要[39]。可见,嫁接处理对网纹甜瓜叶片氮代谢关键酶基因表达及氮素转运蛋白基因表达的影响可能是通过诱导转录因子CmHY5表达进行调控的。
据此,推测嫁接诱导转录因子CmHY5上调表达是导致嫁接网纹甜瓜叶片氮素代谢和转运增强的关键因素。但是,诱导甜瓜接穗叶片中CmHY5上调表达是由于嫁接砧木中的相关物质导致的或是砧木-接穗互作效应诱导的尚不明确。今后,可借助RNA-Seq测序技术及相关分子生物学技术(如:病毒诱导的基因沉默,VIGS)等进一步探析嫁接诱导CmHY5上调表达的原因,以期深入揭示嫁接影响网纹甜瓜氮代谢的生理和分子机制。
