链格孢菌SC-018培养工艺优化及其致病性研究
2019-04-27王禹博纪明山谷祖敏张淑东
王禹博 ,纪明山 ,谷祖敏 ,张淑东 ,张 双 ,杨 宁 ,王 勇
(1.沈阳农业大学 植物保护学院,沈阳 110161;2.辽宁科技大学 化学工程学院,辽宁 鞍山114051)
链格孢菌属于丝状真菌,广泛分布于土壤、污水以及动植物体内。链格孢菌的致病机理主要是通过菌丝产生的多种致病毒素,侵染植物组织,从而引起病理反应造成伤害[1-2]。目前就有报道利用其活体以及代谢产物研发新的生物除草剂[3]。朱海霞等[4]研究发现极细链格孢菌对薄蒴草、藜和密花香薷致病效果突出。采用响应面法优化培养基配方及培养条件,是生物研究中培养基及培养条件优化的重要方法[5-6]。本研究对链格孢菌SC-018培养基中的有机碳、无机氮源、培养温度及初始pH值4个因素利用响应面Box-Behnken实验进行了培养工艺优化,以期增加链格孢菌代谢产物的量和增强其除草活性。野慈姑(Sagittariatrifolia Linn)属泽泻科慈姑属,是一种多年生沼生草本植物,为水田常见杂草,东北三省稻田主要危害杂草之一。化学防除虽然高效,但伴随农产品安全和环境相融友好方面的潜在风险。因此,寻求安全高效的防除野慈姑生物活性成分成为重要方向[7-8]。本研究考察影响链格孢菌SC-018侵染野慈姑的相关因子,建立了稳定的温室环境下链格孢菌SC-018侵染野慈姑的致病体系。
1 材料与方法
1.1 材料
供试链格孢菌SC-018,由沈阳农业大学植物保护实验室提供。供试野慈姑幼苗2017年7月采自辽宁省抚顺清原县大孤山镇。
1.2 方法
1.2.1 碳源筛选 考察不同碳源对链格孢菌SC-018菌丝直径的影响。分别以可溶性淀粉、D-半乳糖、糊精、α-乳糖、山梨醇均按20g·L-1加入PDA培养基代替培养基中的蔗糖,采用直径5mm的打孔器打下链格孢菌SC-018的菌饼,将菌饼倒扣于PDA培养基的平皿中,每组试验设置3次重复,将平皿于25℃恒温培养箱中倒置培养7d,于第3天开始每天测量菌丝直径。
1.2.2 氮源筛选 分别以硝酸钠、硫酸铵、乙酸铵、硝酸钾、硝酸钙均按3.0g·L-1加入PDA培养基中,考察不同氮源对菌丝直径的影响。
1.2.3 培养温度优化 将接种菌饼的平皿分别于5,10,15,20,25,30,35,40℃的条件下倒置培养7d[9],试验设置3次重复,于第3天开始每天测量菌丝直径。
1.2.4 培养基初始 pH 值的优化 考察培养基初始 pH值分别为 5,6,7,8,9,10,11和 12时[10],25℃下培养3,7d时,对菌丝直径的影响。
1.2.5 响应面法优化试验 将上述优化后的因素,通过软件Design-Expert8.0.5中的Box-Behnken(B-B)实验,设计确定所选定的因素的最优值,从而确定最佳的培养基组分比例及培养条件[11-12]。
1.2.6 链格孢菌SC-018的最适接种浓度 将链格孢菌SC-018发酵液用双层纱布过滤,通过无菌水稀释调节使孢子初始浓度为 2.0×106个·mL-1, 再用无菌水将该过滤液稀释成孢子浓度为 1.00×106,5.00×105,2.50×105,1.25×105,6.25×104个·mL-1的悬浮液,加入0.5%吐温-80作为展着剂。将上述孢子悬浮液液滴接种于4叶期的野慈姑叶片。每个处理3次重复,每个重复处理20个叶片。接种后置于25℃、12h光暗交替温室培养5d,测量各叶片上病斑面积。
1.2.7 接种的最佳时期 确定利用浓度为每毫升1.0×106个孢子的链格孢菌SC-018悬浮液喷雾接种1叶期、1~2叶期、2~3叶期、3~4叶期的健康野慈姑植株,接种过的野慈姑幼苗置于温室(夜间最低温度15~18℃,白天最高温度为32~35℃;RH为30%~60%,日平均RH为42%)中培育。每个处理4次重复,接种5d后,测定各组的致病率。
1.2.8 环境因子对链格孢菌SC-018致病性的影响 用每毫升1.0×106个孢子的链格孢菌SC-018悬浮液喷雾接种1~2叶期的健康野慈姑植株,分别置于15,19,25,28,30,35℃的人工温室中培育 (12h光暗交替,RH≥90%)。每个处理设4次重复,接种5d后调查病斑面积,考察温度对链格孢菌SC-018致病力的影响。
用每毫升1.0×106个孢子的链格孢菌SC-018悬浮液喷雾接种1~2叶期的健康野慈姑植株,然后分别置于25℃,RH≥90%的人工温室中培养,设置24h黑暗、10h光照/14h黑暗、12h光照/黑暗交替、14h光照/10h黑暗和24h光照共5个处理。每个处理设4次重复,接种5d后调查病斑面积[13],考察光照对链格孢菌SC-018致病力的影响。
用每毫升1.0×106个孢子的链格孢菌SC-018悬浮液喷雾接种1~2叶期的健康野慈姑植株,然后分别置于25℃的人工温室中(12h光暗交替,RH≥90%)培养0,12,24,36,48,72h。 每个处理设 4次重复,接种 5d后调查发病率和死亡率[14],考察结露时间对链格孢菌SC-018致病力的影响。
2 结果与分析
2.1 不同碳源、氮源对链格孢菌SC-018菌丝生长的影响
由图1可知,随着培养时间的增加,菌丝直径均出现了增长的趋势。D-半乳糖作为碳源的菌丝直径比蔗糖为碳源的处理高12.24%,比直径最小的糊精为碳源的处理高18.38%,可见培养基中最适碳源为D-半乳糖。由图2可知,添加了硝酸钠的培养基,于第7天时菌丝直径达到6.41cm,与常规培养基及添加其他无机氮源相比体现出了相当的优势,因而最适的无机氮源为硝酸钠。
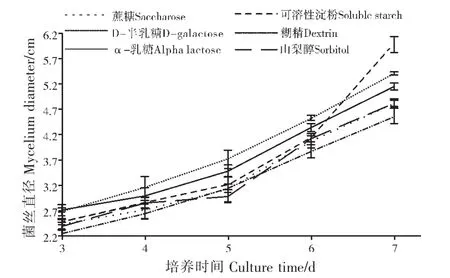
图1 不同碳源对链格孢SC-018菌菌丝生长的影响Figure 1 Effects of different carbon sources on mycelial growth of Alternaria alternata SC-018
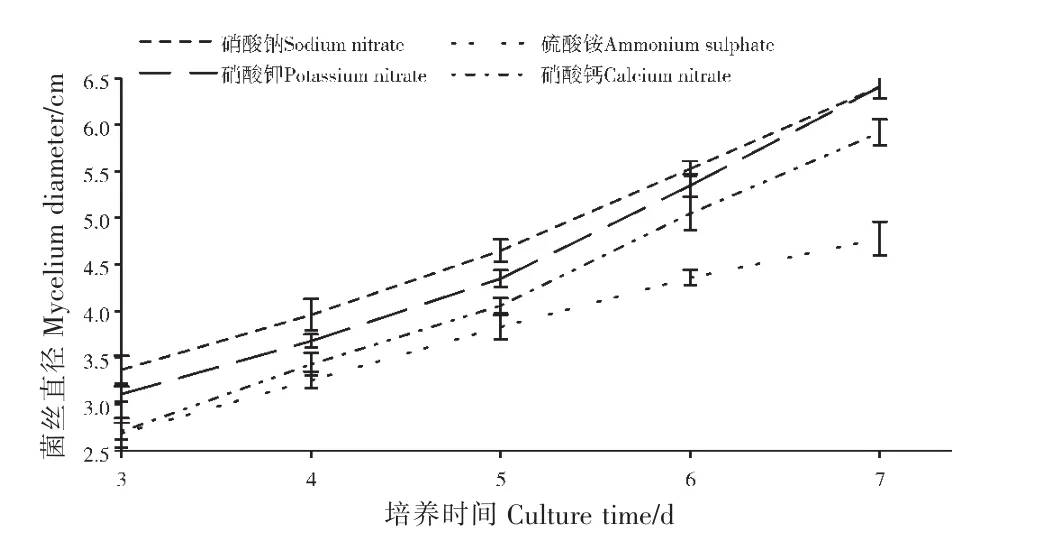
图2 不同氮源对链格孢菌SC-018菌丝生长的影响Figure 2 Effects of different nitrogen sources on mycelial growth of Alternaria alternata SC-018
2.2 不同培养温度、培养基初始pH值对链格孢菌SC-018菌丝生长的影响
由图3可知,在25℃时,链格孢菌SC-018的菌丝直径最大,但当培养温度达到30℃后,随着温度的升高,菌丝直径下降明显。可见链格孢菌SC-018的最适培养温度为25℃。由图4可知,当培养基的初始pH值为8时,链格孢菌SC-018的菌丝直径最大,达到5.925cm,pH值为12时直径最小(4.96cm),最大值比最小值高19.4%,可见培养基最适初始pH值为8。
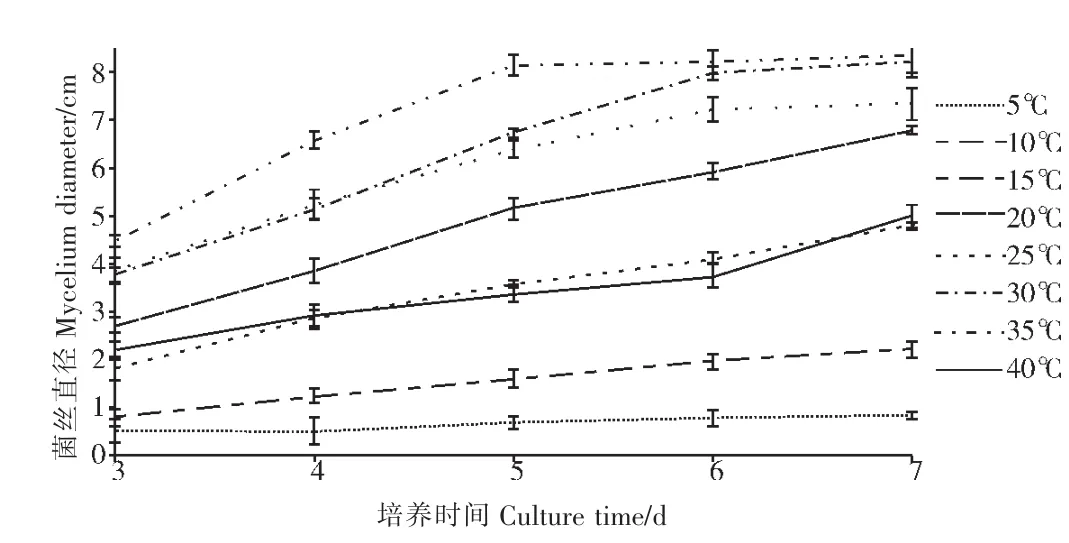
图3 不同培养温度对链格孢菌SC-018菌丝生长的影响Figure 3 Effects of different culture temperatures on mycelial growth of Alternaria alternata SC-018
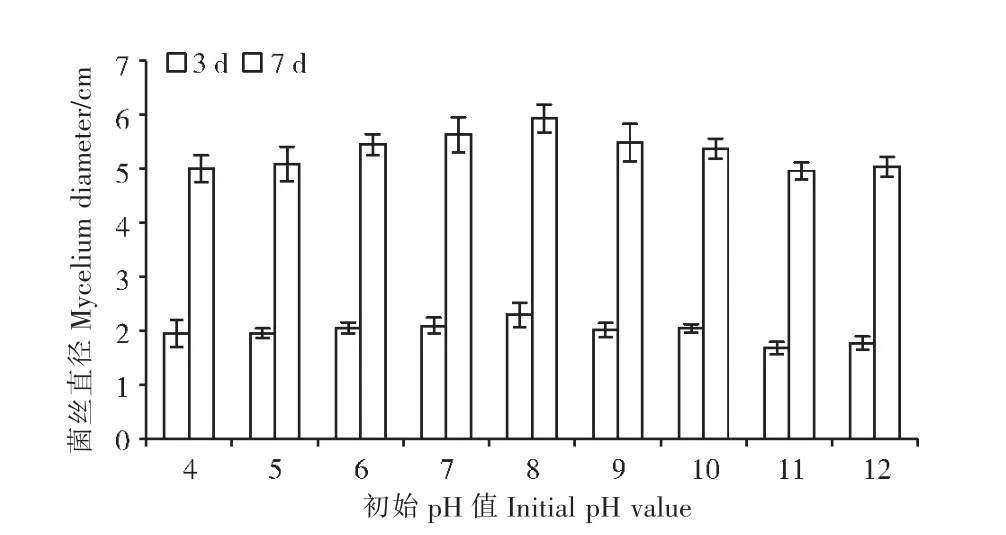
图4 培养基初始pH值对链格孢菌SC-018菌丝生长的影响Figure 4 Effects of initial pH value of culture medium on mycelial growth of Alternaria alternata SC-018
2.3 响应面Box-Behnken试验结果
将培养基中最适碳源D-半乳糖,最适氮源硝酸钠,最适生长温度25℃,最适初始pH值8,这4个因素作为本次B-B试验的影响因素。根据响应面的软件Box-Behnken所设计出的试验方案,通过这个试验方案对链格孢菌SC-018进行培养,每组试验3次重复,培养7d后,测量链格孢菌SC-018的菌丝直径(表1)。
经过软件Design-Expert V 8.0.5分析可知(表2),各个因素的最优值为D-半乳糖21.50g·L-1,硝酸钠3.15g·L-1,培养温度25.94℃,初始pH值7.81,此时的菌丝直径经过计算为7.37cm,通过多次重复试验可以得到的实际菌丝直径为7.35cm。两个值相差的很小,此时误差很小。

表1 Box-Behnken试验设计与结果Table 1 Box-Behnken test design and result

表2 Box-Behnken试验结果方差分析Table 2 Box-Behnken test results analysis
2.4 链格孢菌SC-018的最适接种浓度
由表3可知,链格孢菌SC-018孢子浓度大于每毫升1.0×105个的处理均能在叶片上形成明显病斑。2.0×106个·mL-1的菌悬液和1.0×106个·mL-1的菌悬液在接种野慈姑叶片上产生的病斑面积之间不存在显著差异,5.0×105个·mL-1的菌悬液和2.5×105个·mL-1的菌悬液虽也能使部分叶片出现病斑,但病斑面积明显变小。5μL的最低浓度(6.25×104个·mL-1)的菌悬液中的孢子数量仅为1个,大大降低了孢子成功侵染的几率。

表3 链格孢菌SC-018孢子浓度对病变面积的影响Table 3 Effects of spore concentration of Alternaria alternata SC-018 on lesion area

图5 不同时期接种对链格孢菌SC-018孢子致病力的影响Figure 5 Effects of different infection stages on pathogenicity of Alternaria alternata SC-018 spore
2.5 野慈姑的最佳接种时期
由图5可知,链格孢菌SC-018接种1~2叶期的野慈姑发病最严重,2~3叶期和3~4叶期的发病严重程度逐渐降低,1叶期发病严重度最低。因此,1~2叶期为野慈姑的最佳接种期。
2.6 环境因子对链格孢菌SC-018致病性的影响
2.6.1 温度 由图6可知,在15,19℃时,野慈姑植株不发病;当环境温度为22~28℃时,野慈姑植株发病严重程度递增,但25℃和28℃处理之间并不存在显著差异;而当环境温度上升至30℃及以上时,野慈姑植株的发病严重程度反而降低。由此可见,25~28℃为该菌成功侵染野慈姑从而导致发病的最佳温度。
2.6.2 光照 由图7可知,接种后一定时期的黑暗条件有利于孢子的萌发和侵染,而黑暗时期持续时间的长短则于该菌对野慈姑的侵染效果无明显影响;24h全光照条件下孢子虽然也能萌发侵染,但效果显然不如前者,每日光照10h/黑暗14h最利于该菌侵染野慈姑并致其发病。由于杂草野慈姑在水稻田中较为常见,而水稻作为一种长日照喜温作物,其生长时期的光照条件完全可以满足链格孢菌SC-018侵染所需。

图 6 温度对链格孢菌SC-018侵染野慈姑的影响Figure 6 Effects of Alternaria alternata SC-018 at different temperature on the infection of Sagittaria trifolia
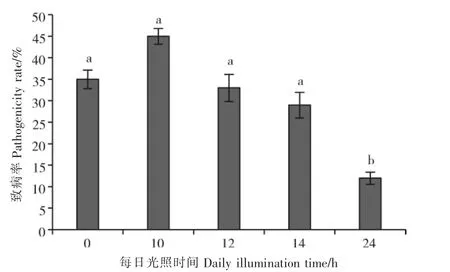
图7 光照对链格孢菌SC-018侵染野慈姑的影响Figure 7 Effects of Alternaria alternata SC-018 at different illumination time on the infection of Sagittaria trifolia
2.6.3 结露时间 由表4可知,结露12h以上就可在叶片上看到明显病斑,48h和72h处理的发病率之间无显著差异。但当结露时间低于24h时,链格孢菌SC-018侵染野慈姑只能在叶片上形成病斑却不能引起野慈姑死亡,结露时间大于48h则可引起90%以上的接种野慈姑死亡。
3 讨论与结论
培养基可提供微生物生长、繁殖和代谢所需要的营养物质,它的成分和配比的合适与否对菌株的生长发育具有重要的影响,尤其是碳、氮源对任何菌株的生长和代谢都是最主要的影响因子。为了探究链格孢菌SC-018的最适生长条件,通过单因素试验对其培养基中的碳源及氮源进行了选择,对培养基初始pH值、培养温度进行了筛选。将单因素试验所筛选出的碳源、氮源与培养温度及初始pH值4个因素进行响应面Box-Behnken试验。研究结果表明,优化后的培养工艺为马铃薯浸出液 1000mL,D-半乳糖21.50g·L-1,硝酸钠 3.159g·L-1,初始 pH值7.81,培养温度 25.94℃。
致病能力是衡量一种生防真菌是否适宜作为除草剂的关键,本研究建立了链格孢菌SC-018防除野慈姑致病性效果的温室测定体系,即按照GLP(good laboratory principle)培育获得1~2叶期的野慈姑作为供试植物,配制浓度大于每毫升1.0×105个孢子的链格孢菌SC-018孢子悬浮液作为接种体,培养温度28℃,10h光照/14h黑暗交替以及结露达到90%以上的时间大于48h的温室环境。在该温室体系下进行链格孢菌SC-018防除野慈姑致病性效果的检测,48h即可观察到野慈姑发病死亡,且可以保证发病稳定。
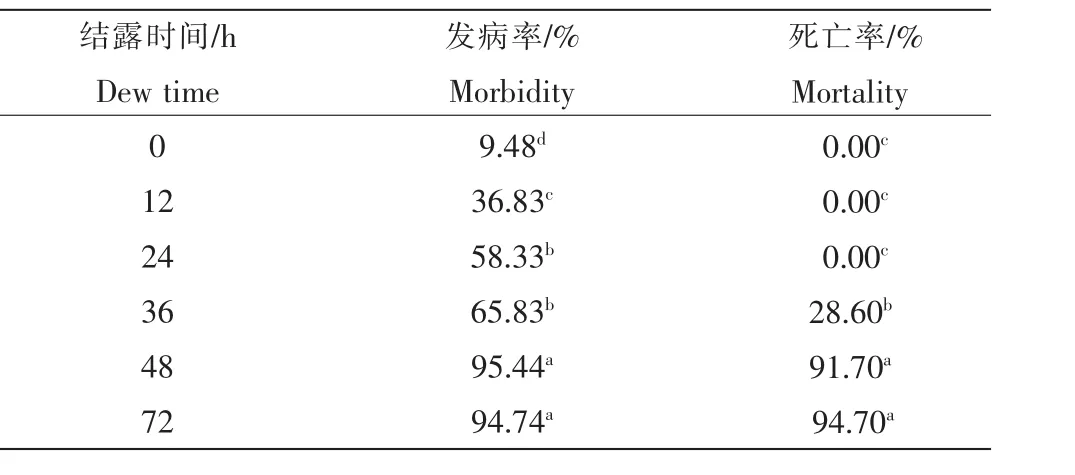
表4 结露时间对链格孢菌SC-018侵染野慈姑的影响Table 4 Effect of dew time on Alternaria alternata SC-018 infection of Sagittaria trifolia
