胰腺神经内分泌肿瘤8例临床及病理特征分析*
2019-04-26郭庆喜卢子剑刘祖平孙兴旺
刘 云,郭庆喜,卢子剑,冯 健,石 敏,刘祖平,孙兴旺△
(1.西南医科大学基础医学院,泸州 646000;2.西南医科大学附属医院病理科,泸州 646000;3.西南医科大学附属医院心血管内科,泸州 646000)
胰腺神经内分泌肿瘤(PNEN)是一类罕见的肿瘤,在所有胰腺肿瘤中所占比率较低(1%~2%)[1],近几年其发病率和患病率呈上升趋势。根据WHO(2017)内分泌肿瘤的新分级标准,PNEN分为胰腺神经内分泌瘤(PNET,包括G1、G2、G3级)、胰腺神经内分泌癌(PNEC)和胰腺混合性神经内分泌-非神经内分泌肿瘤(PMi-NEN)[2]。该病缺乏特征性的临床表现,病因及发病机制尚不明确,临床上容易误诊。本文旨在探讨PNEN的临床病理特点,提高临床病理诊断的准确性。
1 资料与方法
1.1一般资料 收集2005年1月至2018年1月西南医科大学附属医院PNEN病例为研究对象,排除仅接受活检而未接受腔内切除或标准胰腺切除的病例。参照WHO(2017)内分泌肿瘤的新分级标准,对该组8例病例进行重新评估分级,并整理其临床、影像及病理资料。患者及家属知情同意。
1.2方法 标本均由10%中性福尔马林固定,再进行石蜡包埋、切片、HE染色,免疫组织化学采用EnVision法染色。所用抗体CgA、NSE购自广州深达生物制品技术有限公司,Syn、CD56、CK19、TP53购自福州迈新生物技术开发有限公司,Ki-67、RB1、ATRX购自北京中杉金桥生物技术有限公司,DAXX购自西格玛奥德里奇上海贸易有限公司。评估Ki-67阳性率时,在核标记最强区域至少计数500个细胞的阳性百分比,且计数方法使用“对打印图像进行手动计数”法[2];ATRX和DAXX的内部阳性对照为淋巴细胞、内皮细胞或基质细胞等非肿瘤细胞的核阳性染色,出现肿瘤细胞中明确核表达时定义为阳性,细胞质染色被定义为非特异性染色[3]。本研究中临床分期主要参考改良ENETS分期[4]。
2 结 果
2.1临床特征 8例PNEN患者,男4例,女4例;年龄15~62岁,中位数45岁。2例属于功能性肿瘤,出现反复腹泻、低血糖等激素分泌异常引起的临床综合征;6例属于无功能性肿瘤,多无症状或因出现腹痛、腹胀、乏力等症状时偶然发现。3例位于胰头部,2例位于胰体尾部,3例位于胰尾部。8例均行手术治疗,术后均未进行放、化疗。本组病例8例行CT检查,均检出病灶,平扫多表现为结节状稍低密度或等密度影,其中3例伴有囊肿形成,该区域呈低密度或高低密度混杂影,增强CT示动脉期明显强化,静脉期强化同正常胰腺;5例同时行腹部B超检查,4例发现胰腺病灶,检出率为80.0%;2例同时行MRI检查,均检出病灶。例1、2为PNET G1级,例3~6为PNET G2级,例7、8为PNEC,见表1、图1。
2.2病理特征
2.2.1眼观 肿瘤外观均为灰白、灰黄色的实性或囊实性结节,最大径1.5~10.0 cm,中位数6.0 cm。5例与周围胰腺组织分界清楚,3例分界欠清,均可见包膜,其中5例包膜完整。4例肿瘤切面质软,4例质稍硬;2例切面有出血坏死,见表1。
2.2.2镜检 显微镜下8例肿瘤均可见厚薄不一的纤维包膜,间质有丰富的血窦。PNET G1级肿瘤细胞由大小、形态较一致小圆细胞构成,呈梁状、带状或脑回状生长,有“器官样”排列特点,染色质呈细颗粒状,核质比例小,核分裂象少见;PNEC肿瘤细胞大小不一,呈实体性生长,核质比例大,核大而深染或呈空泡状,核仁明显,核分裂象多见,并见出血及坏死改变;PNET G2级镜下特点介于二者之间,肿瘤细胞排列方式多样,有梁索状、假菊形团状、脑回状、腺泡状、实体性等,偶见核分裂象。8例肿块均未见淋巴结转移,3例可见血管、神经侵犯,见表1、图2。

A:动脉期明显强化,伴有囊变形成;B:静脉期强化同正常胰腺
图1 PNEN的增强CT表现(箭头示)
2.2.3免疫表型 8例病例中CgA阳性率87.5%(7/8),Syn阳性率75.0%(6/8),未出现CgA、Syn同为阴性的病例。NSE阳性率为87.5%(7/8)。CD56阳性率为87.5%(7/8),CD56在PNET中表达较好,在PNEC中表达较差。ATRX阳性率87.5%(7/8),仅有1例PNET G2级肿瘤ATRX蛋白表达缺失,该病例预后较差,术后4个月出现肝转移,21个月死亡,DAXX均为阳性。TP53阳性率12.5%(1/8),仅1例PNEC阳性,该病例术后生存期为3个月。RB1均为阳性,无蛋白表达缺失病例。EMA、PCK、CK、CD10、CD99、AAT等抗体标记在部分病例中可见阳性,见图2。
2.3随访 8例中7例获得随访,随访时间10个月至4年,中位数30个月,4例出现转移,其中2例为PNET G2级,2例为PNEC;其余患者均未见转移和复发,见表1。
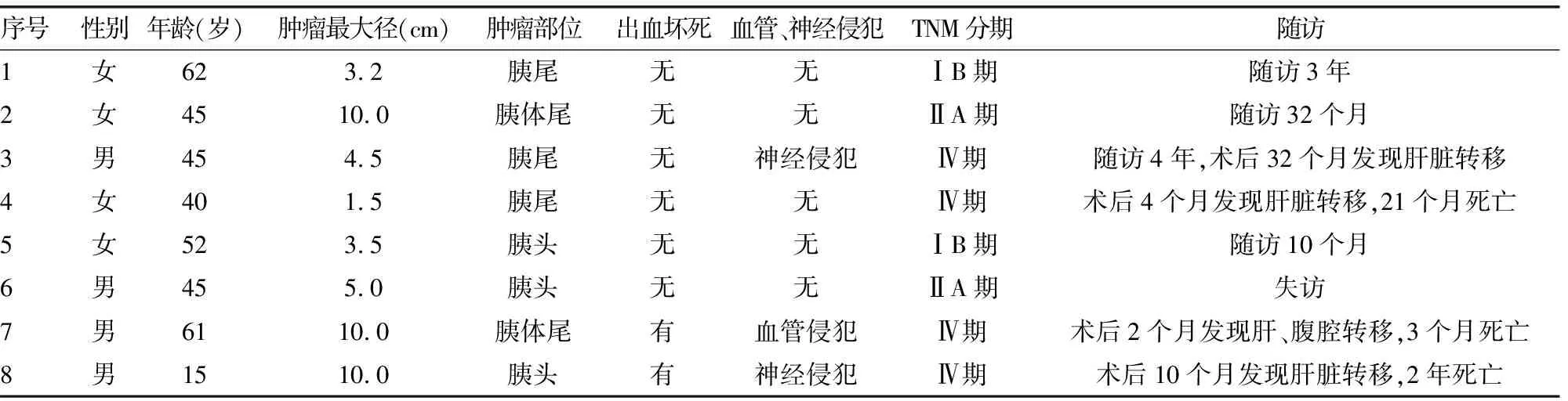
表1 8例PNEN患者的临床资料、生物学行为及随访

A:PNET G1级肿瘤细胞排列呈梁状、带状,HE染色;B:PNET G2级肿瘤细胞排列呈假菊形团状、梁索状,HE染色;C:PNEC肿瘤细胞排列呈实体性,细胞异型性显著,核分裂象多见,HE染色;D:多数肿瘤细胞CgA弥漫阳性表达,EnVision染色法;E:ATRX阳性,EnVision染色法;F:ATRX阴性,淋巴细胞、内皮细胞或基质细胞等非肿瘤细胞核表达为内部阳性对照,EnVision染色法
图2 PNEN的病理形态及免疫表型(×400)
3 讨 论
神经内分泌肿瘤遍布全身各部位,约2/3见于胃肠道和胰腺[5]。PNEN与胃、肠部位的神经内分泌肿瘤(NEN)有许多相同的病理和生物学特征,但它们的发病机制和治疗都有差异,因此需要将PNEN分开讨论。根据有无临床症状,PNEN可以分为两大类:功能性和无功能性,二者在形态学上并无差异。前者包括胰岛素瘤、胃泌素瘤、胰高血糖素瘤、生长抑素瘤、血管活性肠肽瘤等,具有因异常激素分泌导致的临床综合征;后者多因偶然检查或出现局部压迫症状而发现。无功能性肿瘤在PNEN中所占比例为50%~80%[6],且ZHANG等[7]回顾性分析我国人群中的大多数的胃、肠、胰部位的NEN是属于无功能性的。本组功能性肿瘤患者2例(25.0%),无功能患者6例(75.0%),与国内外报道一致。
病理组织学特点和免疫表型是PNEN确诊的主要依据。大多数的PNEN属于高分化[8](分为G1、G2、G3级),多为单发、边界清楚的小结节(约50%<1.5 cm),镜下肿瘤细胞大小、形态较一致,形似胰岛细胞,排列呈梁状、腺泡状、管状、假菊形团状,染色质呈细颗粒状,核分裂象少见,核轻至中度异型。低分化的肿瘤体积通常较大(中位直径4 cm),分界欠清,镜下肿瘤细胞小或中等大,多排列成巢或弥漫片状,核深染,有显著异型性,核质比例增大,核分裂象多见,常伴坏死。免疫组织化学既能辅助确诊,又可作为组织学分级依据。CgA是目前诊断PNEN最特异性的免疫组织化学指标,其阳性程度取决于分泌颗粒的数目,部分分化差的PNEN或者标本固定不当时可能为阴性;Syn是一种跨膜糖蛋白,敏感性高,特异性较CgA差,不受分泌颗粒数目的影响,对于诊断分泌颗粒较少或低分化的PNEN优于CgA,故常与CgA联合应用;其他对诊断有参考价值的神经内分泌指标还有CD56、NSE等。本组病例中CD56在PNET中表达较好,在PNEC中表达较差,这与隋燕霞等[9]研究一致。Ki-67是NEN病理分级的重要依据,可作为胃、肠、胰部位NEN的预后指标[10]。
WHO(2017)内分泌肿瘤的新分级标准引入一组高分化G3级胰腺肿瘤(PNET G3级),PNET G3级和PNEC在男性中更为常见,与本研究相符,二者的鉴别成为难点。有研究发现部分PNET G3级存在PNET G1/G2的成分,推测可能由G1/G2级逐渐发展而来[11]。PNET G3级和PNEC的遗传背景、治疗和预后均有差异,鉴别二者至关重要,目前尚缺乏明确的组织学标准,Ki-67和核分裂象也不能准确区分这两种病理实体。有研究发现免疫组织化学指标ATRX、DAXX、TP53、RB1可辅助鉴别,暗示PNEN的遗传背景。TP53、RB1基因在PNEC中更易发生突变,为分化不良的标志,免疫组织化学提示蛋白表达异常,即p53阳性,RB1阴性;ATRX/DAXX蛋白表达缺失存在于40%的PNET中,不存在于PNEC中[2,11-13]。本组病例中仅1例PNEC出现TP53表达异常,1例PNET G2级出现ATRX阴性,与上述文献一致。本研究局限性在于病例数太少,还需在较大临床研究中得到进一步证实,ATRX、DAXX、TP53、RB1有望成为鉴别PNET G3级和PNEC的常规免疫组织化学指标,并推广到其他部位的NEN中。
诊断PNEN时需注意与其他肿瘤相鉴别:(1)胰腺实性假乳头瘤(SPTP)是一类罕见的外分泌型胰腺肿瘤,呈低度恶性,其组织来源不明,多发生于18~35岁的年轻女性,男性罕见。显微镜下肿瘤含有不同比例的实性、假乳头状和囊性区域[14],假乳头区是肿瘤细胞围绕纤维血管轴心形成的假乳头状特征性区域,囊性区域附近通常可见泡沫样细胞、胆固醇裂隙、异物巨细胞等退行性改变[15]。SPTP和PNEN在组织形态上有一些相似之处,尤其是当SPTP的乳头状结构不明显时很难鉴别,需要行免疫组织化学来提高诊断的准确性。免疫标记β-catenin(核阳性)、Vimentin、CD10通常在SPTP中恒定表达,部分肿瘤细胞Syn表达阳性,但CgA、E-cad一般为阴性[16-17],PAS染色阳性是SPTP的组织学特征之一,大约在5%的PNEN中可出现阳性[18],应结合组织学特点及免疫组织化学指标一起鉴别。(2)腺泡细胞癌肿瘤细胞排列呈腺泡状、梁索状,易与PNEN混淆,主要区别在于腺泡细胞癌的胞浆呈颗粒状,核仁明显且鲜红。细胞核特征不明显时需结合免疫组织化学进行鉴别,腺泡细胞癌主要阳性表达的免疫标记有BCL10、CK-pan、胰蛋白酶及其他胰酶,应注意腺泡细胞癌可少量表达神经内分泌标志物[19]。除了与上述两种胰腺肿瘤鉴别外,还应鉴别的肿瘤有:胰母细胞瘤、肾透明细胞癌、低分化管状腺癌、上皮样胃肠间质肿瘤及胰腺转移性肿瘤。
PNEN均有恶性潜能,手术是最常见的干预措施,其他治疗方式还有化疗、靶向治疗及生物治疗等,其中生物和靶向治疗是目前研究的热点,生物治疗对于控制功能性PNEN的临床症状效果显著。PNEN的生存期总体来说较其他胰腺肿瘤更长,患者的5年生存率为30%~40%[7]。PNEN最容易出现远处转移的部位是肝脏,本组病例中4例发生了肝转移,其中2例为PNET G2级,2例为PNEC。临床上预测患者预后主要根据Ki-67指数、核分裂象、功能状态和TNM分期,然而PNEN的生物学行为个体差异很大,在个体水平预测患者预后仍然面临巨大挑战。ATRX/DAXX蛋白表达与预后的相关性争议较大,二者在肿瘤中表达缺失是相互排斥的。本组病例中1例ATRX阴性病例生存期仅3个月,预后较其他病例差。已有多项研究显示,ATRX/DAXX蛋白表达缺失,总体生存期缩短,并且还可能与驱动远处转移有关[3,20-22];但有两项研究得出ATRX/DAXX蛋白表达缺失,总体生存期延长[23-24],这可能与研究对象中高级别肿瘤所占比例过高或免疫组织化学阳性判定标准不同有关。CHOU等[3]在一项非选择性队列研究中发现,当ATRX/DAXX缺失时,总体生存期缩短,将ATRX和DAXX分别进行分析时,ATRX缺失仍然可以预测总体生存期缩短,但DAXX缺失时对预后的影响不明显,故ATRX更有望成为PNEN的独立预后因素。
