miR-145在心肌梗死大鼠心肌组织中的表达及意义
2019-04-26曾令勇黎荣黄俊刘亮余辉钱冉
曾令勇 黎荣 黄俊 刘亮 余辉 钱冉
(1咸宁市中心医院心血管内科,湖北 咸宁 437100;2湖北科技学院实验诊断教研室)
研究表明心肌梗死引起的心肌细胞凋亡是引起心肌梗死后心室重构和心力衰竭的主要原因,抑制心肌细胞凋亡可显著阻断心肌梗死的发生〔1,2〕。miRNAs是一种非编码RNA分子,可以和下游靶基因结合,调控靶基因转录或降解靶基因,从而对细胞的生长、增殖、分化、迁移、凋亡等生物学行为进行调控〔3〕。miR-145和血管平滑肌细胞表型分化关系密切,研究发现急性冠脉综合征患者血浆miR-145水平下降〔4〕,miR-145与缺氧诱导的H9c2细胞损伤有关〔5〕。但miR-145在心肌梗死中的表达及其对心肌梗死的作用机制研究不多。本文对miR-145在心肌梗死大鼠心肌组织中的表达及其在心肌梗死中的作用机制进行研究。
1 材料与方法
1.1材料 实验动物:清洁级、雄性、健康、SD大鼠258只,体重180~220 g,购自上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2008-0016。主要试剂:兔抗磷脂酰肌醇-3-激酶(PI3K)单克隆抗体、兔抗磷酸化蛋白激酶B(p-AKT)单克隆抗体、兔抗Bax单克隆抗体、兔抗Bcl-2单克隆抗体,甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔抗体(美国Epitmics公司),二喹啉甲酸(BCA)试剂盒、Trizol试剂盒、RT-PCR试剂盒(美国Tocris公司),miR-145寡核苷酸模拟物(mimics)和miR-145 mimics阴性对照(广州锐博生物科技有限公司合成),TUNEL检测试剂盒(武汉博士德生物技术有限公司)等。
1.2心肌梗死模型建立 通过冠状动脉左前降支结扎建立心肌梗死模型:水合氯醛麻醉成功后,剔除大鼠胸部和颈部毛发,碘伏溶液消毒颈部皮肤并做长1 cm切口,暴露气管、连接呼吸机;胸部皮肤消毒后在左侧第4根肋骨作为手术切口,剥离皮肤,暴露心脏,找到冠状动脉左前降支并结扎,心电图显示ST段弓背向上抬高,左心室变白为心肌梗死模型建立成功。
1.3miR-145水平测定 取78只大鼠,随机分为对照组和心肌梗死组,每组39只,对照组给予假手术处理(只进行冠状动脉左前降支穿线,不结扎),心肌梗死组建立心肌梗死动物模型。分别在建模1 d、3 d、7 d每组各处死13只大鼠,取大鼠心肌组织(心肌梗死组大鼠取梗死区心肌组织),进行心肌组织中miR-145水平测定。采用Trizol试剂盒提取各大鼠心肌组织总RNA,检测RNA纯度,采用RT-PCR法测定大鼠心肌组织miR-145表达:将RNA逆转录并进行PCR扩增,PCR反应条件为94℃ 45 s,59℃ 45 s,72℃ 60 s,共35个循环。miR-145相对表达量以2-ΔΔCt表示。
1.4大鼠慢病毒转染 另取180只大鼠根据随机数字法分为假手术组、心肌梗死组、阴性对照组和miR-145组,每组45只,心肌梗死组、阴性对照组和miR-145组大鼠建立心肌梗死模型(方法同上)。miR-145组大鼠心肌组织局部注射携带miR-145 mimics慢病毒(4×107个),阴性对照组大鼠心肌组织局部注射携带绿色荧光蛋白(GFP)慢病毒空载体(miR-145 mimics阴性对照,4×107个),心肌梗死组大鼠和假手术组大鼠心肌组织局部注射等量生理盐水,每天1次,共1 w。治疗结束后,假手术组、心肌梗死组、阴性对照组和miR-145组各分3个亚组,每组中每个亚组分别为15只、14只、13只、14只大鼠。一个亚组大鼠用于心功能检查和心肌梗死面积测定;一个亚组用于心肌细胞凋亡测定;一个亚组用于心肌组织中PI3K、p-AKT、Bax、Bcl-2蛋白和mRNA水平测定。
1.5各组大鼠心功能检查 治疗结束后,水合氯醛麻醉,采用心脏彩超检查,并记录各大鼠的左心室收缩末期内径(LVDs)、左心室舒张末期内径(LVDd)、左心室长轴缩短分数(FS)、左心室射血分数(LVEF)等心功能指标。
1.6各组大鼠心肌梗死面积测定 上述大鼠心功能检查后处死大鼠,取心脏组织,将大鼠心脏沿横轴方向在心尖到结扎点之间进行切片,切片厚1 mm,进行TTC染色,红色心肌组织为正常心肌组织,白色心肌组织为梗死心肌组织,拍照后采用IMAGE PRO图像分析系统进行分析,计算心肌梗死面积占心肌面积的百分数。
1.7各组大鼠心肌细胞凋亡测定 取大鼠心肌组织,石蜡包埋后进行切片,采用TUNEL法测定心肌凋亡指数(具体方法严格按照试剂盒说明书进行),二脒基苯基吲哚染色后,凋亡细胞呈棕黄色,在200倍光镜下计算细胞凋亡指数,细胞凋亡指数=凋亡细胞/细胞总数×100%。
1.8各组大鼠心肌组织中PI3K、p-AKT、Bax、Bcl-2蛋白水平测定 取各大鼠心肌组织,匀浆,加入细胞裂解液裂解30 min,提取心肌组织总蛋白,采用BCA测定心肌组织蛋白浓度,采用Western印迹法测定心肌组织中PI3K、p-AKT、Bax、Bcl-2蛋白水平,一抗为兔抗PI3K单克隆抗体、兔抗p-AKT单克隆抗体、兔抗Bax单克隆抗体、兔抗Bcl-2单克隆抗体,GAPDH单克隆抗体为内参照,PI3K、p-AKT、Bax、Bcl-2蛋白的相对表达量=PI3K、p-AKT、Bax、Bcl-2蛋白条带灰度值/GAPDH条带灰度值。
1.9各组大鼠心肌组织中PI3K、p-AKT、Bax、Bcl-2 mRNA水平测定 采用RT-PCR测定各组大鼠心肌组织中PI3K、p-AKT、Bax、Bcl-2 mRNA水平,具体方法同心肌组织miR-145表达量测定。
1.10统计学方法 采用SPSS20.0软件进行方差分析、LSD-t检验。
2 结 果
2.1各组大鼠存活情况 假手术组大鼠存活45只,心肌梗死组大鼠建模成功并存活42只,阴性对照组大鼠建模成功并存活40只,miR-145组大鼠建模成功并存活42只。
2.2不同时间点心肌梗死大鼠梗死区心肌组织中miR-145水平 建模1、3、7 d,心肌梗死组miR-145水平均显著低于对照组(P<0.001)。见表1。

表1 不同时间点心肌梗死组和对照组心肌组织中miR-145水平比较
2.3各组心肌组织中miR-145表达量及大鼠心脏功能比较 与假手术组比较,心肌梗死组和阴性对照组及miR-145组miR-145相对表达量明显降低(P<0.05);与心肌梗死组和阴性对照组比较,miR-145组miR-145相对表达量明显升高(P<0.05);心肌梗死组和阴性对照组miR-145相对表达量比较差异无统计学意义(P>0.05)。与假手术组比较,心肌梗死组、阴性对照组LVDs和LVDd显著升高(P<0.05),FS和LVEF显著降低(P<0.05);与心肌梗死组和阴性对照组比较,miR-145组大鼠LVDs和LVDd显著降低(P<0.05),FS和LVEF显著升高(P<0.05);心肌梗死组和阴性对照组大鼠LVDs、LVDd、FS、LVEF比较差异无统计学意义(P>0.05)。见表2。
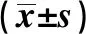
表2 各组大鼠心脏功能及心肌组织中miR-145相对表达量、心肌梗死面积和凋亡指数比较
与假手术组比较:1)P<0.05;与心肌梗死组比较:2)P<0.05;与阴性对照组比较:3)P<0.05;下表同
2.4各组心肌梗死面积和凋亡指数比较 假手术组无心肌梗死。与假手术组比较,心肌梗死组和阴性对照组及miR-145组心肌凋亡指数显著升高(P<0.05);与心肌梗死组和阴性对照组比较,miR-145组心肌梗死面积和凋亡指数显著降低(P<0.05);心肌梗死组和阴性对照组心肌梗死面积和凋亡指数比较差异无统计学意义(P>0.05)。见表2、图1和图2。
2.5各组心肌组织中PI3K、p-AKT、Bax、Bcl-2蛋白及mRNA水平比较 与假手术组比较,心肌梗死组和阴性对照组及miR-145组Bax蛋白水平及mRNA相对表达量均显著升高(均P<0.05),PI3K、p-AKT、Bcl-2蛋白水平及mRNA相对表达量均显著降低(均P<0.05);与心肌梗死组和阴性对照组比较,miR-145组Bax蛋白水平及mRNA相对表达量均显著降低(均P<0.05),PI3K、p-AKT、Bcl-2蛋白水平及mRNA相对表达量均显著升高(均P<0.05);心肌梗死组和阴性对照组PI3K、p-AKT、Bax、Bcl-2蛋白水平及mRNA相对表达量比较差异无统计学意义(P>0.05)。见表3、图3。
图1 各组大鼠心肌梗死面积

箭头所示为凋亡细胞图2 各组大鼠心肌组织TUNEL染色(×200)
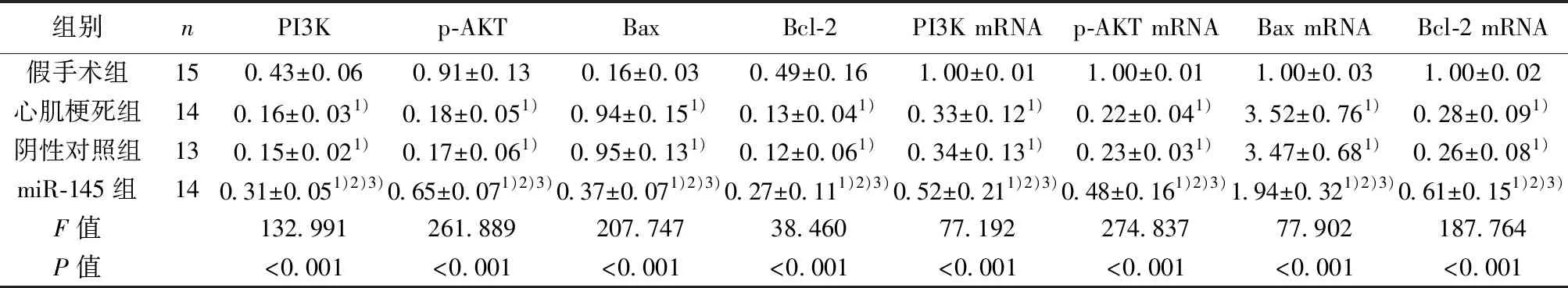
组别nPI3Kp-AKTBaxBcl-2PI3K mRNAp-AKT mRNABax mRNABcl-2 mRNA假手术组150.43±0.060.91±0.130.16±0.030.49±0.161.00±0.011.00±0.011.00±0.031.00±0.02心肌梗死组140.16±0.031)0.18±0.051)0.94±0.151)0.13±0.041)0.33±0.121)0.22±0.041)3.52±0.761)0.28±0.091)阴性对照组130.15±0.021)0.17±0.061)0.95±0.131)0.12±0.061)0.34±0.131)0.23±0.031)3.47±0.681)0.26±0.081)miR-145组140.31±0.051)2)3)0.65±0.071)2)3)0.37±0.071)2)3)0.27±0.111)2)3)0.52±0.211)2)3)0.48±0.161)2)3)1.94±0.321)2)3)0.61±0.151)2)3)F值132.991261.889207.74738.46077.192274.83777.902187.764P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001

A:假手术组,B:心肌梗死组,C:阴性对照组,D:miR-145组图3 各组大鼠心肌组织中PI3K、p-AKT、Bax、Bcl-2蛋白Western印迹电泳
3 讨 论
miRNAs为一类高度保守的小RNA,长18~25 nt,可以和靶基因3′-UTR区域结合,抑制靶基因翻译,从而调控细胞的增殖、分化和凋亡等,研究发现miRNAs和心肌缺血再灌注损伤、心肌梗死、心脏重构、心力衰竭等心血管疾病的发生发展关系密切〔6〕。miR-145位于人类染色体5q32上,有23个核苷酸组成,miR-145在血管平滑肌中高度表达,参与血管平滑肌的增殖和收缩表型的维持〔7,8〕,和动脉血管平滑肌的增殖和迁移关系密切〔9〕。研究发现miR-145在心脑血管疾病的发生发展中具有重要作用,如姜春玲〔10〕研究发现急性冠脉综合征患者外周血单核细胞miR-145水平下降。Xu等〔11〕研究发现miR-145过表达可以通过靶向细胞程序性死亡基因(PDCD)4预防大鼠心肌梗死。Zhang等〔12〕研究发现急性心肌梗死的发生与血浆miR145水平降低有关,血浆miR145水平可用于预测心脏功能和心力衰竭的发生风险。Higashi等〔13〕研究发现miR-145可通过心肌细胞自噬修复梗死的心肌组织。但miR-145在心肌梗死心肌组织中的表达及其对心肌梗死的影响尚不十分清楚,本研究建立心肌梗死大鼠模型,发现心肌梗死大鼠心肌组织中miR-145水平下降,向梗死心肌组织中注射miR-145可减少心肌梗死面积,降低心肌凋亡指数,改善心功能,本研究结果提示miR-145参与心肌梗死的发生发展过程,miR-145可通过降低心肌细胞凋亡发挥保护心肌的作用。
细胞的凋亡受多种信号通路调控,PI3K/AKT具有抗凋亡通路之称,是调控细胞凋亡信号通路中的一种〔14〕,PI3K/AKT信号通路可通过调控其下游的Bcl-2和Bax等多种靶蛋白的表达发挥对细胞生长、分化、凋亡、侵袭、迁移及血管形成等病理生理过程〔15,16〕。在心肌梗死中PI3K/AKT信号通路失活,激活PI3K/AKT信号通路可抑制心肌细胞凋亡〔17~19〕。在心肌缺血再灌注中,PI3K/AKT信号通路的激活及其对Bcl-2和Bax的调控可减少心肌细胞凋亡〔20,21〕。miR-145的生物学作用与PI3K/AKT信号通路的关系也比较密切,有研究发现miR-145通过PI3K/AKT信号通路卵巢上皮癌的发生发展〔22〕。本研究结果发现心肌梗死大鼠心肌组织中PI3K、p-AKT、Bcl-2水平降低,Bax水平升高,对梗死心肌组织中注射miR-145后大鼠心肌组织中PI3K、p-AKT、Bcl-2水平升高,Bax水平降低。本研究结果表明miR-145可能通过激活PI3K/AKT信号通路及调控PI3K/AKT下游Bcl-2和Bax靶蛋白水平发挥对心肌梗死大鼠心肌细胞凋亡的抑制作用。
