利用高内涵筛选显微镜技术评估培养的间充质干细胞衰老程度
2019-04-26刘佳李钢周婷婷陈丹娜
刘佳 李钢 周婷婷 陈丹娜
(1长沙医学院基础医学院,湖南 长沙 410219;2长沙市第四医院血液科)
间充质干细胞(MSCs)是来源于中胚层的非造血干细胞,主要取材于骨髓,现在也在开发脐血、脂肪组织等来源,其有着较好的自我更新能力、多向分化能力及低免疫源性,在自身免疫性疾病和移植物抗宿主病(GVHD)、神经系统疾病、心血管疾病、泌尿系统疾病、肝疾病、运动系统疾病等方面都有广泛的应用前景。衰老过程影响MSCs的功能,导致分化能力和免疫抑制力的降低,这恰巧是MSCs在细胞治疗中的主要价值〔2〕。用于临床治疗使用的细胞必须评估衰老,以保障医疗安全。目前,有多种方法可用于评估衰老,但多数方法过于繁琐。本研究主要探讨高内涵筛选显微镜技术对于培养中的MSCs衰老评估的有效性。
1 材料与方法
1.1主要试剂盒和仪器 人骨髓MSCs分离试剂盒购自天津灏洋TBD公司,端粒长度测定试剂盒购自瑞士罗氏公司,组织样本DNA提取纯化试剂盒购自美国Qiagen公司,SA-β-gal检测试剂盒购自美国Biolabs公司。高内涵筛选显微镜购自美国Thermo公司,在北京鼎国昌盛生物技术公司进行细胞拍摄。
1.2MSCs来源 MSCs是4名健康成人志愿者在签订知情同意书后,在长沙第四医院血液科无菌室从其髂嵴处抽取骨髓分离。捐赠者匿名,年龄为23~36岁,男女各半,编码S1~S4。实验方案得到长沙医学院和长沙市第四医院伦理委员会批准。
1.3实验方法
1.3.1骨髓MSCs的获取、鉴定和培养 从抽取的骨髓中利用试剂盒分离MSCs,从原代开始连续培养到衰老,传代数用p表示。MSCs以低糖DMEM(含10%胎牛血清和双抗)进行培养。MSCs鉴定根据国际细胞治疗协会(ISCT)指南〔3〕进行,通过流式细胞仪鉴定细胞表面抗原,通过von Kossa染色和苏丹Ⅲ染色进行成骨和脂肪分化分析〔4〕;在培养过程中,用倒置显微镜进行细胞观察。当达到80%的汇合时,细胞通过胰蛋白酶消化,以1×104/ml的密度进行传代,直至衰老。在第2、4、6和8代(表示为p2、p4、p6、p8)收集细胞进行分析。
1.3.2图像分析的样本准备、采集和分析 p2、p4、p6、p8细胞在6孔板以1×104/ml密度接种,在48 h的附着和增殖后,细胞以4%多聚甲醛固定,0.1%Triton X-100处理后,以1 μg/ml Mask Deep Red染色细胞质,以0.125 μg/ml DAPI染色细胞核。细胞核和细胞质的图像是在385 nm和630 nm处分别采集信号形成的。细胞拍摄时选取6孔板中间部分,当1个目标只包含1个细胞核且细胞轮廓完全出现在拍摄视野中时,被认为是一个符合要求的细胞。符合标准的以绿线界定细胞轮廓,不符合标准的用紫红线界定。每个样本中分析3次并取均值,以校正数据。所得到的图像是用高内涵筛选显微镜配套的Thermo Scientific软件进行面积计算。
1.3.3端粒长度的Southern印迹分析 端粒长度是通过对末端限制片段(TRFs)的Southern印迹分析来测定的。利用组织样本试剂盒分离并纯化基因组DNA。端粒长度分析是用端粒长度测定试剂盒来进行的:先用HinfI和RsaI消化2 μg基因组DNA,电泳分离。分离后的DNA转移到尼龙膜,紫外交联仪进行交联。用地高辛(DIG)标记的端粒特异性探针(TTAGGG)进行12 h杂交,加入抗DIG抗体后放射自显影,利用ImageJ分析软件计算端粒长度。每个样本测定3次,以均值作图。
1.3.4衰老相关的β-半乳糖苷酶(SA-β-gal)活性检测 SA-β-gal活性用细胞衰老检测试剂盒来测定。首先破裂细胞膜,收集细胞内蛋白质,荧光标记SA-β-gal,以等量的总蛋白质进行检测。荧光信号在360 nm处激发,465 nm读取,结果表示为相对荧光单位(RFU)。每个样本检测3次,以均值作图。
1.3.5统计学方法 使用SPSS10.0软件进行方差分析、LSD-t检验。
2 结 果
2.1不同代的MSCs细胞形态 细胞衰老的判定标准为经过14 d的培养,细胞汇合依然低于30%,细胞呈现大而扁平或不规则的形态,颗粒数量激增。S1~S4 4个样本细胞从原代培养至衰老平均为9代,培养时间为(95±17)d。高内涵筛选显微镜成像后可以发现,在原代至p4,细胞小、呈现纺锤形,4个样本的细胞接种2 d后都处于对数生长期,培养时间为6~8 d。p5、p6开始,细胞生长速度缓慢降低,每一代时间为9~11 d。p8~p10,多数细胞停止了增殖,显示了衰老细胞的典型特征,如大尺寸、不规则形状和颗粒度(图1)。其中样本S3进入衰老最早,p8细胞经过14 d培养,汇合比率始终无法达到30%。
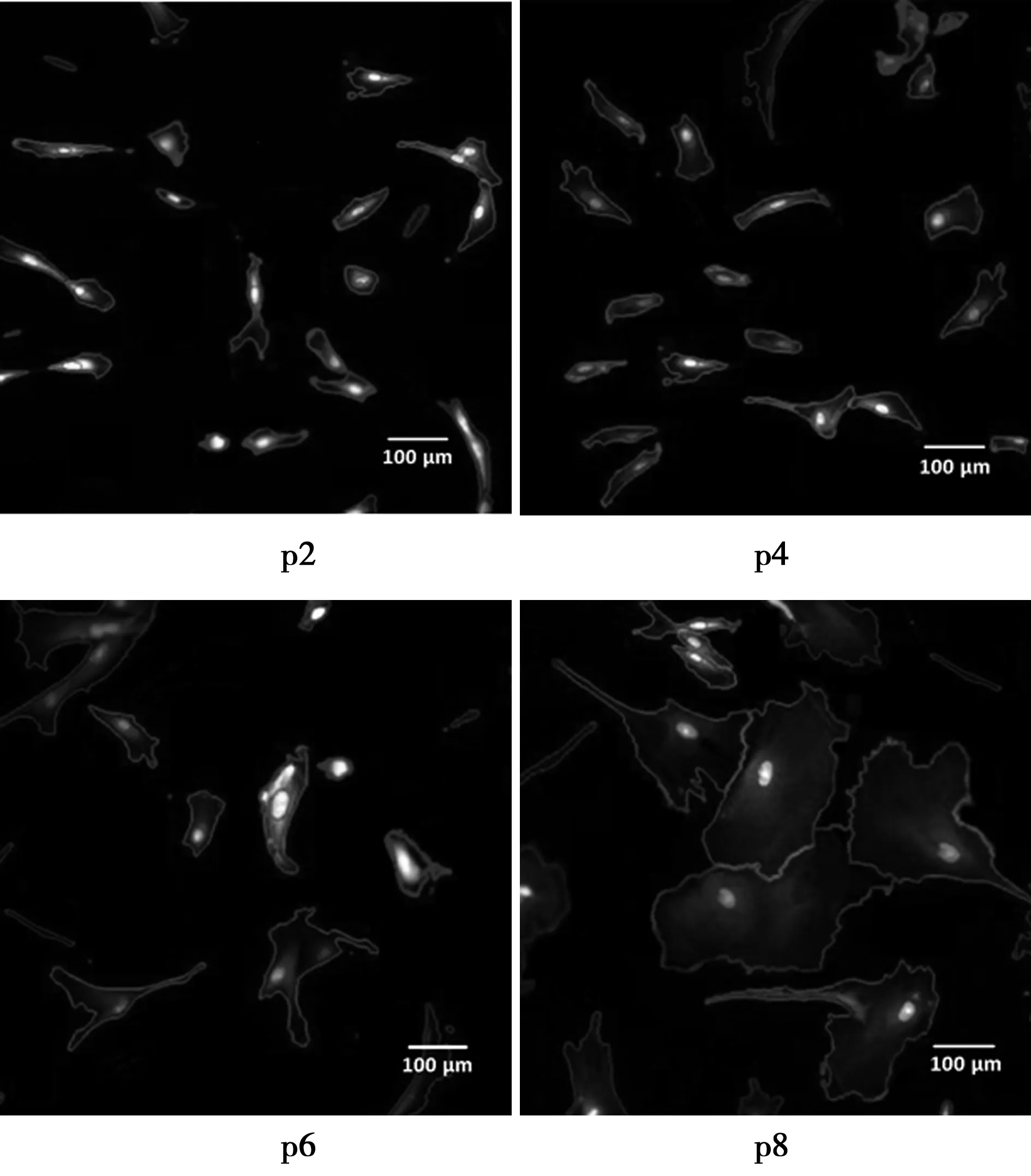
图1 高内涵筛选显微镜下各代细胞的图像分析(×100)
2.2细胞面积的增加 p2 MSCs细胞面积小,形态并不很一致。p4时各样本面积略增,均一性好。p6细胞形态开始不规则,面积增大。p8多数细胞面积显著增大,也有少量小细胞,p2、p4、p6、p8细胞大小呈现逐步显著增大趋势(P<0.05)。见表1。考虑到细胞汇合作为传代指标,细胞尺寸的增加侧面反映了传代晚期各组细胞数目的减少,培养时间延长则提示细胞增殖能力下降。
2.3衰老标记物的表达 随着MSCs培养时间延长,端粒逐渐缩短,p2、p4、p6、p8端粒长度差异有统计学意义(P<0.05)。p2、p4、p6、p8细胞SA-β-gal活性呈现逐步显著增加趋势(均P<0.05)。见表1。

表1 不同细胞代数细胞面积、端粒长度、SA-β-gal活性比较
与p2比较:1)P<0.05;与p4比较:2)P<0.05;与p6比较:3)P<0.05
3 讨 论
MSCs是一种多效的基质细胞群,可从骨髓、脂肪组织、脐血等多种来源中分离出来,有分化为成骨细胞、软骨细胞和脂肪细胞等多种细胞的能力,被归类为多功能干细胞〔5〕,可以用于各种组织再生〔6〕。除了多向分化能力外,MSCs也有很强的免疫抑制潜力,因此被用于GVHD〔7〕,对免疫性疾病可能也有效果。国际细胞治疗协会对MSCs鉴定标准是贴壁的成纤维细胞样细胞,表达特异性表面抗原,缺乏造血标志物,并能分化为成骨细胞和脂肪细胞。现在用于临床的细胞治疗MSCs通常是从抽取的骨髓中分离的,有效成分是其中的微量的单核细胞部分。而临床治疗需要大量的细胞,MSCs势必要在体外扩增来满足需要〔8〕。扩增时,复制性衰老开始启动。MSCs应属于有限生命周期的细胞,培养的MSCs会逐渐衰老,导致细胞分裂永久地停滞,虽然细胞在一段时间内仍然存活,但已经失去产生后代的能力了〔9〕。衰老可能危害用于临床治疗的产品质量和安全性。对衰老程度准确评估,可以检测衰老相关的DNA甲基化变化来评估细胞产品,但方法很烦琐〔10〕。如果能找到一个节省人力和成本效益的方式,在MSCs进行培养可即时判断,无疑可以更全面的监测MSCs质量。
监测细胞形态变化是可以作为保障MSCs生产的重要手段。端粒随着细胞分裂而缩短,反映细胞和机体的生物学年龄。当细胞最短的端粒达到其临界最小长度时,就会触发衰老〔11〕。除了端粒缩短,衰老也伴随着细胞的SA-β-gal增加〔12〕。本研究确定了细胞形态、面积变化和衰老的联系,其中最容易观察到的细胞衰老的指标是细胞大小和形态的变化,年轻的细胞多呈现小的纺锤形,衰老细胞则是大而不规则形状。本研究利用高内涵筛选显微镜对细胞面积进行精确计算,这是一种高效自动荧光图像采集和定量分析的筛选系统。检测发现p2、p4细胞小且均匀,平均细胞面积及其变异在p6后迅速增加。与此同时,SA-β-gal表达显著增加,端粒显著缩短。综合分析细胞面积与两个衰老标记物之间的相关性,发现细胞面积和端粒长度大致呈负相关性,细胞面积和SA-β-gal活性有着很强的正相关性,因此细胞面积也可作为衰老检测的一个显著指标。衰老引起的面积增加可以很容易检测到,而且重复性好,有利于将这一无创的显微技术用于常规的干细胞生产中,来判定培养的细胞衰老情况。
本研究观察到样本S3的细胞面积在早期就有明显增加,与其他细胞样本相比,S3的端粒开始就更短,SA-β-gal表达就更显著。这很可能与捐赠年龄有关:其他捐赠者年龄23~29岁,而供体S3为36岁。供者年龄高导致这样的现象,其他研究也得出了类似的结果〔13,14〕。本研究表明,细胞面积的增加确实可以作为MSCs培养中判定衰老的有效指标。Whitfield等〔15〕利用筛选显微镜来分析培养中的MSCs变化,在6 d的时间里连续不断地记录MSCs变化,将大于7 000 μm2定义为大细胞,并发现所有这些细胞都是SA-β-gal阳性。这从侧面证实了本研究。
