丹红注射液通过脂代谢通路对糖尿病大鼠肾脏的保护作用研究*
2019-04-25李贵森1
杨 雪,肖 祥,李 怡,钟 翔,王 莉,李贵森1,△
(1.西南医科大学临床医学院,四川泸州 646000;2.四川省医学科学院/四川省人民医院肾内科,成都 610072)
糖尿病肾病(DKD)是以蛋白尿和进行性肾功能损害为主要特征的糖尿病微血管并发症之一,并且也是终末期肾脏病(ESRD)的主要原因。近年来,随着经济的发展、城市化进程、人口老龄化和生活饮食方式的改变,糖尿病的患病率逐年增高。2007-2008年调查显示,我国成人糖尿病患病率为9.7%[1],而2010年的成人糖尿病患病率为11.6%[2]。人们一直在努力寻找治疗DKD的新策略,但结果并不理想[3]。在最近一项纳入8 561例患有2型糖尿病和慢性肾脏病(CKD)患者的多国前瞻性随机对照研究(PRCT)中,由于阿利吉仑的严重不良事件(包括急性肾损伤、高钾血症、低血压和中风)试验被提前终止[4]。另一项研究表明,在患有2型糖尿病的CKD 4期患者中,二氢睾酮甲基不能降低ESRD或心血管疾病的死亡风险[5]。因此,寻找可以更有效地延缓或阻止DKD进展的药物刻不容缓。
丹红注射液是由传统中药丹参、红花科学配方经现代工艺提取精炼而成的复方注射液,其中丹参微寒性苦为君药,红花性温味辛为臣药[6]。研究表明,丹红注射液可以降低DKD患者尿清蛋白排泄率(UAER)和24 h尿蛋白水平[7-8]。本课题组前期的一项荟萃分析也发现,丹红注射液能够降低包括DKD在内的CKD患者的24 h尿蛋白、UAER、血肌酐(Scr)及尿素氮(BUN)水平[9]。动物实验发现,丹红注射液可以抑制糖尿病性db/db小鼠的糖尿病视网膜病和DKD的进展[10]。而在实验性DKD大鼠中,丹参酮ⅡA明显改善了肾脏的肥大和24 h尿蛋白排泄[11]。这些数据表明丹红注射液可以有效延缓DKD的进展,但丹红注射液的肾脏保护作用机制仍不清楚。 本研究探讨丹红注射液对DKD大鼠的保护作用及其潜在机制。
1 材料与方法
1.1实验动物分组及处理 雄性Sprague-Dawley大鼠(4~5周,200~250 g)由成都达硕生物科技有限公司提供。将大鼠置于12 h明暗交替的房间内(温度18~29 ℃,相对湿度40%~70%),自由进食与饮水。适应性喂养1周后,所有动物均进行左侧肾脏切除术,然后予以高脂饮食4周。选择3只大鼠作为正常对照组(NM组,n=3),其余大鼠禁食12 h,然后腹腔注射链脲佐菌素(38 mg/kg)。 72 h和7 d后,尾静脉取血测量葡萄糖水平,NM组血糖水平正常,模型组血糖水平大于16.7 mmol/L,视为造模成功。 将造模成功的大鼠分为丹红注射液组(DH组,n=4)和生理盐水组(NS组,n=3)。 DH组大鼠每天腹腔注射丹红注射液(2 mL/kg,2周),NM组和NS组大鼠每天腹腔注射生理盐水(2 mL/kg,2周)。
1.2方法
1.2.1肾功能和血脂检测 每组大鼠在给药后第10周收集尿液,并在麻醉处死后收集腹主动脉血样。使用全自动生化分析仪(日本Hitachi公司)测定BUN、Scr、胱抑素C(Cys-C)、24 h尿总蛋白(24 hTP)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)。
1.2.2肾组织病理学检查 在上述时间点处死大鼠后,取出右肾,4%多聚甲醛固定,石蜡包埋。制备3 μm石蜡切片,采用苏木素-伊红(HE)染色评估肾脏病理改变。
1.2.3微阵列分析 使用TRIzol®试剂(美国Invitrogen公司)提取大鼠肾脏总RNA(n=3),通过NanoDrop ND-1000 鉴定RNA浓度和质量。RNA完整性通过标准变性凝胶电泳进行评估。样品由Arraystar RNA Flash Labeling Kit标记,通过 Agilent SureHyb进行杂交。Agilent DNA微阵列扫描仪(部件号G2505C)洗涤、固定和扫描杂交阵列。 Agilent Feature Extraction软件(v11.0.1.1)用于捕获芯片探针信号值。采用Agilent GeneSpring GX v12.1软件对芯片进行标准化并选择差异表达mRNA(倍数变化大于或等于2.0,P≤0.05)。

表1 各组大鼠肾功能和血脂情况比较
a:P<0.05,与NM组比较;b:P<0.05,与NS组比较
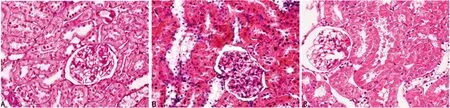
A:NM组;B:NS组;C:DH组
图1 各组大鼠肾脏HE染色(×400)
1.2.4免疫组织化学染色 在给药后第10周麻醉后处死大鼠,取出右肾,用4%多聚甲醛固定,然后进行石蜡包埋并制备3 μm石蜡切片。常规脱蜡水化,使用柠檬酸缓冲液高温高压抗原修复法修复组织抗原。山羊血清封闭,抗过氧化物酶体增殖物激活受体γ(PPARγ)抗体(美国Proteintech公司)4 ℃孵育切片过夜。磷酸缓冲盐溶液4 ℃孵育切片过夜作为阴性对照。山羊抗兔二抗室温孵育切片30 min。DAB显色液显微镜下显色。

2 结 果
2.1肾功能和血脂 NS组大鼠的BUN、Cys-C、24 h TP、TC和LDL-C均高于NM组,而HDL-C明显低于NM组,差异有统计学意义(P<0.05)。与NS组比较,DH组大鼠的Scr、Cys-C、24 hTP、TC和LDL-C均降低,而HDL-C明显升高,差异有统计学意义(P<0.05),见表1。
2.2肾脏病理 NS组大鼠肾脏病理改变主要表现为肾小球体积增大,系膜基质增生,系膜细胞增多,基底膜增厚等。 与NS组相比,DH组大鼠的上述肾脏病理损伤在丹红注射液治疗后明显减轻,见图1。

图2 NS组和DH组差异表达的mRNA
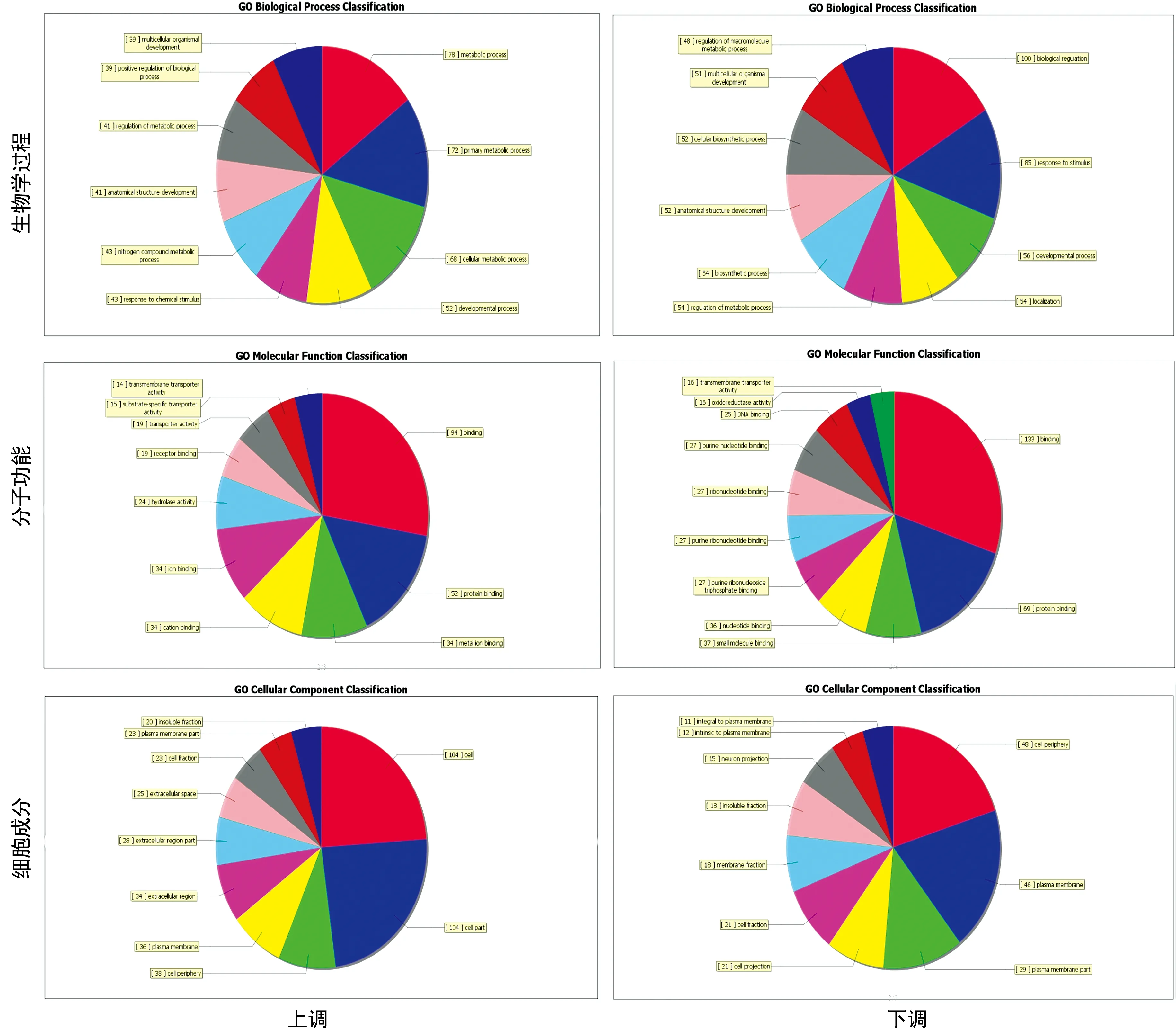
图4 NS组和DH组差异表达的mRNA的GO分析结果
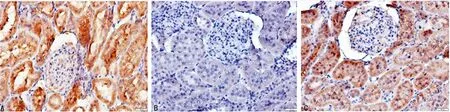
A:NM组;B:NS组:C:DH组
图5 各组肾脏组织PPARγ的表达情况(×400)
2.3微阵列分析 使用微阵列分析鉴定DH组和NS组之间差异表达的mRNA,共筛选出464个差异表达mRNA。与NS组比较,DH组上调185个mRNA,下调279个mRNA,见图2。KEGG通路富集分析结果显示,与NS组比较,DH组上调的差异表达mRNA的前16条富集通路中有3条通路与脂代谢相关,包括PPAR信号通路、脂肪细胞因子信号通路及脂肪的消化和吸收通路,相关的基因包括ACSBG1、ADIPOQ、FABP4、RGD1565355、SLC27A5、UCP1、JAK2、ABCA1。与NS组比较,DH组下调的前18条通路中有2条通路与脂代谢相关,包括初级胆汁酸生物合成通路和胆汁合成通路,相关的基因为ACOX2、CYP8B1、ATP1A4、NMOB2、SLCO1B2,见表2。使用STEM软件对差异表达的mRNA进行了趋势分析,结果显示9个样品中(每组3个样品)差异表达的mRNA谱有7个趋势明显。其中表达谱1显示169个分配基因中有140.3个基因的趋势为NS组较NM组降低,而DH组较NS组升高,主要基因包括RGD1565355、LOC360228、PPARG等,见图3。
GO分析显示,差异表达mRNA的功能与对糖尿病的发生、发展至关重要的许多生物学过程有关,如代谢过程、发育过程和对刺激的反应;相关的分子功能主要包括解酶活性、结合和转运活性等;相对应的细胞成分主要包括细胞、细胞部分、细胞周围和质膜,见图4。
2.4肾脏组织PPARγ的表达 与NM组比较,采用链脲佐菌素诱导大鼠发生DKD后,大鼠肾脏组织的PPARγ表达明显降低,丹红注射液干预后PPARγ的表达相比于NS组明显升高,差异有统计学意义(P<0.05),见图5。
3 讨 论
DKD作为糖尿病最常见的微血管并发症之一,大约30%的1型糖尿病和40%的2型糖尿病患者会发生DKD。目前DKD治疗措施主要包括调节生活方式、控制血糖、保护肾脏的药物、容量控制、降脂,以及抗血小板治疗等,但这些治疗均不能阻止甚至延缓DKD进展为ESRD。最新研究报道显示,在我国普通人群和城市住院患者中,与糖尿病相关的CKD比肾小球肾炎相关的CKD更常见,而我国糖尿病相关的CKD患者估计有2 430万人[12]。
丹红注射液中丹参微寒,归心、肝经,祛瘀止痛、活血通络、清心除烦;红花性温,归心、肝经,活血通经、散瘀止痛[13]。研究报道丹参酮(丹参的活性成分之一)可以通过清除氧自由基,防止低密度脂蛋白氧化,减少炎症细胞浸润,保护血管内皮,从而改善肾小球基底膜通透性,减少尿蛋白;而丹参酮ⅡA可通过抑制瘢痕来源的成纤维细胞的增殖来改善肾间质纤维化[14]。红花的有效成分红花苷和红花黄色素具有抑制血小板聚集、改善微循环、扩张小动脉和增强纤维蛋白溶解活性的功能[15]。在早期DKD患者中,丹红注射液可通过降低C反应蛋白(CRP)和白细胞介素6(IL-6)而改善患者的肾功能[16]。而在临床DKD患者中,应用丹红注射液治疗后可使血浆丙二醛(MDA)、血管紧张素Ⅱ(AngⅡ)水平下降,从而改善病情[17]。而DKD发病机制较为复杂,主要包括遗传因素、高血糖、晚期糖基化终末产物的形成、多元醇旁路活性增加、血流动力学异常、氧化应激、血脂异常、炎性反应等。上述研究表明丹红注射液可能通过减轻炎性反应、抑制氧化应激、改善血流动力学异常等途径延缓DKD的进展。
除了存在糖代谢紊乱外,DKD患者还常伴有脂质代谢紊乱。一项流行病学调查显示,低HDL-C和高TG水平是2型糖尿病门诊患者发生肾病进展的独立危险因素[18]。高脂血症通过引起胰岛素抵抗并损害胰岛β细胞的功能导致2型糖尿病的发生、发展[19]。动物实验表明,高脂血症可激活S100A8 TLR4信号转导通路,导致糖尿病肾小球损伤[20]。相反,降低血脂水平可以保护肾功能。 YOKOYAMA等[21]发现多不饱和脂肪酸饮食可减少肾脏中的脂质沉积并延缓DKD的发展。而有研究报道丹红注射液能降低TC、TG 和LDL-C,并提高HDL-C的水平,从而改善脂质代谢,保护肾脏[22-24]。动物实验也发现丹红注射液治疗高脂血症大鼠可使大鼠肝脏脂肪分解增加,脂肪酸合成减少[25]。在本研究中,笔者发现丹红注射液减轻了DKD大鼠的肾脏病理损伤,降低BUN、Cys-C和TC水平,并升高了HDL-C水平。这些结果表明丹红注射液可以缓解DKD大鼠的肾功能恶化,并改善其血脂紊乱。微阵列分析表明丹红注射液明显改变了DKD大鼠的基因表达谱。而这些差异基因的功能包括代谢过程、发育过程、对刺激的反应、生物调控、生物合成过程等均与糖尿病的发生、发展密切相关。STEM趋势分析表达谱1中丹红注射液上调的基因RGD1565355参与脂肪细胞因子信号通路和脂肪的消化与吸收;LOC360228参与白色脂肪细胞分化过程;PPARG参与PPAR信号通路,脂肪形成,白色和棕色脂肪细胞分化,脂肪酸、TC和酮体代谢,以及脂质和脂蛋白代谢等通路。此外,差异表达基因的KEGG通路富集分析结果中,丹红注射液明显改变了5条与脂代谢相关的通路,其中基因ACSBG1、ADIPOQ、FABP4、SLC27A5、ABCA1和CYP8B1据报道主要参与游离脂肪酸、胆汁酸、胆固醇的代谢,而与代谢性疾病[26-31]如糖尿病相关。本研究对差异表达基因的KEGG通路富集分析结果中,丹红注射液明显改变的主要通路PPAR信号通路中的关键基因PPARγ进行性肾脏组织免疫组织化学染色以验证微阵列结果。同微阵列结果一致,PPARγ在NS组表达明显低于MN组,而使用丹红注射液后PPARγ表达明显升高。而有研究报道,PPARγ激动剂可增加肝X受体基因的表达而介导在肾小球系膜细胞中胆固醇的外流,从而减少细胞内脂质积累[32]。
综上所述,本研究发现丹红注射液可能通过脂代谢通路改善血脂紊乱而延缓糖尿病大鼠的肾功能恶化,这些结果有助于理解丹红注射液治疗DKD的机制,为DKD的治疗提供新的思路。
