miR-146a对血小板免疫炎症功能的影响*
2019-04-25徐吉淋王路乔杨人强
徐吉淋,王路乔,梁 倩,杨人强
(1.长江航运总医院心血管内科,武汉 430019;2.南昌大学第二附属医院心血管内科,南昌 330006;3.昆明医科大学第一附属医院心血管内科,昆明650031;4.南昌大学第二附属医院分子中心,南昌 330006)
血小板的激活和各种血小板因子的释放是触发急性冠脉综合征(acute coronary syndrome,ACS)的始动和核心环节。最近的研究发现,血小板的激活不仅能促进血栓形成,还能激活机体免疫炎性反应[1-2]。血小板表面存在Toll样受体4(TLR4)、CD40L、P-selectin等免疫分子。TLR4的表达在活化和非活化的血小板之间不同,活化的血小板TLR4表达明显升高[3-4]。TLR4在ACS患者单核细胞中过表达,并且这些过表达的TLR4通过TLR4/核因子(NF)-κB信号通路调控免疫炎性反应[5-6]。近年有研究表明,血小板、巨核细胞中存在大量有功能的NF-κB家族成员,并且它们和血小板免疫炎症密切相关,具体机制有待进一步研究[7]。miR-146是第一个被发现在免疫系统中具有调节作用的miRNA,其能诱导巨核细胞增生分化[8],并且在小鼠成熟巨核细胞中表达增加[9]。在血小板生成过程中,巨核细胞中线粒体、核糖体等细胞器及多种不同细胞因子的pre-mRNA转移到血小板,因此miRNA通过影响巨核细胞中mRNA的合成进一步影响血小板功能[9]。本文研究miR-146a对巨核细胞裂解产生的血小板免疫炎症功能的影响,为抑制血小板免疫炎症的治疗提供更多的理论依据。
1 材料与方法
1.1材料 人慢性粒细胞白血病细胞K562由南昌大学第二附属医院分子中心馈赠;高糖1640培养基,胎牛血清(FBS,以色列BI公司); miR-146a mimic、miR-146a inhibitor、mimic-NC、inhibibor-NC、miR-146a/U6的RT-qPCR引物(吉玛公司); lipofectmine 2000(全式金公司); TLR4一抗(美国Proteintech公司),NF-κB一抗(美国Abcam公司),β-actin一抗、鼠二抗、兔二抗(中杉金桥公司);白细胞介素(IL)-6及肿瘤坏死因子α(TNF-α)ELISA试剂盒[优尔生(uscnk)];RT-PCR、qPCR试剂盒(Tiangen公司);佛波酯(美国Sigma公司)。
1.2方法
1.2.1细胞培养及巨核细胞模型建立 常规培养K562细胞,按照前期实验摸索条件,复制K562细胞向巨核细胞分化模型,待细胞处于对数增殖期时,加入佛波酯(DMSO溶解,终浓度为10 ng/mL) 诱导72 h,离心收集诱导后细胞,培养基重悬,接种于新的培养皿中用于后续细胞转染实验。
1.2.2细胞形态分析 收集诱导前后K562细胞离心涂片,在光镜下观察诱导前后细胞形态变化并拍照。
1.2.3流式细胞术检测表面标志分子 用流式细胞仪检测诱导前后K562细胞CD61和CD41阳性血小板百分率。三色流式细胞分析法详细操作步骤参考文献[5]。
1.2.4转染佛波酯诱导分化 诱导后细胞增殖至80%左右汇合时进行siRNA转染。按照转染试剂操作指南操作,分别导入miR-146a mimic、miR-146a inhibitor、mimic-NC、inhibitor-NC等。
1.2.5荧光定量检测miR-146a水平 收集细胞,按Trizol试剂盒说明书提取总RNA。反转录合成第1链cDNA,PCR扩增。miR-146a:上游引物5′-TAATCGTGTGAGAACTGAATTC-3′,下游引物5′-TATGGTTTTGACGACTGTGTGAT-3′;U6:上游引物5′-ATTGGAACGATA CAGAGAAGATT-3′,下游引物5′-GGAACGCT TCACGAATTTG-3′。具体步骤参照荧光定量试剂盒说明书。扩增条件:95 ℃ 15 min 1个循环;95 ℃ 10 s,60 ℃ 32 s 40个循环。每个标本均做3个复孔,结果采用2-ΔΔCT法进行相对基因分析。
1.2.6ELISA测定IL-6、TNF-α水平 按照ELISA试剂盒说明书操作,检测培养上清液中IL-6、TNF-α水平,结果经酶标仪读数,在标准曲线上进行定量分析。
1.2.7Western blot检测TLR4、NF-κB蛋白表达 收集转染3 d后的细胞悬浮液离心(1 000 r/min离心5 min),PBS洗涤3次;加入50 μL×Loading Buffer漩涡振荡充分裂解细胞,置沸水中煮10 min,十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后将其转移到聚偏氟乙烯(PVDF)膜,脱脂牛奶封闭2 h,双蒸水洗膜5 min×3次,加入稀释好的一抗4 ℃摇床孵育36~48 h,TBST洗涤10 min×3次。加入二抗常温孵育1.5 h,TBST 洗涤10 min ×3次。加入显影液曝光,以β-actin 作为内参照。
1.2.8RT-PCR检测NF-κB、IL-1受体相关激酶1(IRAK1)水平 收集细胞,按Trizol试剂盒说明书提取总RNA。反转录合成第1链cDNA,PCR扩增。具体步骤参照RT-PCR试剂盒说明书。NF-κB、IRAK1引物序列见表1。PCR反应条件:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火58 ℃ 30 s,延伸 72 ℃ 60 s,循环30次;总延伸72 ℃ 7 min。IRAK1退火温度56.8 ℃,NF-κB退火温度 57.8 ℃。

表1 引物系列
1.2.9靶基因预测 利用3种常用的靶基因预测软件(TargetScan、PicTar、miRanda)预测miR-146a可能作用的靶基因,结合miR-146a在调控血小板免疫炎症过程中的作用,在预测结果交集中筛选出IRAK1基因为潜在的靶基因;通过荧光素酶报告基因法验证IRAK1是否含有miR-146a的靶位点;通过检测过表达或抑制表达miR-146a后细胞中靶基因mRNA及蛋白表达的变化,从而确定miR-146a与靶基因的对应关系。

2 结 果
2.1形态学变化 K562细胞经佛波酯诱导后,随着时间的延长细胞逐渐变形,到72 h时细胞变化最明显,呈现出巨核细胞特点:细胞形态为圆形或椭圆形,边缘不规则,染色质呈粗颗粒状,排列紧密,核仁不甚清晰,出现空泡及伪足等,见图1。

A:诱导0 h;B诱导24 h;C:诱导48 h;D:诱导72 h
图1 佛波酯诱导K562细胞的形态变化(×100)
2.2表面标志物CD41和CD61表达水平 K562细胞表面几乎不表达CD41和CD61,而佛波酯诱导72 h后,流式细胞术检测细胞表面CD41和CD61的阳性率分别高达38.7%和46.45%,见图2。

图2 佛波酯诱导K562细胞前后CD41、CD61表达变化
2.3siRNA转染效率的测定 与mimic-NC组相比,miR-146a mimic组miR-146a的表达明显升高(约77.5倍);与inhibitor-NC组相比,miR-146a inhibitor组miR-146a表达下降(约7.5倍),见图3。

1:Control;2:miR-146a mimic;3:miR-146a inhibitor;4:mimic-NC;5:inhibitor-NC
图3 转染siRNA 48 h后各组miR-146a水平变化
2.4miR-146a对IL-6、TNF-α水平的影响 与mimic-NC组相比, miR-146a mimic组细胞上清液中IL-6、TNF-α水平明显降低(P<0.05);与inhibitor-NC组相比,miR-146a inhibitor组细胞上清液中IL-6、TNF-α水平明显升高(P<0.05),见表2。

表2 各组细胞IL-6、TNF-α水平
a:P<0.05,与Control组比较;b:P<0.05 与mimic-NC组比较;c:P<0.05,与inhibitor-NC组比较
2.5miR-146a对TLR4、NF-κB蛋白表达的影响 转染72 h后提取总蛋白质行Western blot,结果显示miR-146a mimic组中TLR4蛋白表达明显升高,NF-κB蛋白表达明显降低,差异有统计学意义(P<0.05),见图4。转染48 h后提取总RNA行RT,结果显示: miR-146a mimic 可降低NF-κB mRNA表达,差异有统计学意义(P<0.05),见图5。

1:Control;2:miR-146a mimic;3:miR-146a inhibitor;4:mimic-NC;5:inhibitor-NC;a:P<0.05,与Control组比较;b:P<0.05,与miR-146a mimic组比较;c:P<0.05,与miR-146a inhibitor组比较
图4 各组细胞TLR4、NF-κB蛋白表达

1:Control;2:miR-146a mimic;3:miR-146a inhibitor;4:mimic-NC;5:inhibitor-NC;a:P<0.05,与Control组比较;b:P<0.05,与miR-146a mimic组比较;c:P<0.05,与miR-146a inhibitor组比较
图5 各组细胞NF-κB mRNA表达
2.6验证靶基因 双荧光素酶报告基因实验结果显示,共转染Pmir-Report-WT-IRAK-1-3′UTR载体与miR-146a mimic,在细胞内miR-146a与IRAK1 3′UTR相结合,使得载体荧光素酶不表达,荧光素酶活性受到明显抑制;而将此共转染体系中更换为mimic-NC或Pmir-Report-MUT-IRAK-1-3′UTR载体,则荧光素酶表达不受影响,荧光强度无明显变化,见图6。hsa-miR-146a可以与IRAK1的3′UTR相结合,IRAK1是hsa-miR-146a的靶基因。进一步的生物学实验表明hsa-miR-146a过表达能降低IRAK1蛋白表达而不影响IRAK1 mRNA表达,阻遏hsa-miR-146a的表达则提高了IRAK1的蛋白表达,IRAK1 mRNA表达也无明显变化,见图7、8。hsa-miR-146a在转录后水平抑制IRAK1表达,再次证实IRAK1是hsa-miR-146作用的靶基因。
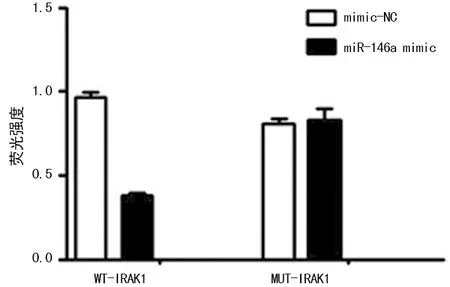
图6 双荧光素酶报告基因交叉转染后对荧光素酶活性的影响

图7 各组细胞IRAK1 mRNA表达
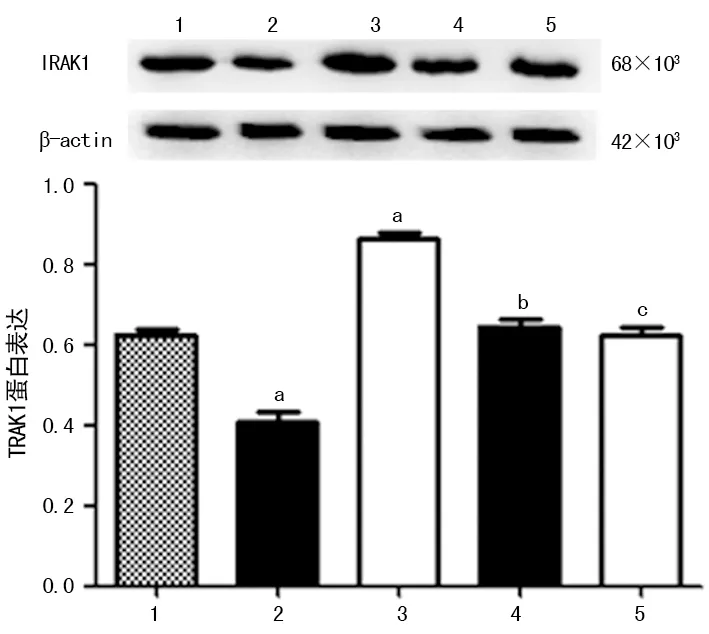
1:Control;2:miR-146a mimic;3:miR-146a inhibitor;4:mimic-NC;5:inhibitor-NC;a:P<0.05,与Control组比较;b:P<0.05,与miR-146a mimic组比较;c:P<0.05,与miR-146a inhibitor组比较
图8 各组细胞IRAK1蛋白表达
3 讨 论
激活的血小板自身能分泌多种炎症因子,如IL-1β、IL-3、IL-6、TNF-α[10]。此外,血小板激活后通过与血管内皮、循环中的白细胞相互作用,释放多种促炎分子[4,11-12]。因此,血小板的免疫炎性反应不仅参与动脉粥样斑块破裂及血栓形成,还贯穿在动脉粥样硬化的形成及发展的整个慢性炎性反应过程中[13-14]。研究血小板的免疫炎性反应,对冠状动脉粥样硬化性心脏病的预防和治疗有着深远意义。然而血小板体外存活时间短,保存困难,容易激活,体外研究困难。K562细胞是一种双分化潜能的人慢性粒细胞白血病细胞,在国际上被通用于研究巨核细胞的分化研究。本实验成功复制了体外用佛波酯诱导K562细胞构建巨核细胞/血小板模型[15],通过转染miR-146a siRNA成功上调或下调了miR-146a水平。上调miR-146a表达后,TLR4蛋白明显升高,NF-κB mRNA和蛋白降低,细胞上清IL-6、TNF-α水平明显降低。下调miR-146a表达后,TLR4蛋白明显降低,NF-κB mRNA和蛋白明显升高,细胞上清IL-6、TNF-α水平明显升高。IRAK1是TLR4/NF-κB信号通路中的一关键分子,多个生物信息学软件都预测到IRAK1是miR-146a的一个靶基因,通过双荧光素酶报告基因证明在血小板中miR-146a可以靶向作用于IRAK1,并通过Western blot和RT-PCR检测证明血小板中miR-146a也能在转录后水平调控IRAK1的表达。从而表明miR-146a可通过TLR-4/NF-κB炎症通路抑制血小板的炎性反应,并且其可能机制是通过作用TLR4/NF-κB信号通路中关键靶点IRAK1,负性调节此通路,减弱该通路下游NF-κB介导的IL-6、TNF-α等炎症因子的表达。目前研究的miR-146a抗炎的经典途径之一是miR-146a通过靶向作用于IRAK1、TRAF6,负向调控TLR4/NF-κB信号通路,抑制该通路下游NF-κB介导的炎症因子的表达[16-17]。上述经典途径与本研究结果完全一致。然而,也有研究表明miR-146a可促进动脉粥样硬化的炎症,加重冠状动脉粥样硬化性心脏病[18-19]。因此,需要进一步研究miR-146a在血小板免疫炎症及冠状动脉粥样性心脏病中的的作用机制。
