髓系细胞触发受体-1对脓毒症肠功能障碍大鼠瓜氨酸循环水平的影响*
2019-04-25沈丽娟吴锡平孙月雯关云艳
沈丽娟,吴锡平,王 倩,孙月雯,关云艳
(南京中医药大学无锡附属医院重症医学科,江苏无锡 214071)
脓毒症时,肠上皮细胞数量减少、功能障碍,肠黏膜屏障破坏,肠道菌群移位,引起体内促炎性和抗炎性介质平衡失调,导致全身炎症反应综合征(SIRS),最终造成多器官功能障碍(MODS),这是脓毒症发展过程中的一个主要病理过程[1-2]。髓系细胞触发受体-1 (TREM-1)是一种跨膜糖蛋白,选择性地表达于中性粒细胞和一部分单核细胞,它是感染性疾病炎症激发及级联放大的关键介质,可以增强炎性反应对机体的影响[3]。但正常肠道固有层巨噬细胞几乎不表达TREM-1,是肠道防止炎性反应与组织损伤过强的重要机制[4]。目前已知TREM-1不仅参与了感染等急性炎性反应,同时在肠道急慢性炎症中也起到了促进炎性反应和加重组织损伤的作用[4]。因此笔者推测在脓毒症肠黏膜损伤时肠道TREM-1呈现高表达,并与肠黏膜的损伤程度相关。瓜氨酸是一种非蛋白质的氨基酸,主要由小肠黏膜上皮细胞吸收代谢谷氨酰胺产生[5]。前期研究证实,瓜氨酸可以作为诊断脓毒症大鼠急性肠功能障碍的有效指标[6]。笔者推测肠黏膜组织TREM-1水平与血清瓜氨酸水平呈现相关性,能反映脓毒症急性肠功能障碍的程度。本研究通过脂多糖(LPS)构建脓毒症大鼠模型,用TREM-1特异性阻断剂 LP17人工合成肽阻断TREM-1,观察肠黏膜组织TREM-1水平与血清瓜氨酸及肠黏膜组织病理学改变的关系,为脓毒症急性肠功能障碍治疗药物新靶点的发现提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 选取健康8周龄雄性SD大鼠30只[北京维通利华公司,质量合格证:SCXK(京)2012-0001],体质量280~300 g。
1.1.2主要仪器 多用脱色摇床SYC-2101(苏州捷美),BM450A全自动组织包埋机(常州派斯杰医疗),光学显微镜[日本Olympus公司DX45显微镜及其自带的计算机图像分析系统(DP2-BSW)],JEM-1010透射电子显微镜(日本电子公司),带电化学检测器的高压液相色谱仪(HPLC-PED,美国Dionex公司)。1525高效液相色谱仪、2489紫外检测器(美国Waters公司),XBridge C18色谱柱(5 μm,4.6×250.0 mm),Empower2色谱工作站。Elx-800酶联免疫分析仪(美国BioTek公司),LightCycler480基因扩增仪(美国BioER公司)。
1.1.3主要试剂 LPS(L2880-100MG,美国Sigma公司)。LP17人工合成肽由上海科肽生物科技有限公司合成,采用Fmoc法经去保护、激活和交联、循环3步合成,序列为LQVTDSGLYRCVIYHPPL,相对分子质量2 074.41,HPLC分析其纯度为98.22%。肿瘤坏死因子α(TNF-α)和TREM-1 ELISA 试剂盒(上海沪峰化工有限公司,货号F11310-A、F3151-A)。乳果糖、甘露醇(美国Sigma公司)。苏木素-伊红染色试剂盒(上海碧云天生物技术有限公司),Trizol RNA Isolation(美国Invitrogen公司),SYBR®Premix ExTaq TMⅡ、逆转录试剂盒[宝生物工程(大连)有限公司],引物序列(上海博彩生物技术有限公司),TREM-1单克隆抗体(北京博奥森生物技术有限公司,编号23400R)。
1.2方法
1.2.1动物模型及分组 雄性SD大鼠30只分为正常组(A组)、模型组(B组)及LP17组(C组),每组10只。模型组及LP17组大鼠腹腔注射4.5 mg/kg LPS进行造模[7]。大鼠出现心率加快(为造模前心率2倍)、血压下降、精神萎靡、少动、竖毛、口鼻分泌物增多等视为造模成功[8]。造模成功后,C组尾静脉注射TREM-1特异性阻断剂LP17人工合成肽(24.5 mg/kg)[9],其余两组尾静脉注射等量生理盐水。实验期间自由进食饮水。72 h后各组大鼠灌胃乳果糖100 mg、甘露醇50 mg混悬液2 mL,放置代谢笼,留取24 h尿液。
1.2.2标本采集及检测 大鼠下腔静脉取血,将收集的血液标本经1 000 r/min离心5 min,取上清液,-80 ℃保存,统一检测。取血后处死,打开腹腔,观察并记录肠管颜色,有无水肿、出血、扩张及穿孔等情况。取回肠用10%福尔马林固定,常规取材,脱水,石蜡包埋,切片经HE染色。
1.2.3病理检测 光学显微镜观察肠壁绒毛有无水肿,黏膜上皮细胞有无变性、坏死,黏膜下层、肌层、浆膜层、固有层有无充血、水肿、炎细胞浸润。按Chiu氏6级评分[10]评价病变程度,由轻到重依次评为1~5分,无明显病变为0分。用图像分析软件测量肠壁绒毛长度、黏膜层厚度,求出每只大鼠平均绒毛长度与黏膜层厚度的比值(绒毛长度/黏膜层厚度)。
1.2.4肠黏膜通透性 带电化学检测器的高压液相色谱仪(HPLC-PED)检测尿液中乳果糖与甘露醇的浓度[11],计算比值(L/M)。淋洗液0.1 mol/L NaOH,流速1.0 mL/min,检测电极+0.1 V,氧化电极+0.75 V,还原电极-0.01 V,进样量25 μL。
1.2.5血清瓜氨酸水平 运用高效液相色谱法检测[12],色谱条件:25 mmol/L醋酸铵缓冲(pH6.0):甲醇=90∶10→85∶15(8 min)→55∶45(10 min)→10∶90(10 min),流速1.0 mL/min;柱温30 ℃;检测波长254 nm,进样量20 μL。
1.2.6血清TNF-α、TREM-1水平 ELISA检测血清TNF-α、TREM-1水平。具体步骤如下:加样,加酶标液,密封酶标板,37 ℃孵育,反复清洗酶标板,吸水纸拍干,加入显色剂A和显色剂B,37 ℃下避光反应10~15 min,加入终止液终止反应,酶标仪检测光密度(OD)值,波长450 nm,根据检测结果绘制标准曲线,计算样本浓度。
1.2.7回肠组织TREM-1 mRNA表达 将50 mg的冷冻回肠组织按照说明书提取总RNA。-80 ℃保存。采用RT-PCR两步法进行检测,通过溶解曲线、2%琼脂糖凝胶电泳确定产物的准确性,采用Real Time-PCR方法进行相对定量,标准化比值计算公式采用2-△△CT法[13]。以大鼠β-actin作为内参基因,检验所用引物序列见表1。

表1 大鼠回肠目的基因和内参基因引物序列
1.2.8免疫组织化学检测TREM-1表达 石蜡切片脱胎换骨蜡、水化,PBS冲洗,加入3%H2O2,室温孵育10 min,PBS冲洗,抗原修复,PBS冲洗。滴加正常山羊血清封闭液,室温孵育30 min,加入TREM-1一抗(1∶500),4 ℃孵育过夜,PBS冲洗,加入二抗,37 ℃孵育1 h,PBS冲洗。DAB染色2~5 min,显微镜下观察,PBS冲洗10 min,苏木素复染2 min,盐酸酒精分化,自来水冲洗10 min,梯度乙醇脱水、透明、树胶封片,镜检。

2 结 果
2.1各组大鼠血清TREM-1、TNF-α、瓜氨酸水平 实验结束时,B组大鼠死亡3只,A组与C组无死亡。与A组比较,B组与C组血清TREM-1、TNF-α水平明显升高(P<0.05),血清瓜氨酸水平明显降低(P<0.05);与B组比较,C组血清TREM-1、TNF-α水平明显下降(P<0.05),血清瓜氨酸水平明显升高(P<0.05),见表2。3组大鼠血清TREM-1水平与TNF-α呈正相关(r=0.920,P=0.001),见图1。

表2 各组大鼠血清TREM-1、TNF-α、瓜氨酸水平比较
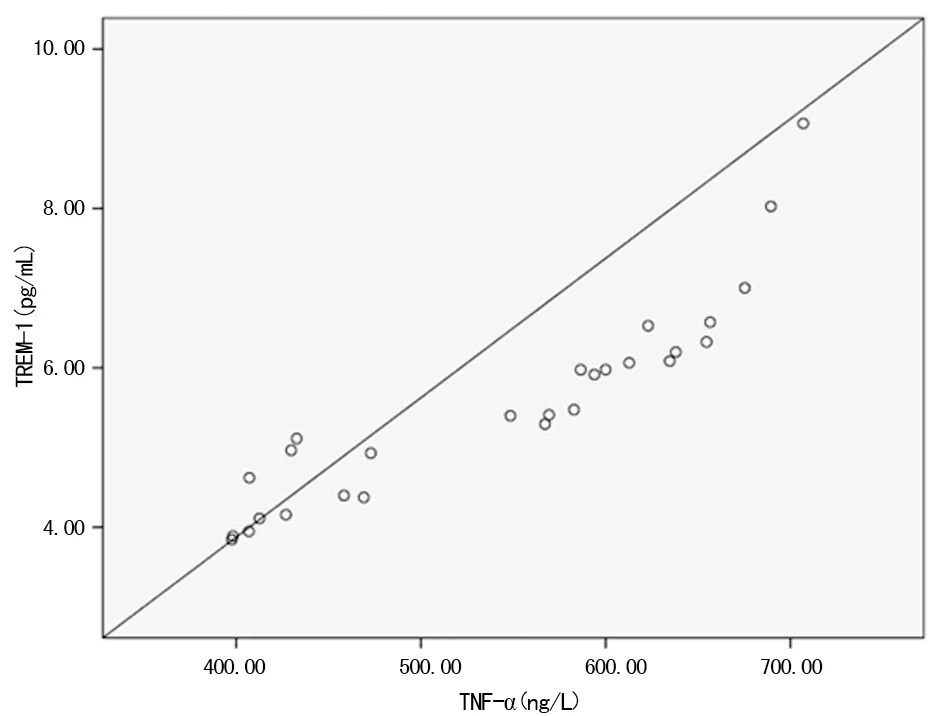
图1 血清TREM-1与TNF-α的相关性分析
2.2回肠组织TREM-1 mRNA表达 B组与C组回肠组织TREM-1 mRNA表达0.56±0.12、0.30±0.09较A组无表达明显升高(P<0.05);与B组比较,C组回肠组织TREM-1 mRNA表达明显降低(P<0.05)。
2.3免疫组织化学检测回肠组织TREM-1表达 TREM-1阳性表达呈黄色或棕黄色的染色颗粒,在A组回肠组织中未检测到TREM-1的表达,B组与C组回肠组织中有TREM-1表达,C组表达量较B组减少,见图2。
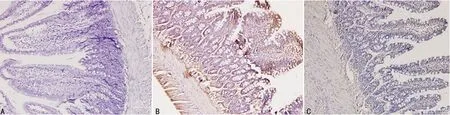
A:A组;B:B组:C:C组
图2 各组回肠组织TREM-1的表达(×200)
2.4回肠黏膜形态及病理学情况 A组:回肠由黏膜层、黏膜下层、肌层和浆膜层4层结构组成,各层次结构清晰。黏膜层表覆单层柱状上皮,向肠腔突起形成细长的绒毛,排列整齐,均无异常。固有层内有肠腺,间质无水肿。黏膜下层为疏松结缔组织,肌层较厚,浆膜为间皮,单层扁平状。B组:大部分肠黏膜上皮抬高,绒毛较A组短、宽,向两侧倒伏,部分绒毛顶端脱落,绒毛顶端上皮下出现囊状间隙,伴随毛细血管充血。少部分出现黏膜层细长的绒毛,排列整齐,顶端上皮细胞无明显变性,无明显坏死。固有层腺体和间质,黏膜下层、肌层无明显病变。C组:大部分肠黏膜绒毛上皮下间隙轻度扩大,伴随毛细血管轻度充血。
与A组比较,B组与C组回肠黏膜厚度、绒毛长度明显降低(P<0.05),Chiu氏评分明显升高(P<0.05);与B组比较,C组回肠黏膜厚度、绒毛长度明显升高(P<0.05),Chiu氏评分未见明显差异(P>0.05),见表3、图3。
2.5回肠黏膜通透性改变 B组与C组回肠黏膜通透性3.57±0.38、2.35±0.27较A组0.19±0.02明显升高(P<0.05);与B组比较,C组回肠黏膜通透性明显降低(P<0.05)。

表3 各组回肠黏膜形态及病理学比较
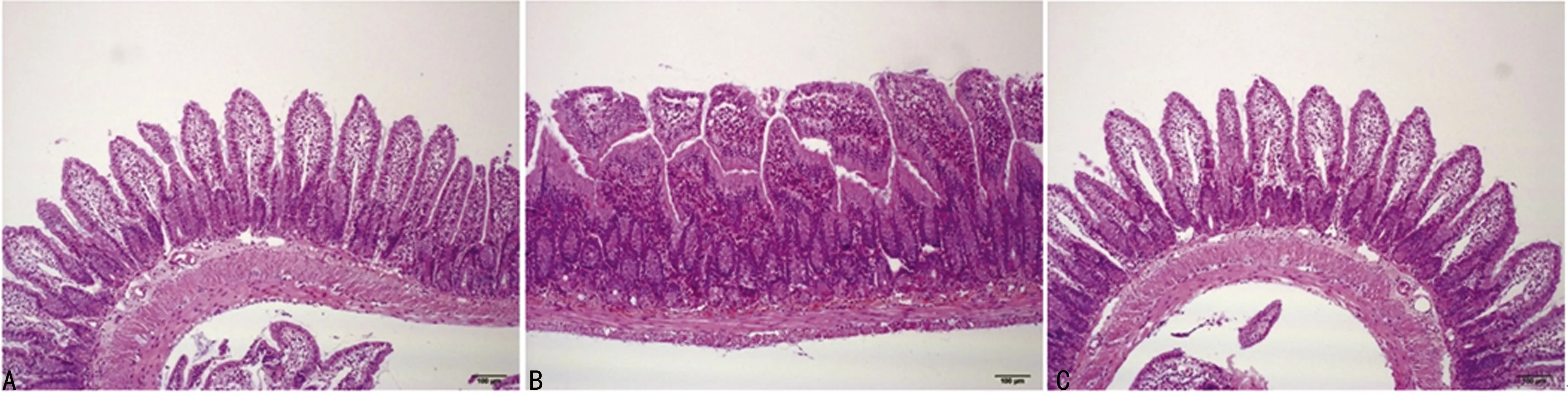
A:0分;B:1分;C:2分
图3 Chiu氏评分情况
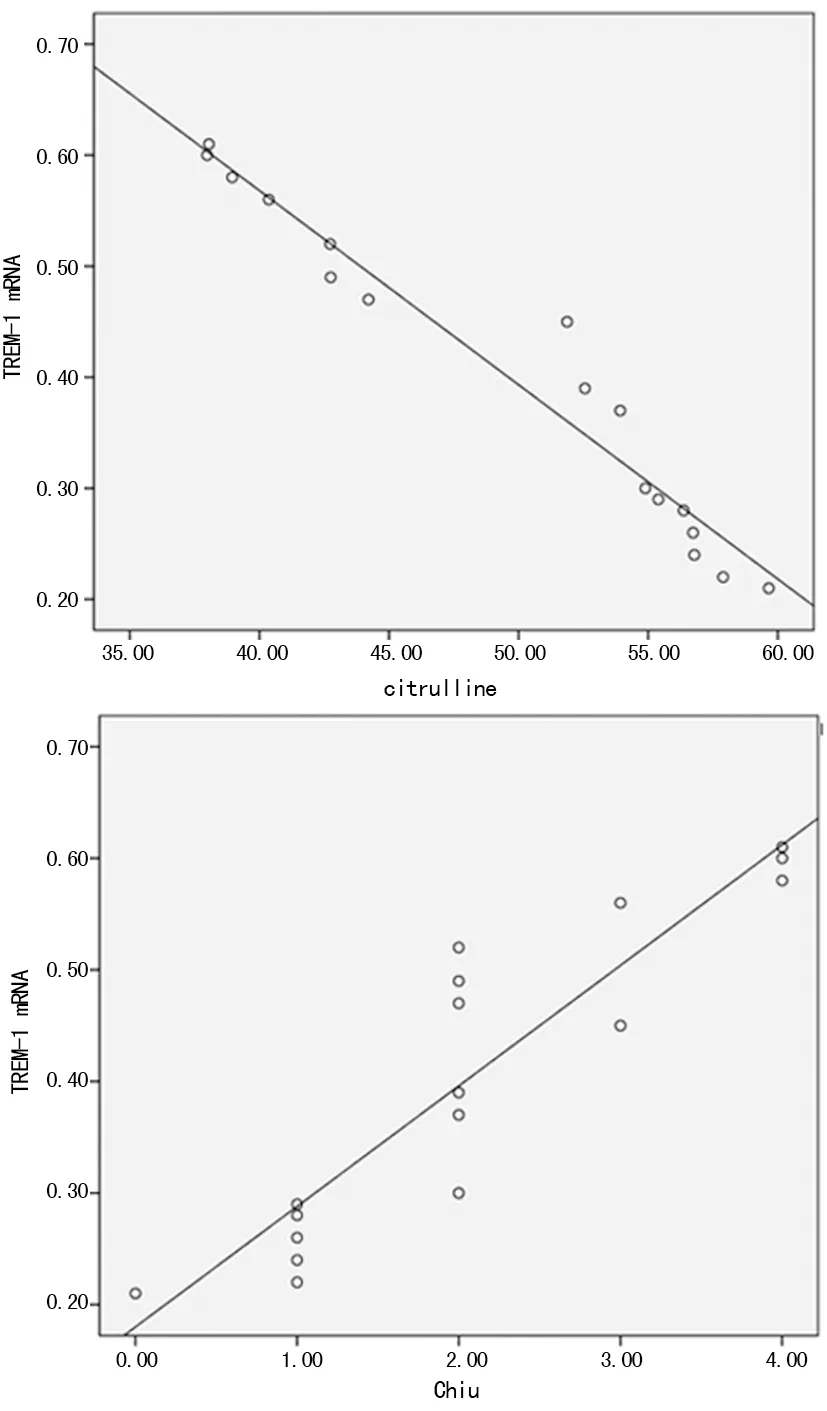
图4 回肠组织TREM-1 mRNA表达与血清瓜氨酸水
2.6回肠组织TREM-1 mRNA表达与血清瓜氨酸及Chiu氏评分相关性分析 B、C组回肠组织TREM-1 mRNA表达与血清瓜氨酸水平呈负相关(r=-0.974,P=0.000),与Chiu氏评分呈正相关(r=0.914,P=0.000),见图4。
3 讨 论
2000年BOUCHON等[3]首次发现TREM-1为一种跨膜糖蛋白,选择性地表达于中性粒细胞和一部分单核细胞,是感染性疾病炎症激发及级联放大的关键介质,其可以增强炎性反应对机体的影响[3]。TREM-1与配体结合后激活下游信号通路,导致细胞合成TNF-α、白细胞介素(IL)-1β、IL-6、IL-8等促炎因子,同时抑制抗炎因子IL-10的合成;而TNF-α、IL-8等可协助LPS上调TREM-1的表达,IL-10则抑制TREM-1的上调,从而产生激发和放大炎性反应的恶性循环[14]。研究显示,脓毒症时所有效应细胞的TREM-1均呈现特异性的高表达,且细胞表面的TREM-1表达明显增高[15]。本研究与上述研究结果一致,脓毒症大鼠血清TREM-1明显升高,并与TNF-α呈正相关,证实TREM-1参与脓毒症的发生、发展过程。
正常肠道固有层巨噬细胞几乎不表达TREM-1,是肠道防止炎性反应与组织损伤过强的重要机制[4]。研究发现,TREM-1不仅参与了感染等急性炎性反应,同时在肠道急慢性炎症中也起到了促进炎性反应和加重组织损伤的作用[4]。有报道,重症胰腺炎大鼠肠组织内TREM-1高表达,促进炎症介质释放和肠黏膜屏障功能障碍,促进炎症因子释放,导致SIRS,诱发和加重 MODS[16]。抑制肠巨噬细胞TREM-1的表达可减轻氧化应激对肠黏膜屏障的损伤[17]。脓毒症时,肠上皮细胞凋亡增加,细胞数量减少,肠上皮细胞功能障碍,肠黏膜屏障破坏,肠道菌群失调,肠道免疫功能受损,导致肠腔内毒素入血,引起炎症介质释放增多,使肠黏膜屏障进一步受损,大量细菌和毒素易位,引起体内促炎性和抗炎性炎症介质平衡失调,导致恶性循环,加重SIRS,最终导致MODS[1-2]。本研究发现,脓毒症时肠黏膜绒毛长度及黏膜层厚度降低,通透性增加,回肠组织TREM-1呈现高表达,并与肠黏膜的损伤程度相关,提示TREM-1参与了脓毒症肠功能障碍的发生、发展。
瓜氨酸是一种非蛋白质的氨基酸,主要由小肠黏膜上皮细胞吸收、代谢谷氨酰胺而产生[18]。瓜氨酸被释放入肝门静脉系统,但肝组织对瓜氨酸没有首过效应,肝脏中的瓜氨酸绝大部分被肾脏摄取后代谢为精氨酸[18]。研究发现,血清瓜氨酸水平能反映诸多小肠疾病(如短肠综合征、放射性肠炎、克罗恩病)患者小肠黏膜上皮细胞的数量[7]。前期研究证实,血清瓜氨酸水平能够反映脓毒症肠黏膜上皮细胞的数量和功能[19]。临床研究发现,急性肠功能损伤的危重症患者血清瓜氨酸水平降低,是死亡的独立危险因素之一[20]。本研究发现,脓毒症大鼠血清瓜氨酸水平降低,并与回肠组织TREM-1 mRNA表达呈负相关,给予脓毒症大鼠尾静脉注射TREM-1特异性阻断剂LP17人工合成肽后,回肠组织TREM-1 mRNA表达有所降低,肠黏膜损伤程度减轻,同时血清瓜氨酸水平有所升高,提示TREM-1能够影响脓毒症血清瓜氨酸水平,进一步证实TREM-1在脓毒症肠急性功能障碍中有重要意义。
TREM-1是感染性疾病炎症激发及级联放大的关键介质,TREM-1能够影响脓毒症血清瓜氨酸水平,反映脓毒症急性肠功能障碍的程度。验证了TREM-1作为脓毒症急性肠功能障碍分子治疗靶点的价值,找到抑制TREM-1活性的药物为改善脓毒症急性肠功能障碍患者的预后提供了新的思路和有效的治疗策略,这将成为下一步研究的重要方向。
