直肠癌术前ADC值与肿瘤分化程度及Ki-67增殖指数的相关性
2019-04-25程有根敖炜群茅国群包向东杨光钊张宏霞魏福全
程有根 敖炜群 茅国群 包向东 杨光钊 张宏霞 魏福全
结直肠癌是常见的恶性肿瘤,其中直肠癌占30%~35%[1]。目前主要依据直肠癌分化程度、TNM分期、肿瘤细胞增殖指数评估预后[2],但部分指标无法在术前进行观察,而需依赖于组织活检或外科手术标本组织病理学检查[3]。磁共振扩散加权成像(DW-MRI)是目前唯一能无创检测活体组织内水分子扩散运动的方法,可以评估组织学特征(包括细胞和水分子)。表观扩散系数(ADC)值是DW-MRI的定量指标,可能反映了特定肿瘤的免疫组织化学特征[4],在肿瘤良恶性判断方面的应用较为广泛。Ki-67增殖指数是一种成熟的免疫组化标志物,可用于直肠癌侵袭性及预后的评估[5]。本研究对直肠癌术前ADC值与术后肿瘤分化程度及Ki-67增殖指数的相关性作一分析,以探讨ADC值预测肿瘤生物学行为及预后的价值。
1 对象和方法
1.1 对象 选取2010年1月至2018年6月本院收治且经手术病理学检查证实为直肠癌的患者125例,术前均未行新辅助放化疗,术前1周内均行常规MRI检查及DW-MRI检查。其中男80例,女45例;年龄38~87(65.01±9.88)岁;腺癌117例,腺癌伴部分黏液腺癌4例,腺癌伴局部神经内分泌癌分化4例;肿瘤部位为高位(距离肛门 11~15cm)28例,中位(距离肛门 6~10cm)40例,低位(距离肛门1~5cm)57例。排除完成MRI检查但DW-MRI和ADC图像无明确肿瘤显示者、手术病理资料不完整者。
1.2 MRI检查 检查前嘱患者尽量排空粪便。采用德国SIEMENS公司生产的3.0T Verio超导磁共振成像仪,8通道相控阵线圈。扫描序列:T2WI轴位、矢状位、冠状位及T1WI轴位、DW-MRI及3D-VIBE增强扫描。扫描参数:T2WI采用TSE序列非脂肪抑制技术,TR 3 900ms,TE 80ms,FOV 220mm×220mm,层厚 5mm,层距1mm;T1WI 采 用 SE 序 列 ,TR 400ms,TE 16ms,FOV 260mm×260mm,层厚5mm,层距1mm;横断位DW-MRI采用 EPI-stir序列,TR 9 700ms,TE 40.3ms,b 值分别取0、1 000s/mm2,层厚 5mm,层距 1.5mm;T1WI增强序列(3D-VIBE):TR 3.3ms,TE 1.3ms,FOV 260mm×260mm,层厚3mm,层距0mm。使用MR自动高压注射器,对比剂为钆喷酸葡胺注射液(Gd-DTPA,德国拜耳公司),剂量根据患者体重(0.1mmol/kg)计算,速率2ml/s。所有患者检查完毕后1周内,行全直肠系膜切除术。
1.3 ADC值测量 由同1位影像科医生(腹部诊断经验12年)在影像工作站直接调取图像测量,该医生对组织病理学检查结果并不知情。在ADC图上手工绘制感兴趣区(ROI),测量病变的ADC值。ROI为圆形或椭圆形,面积50~150mm2。测量时对照同层T2WI图像及增强图像病灶,尽量取病灶最大层面,同时避开血管及坏死区,记录相应ADC值,重复测量3遍,取其平均值。高、中、低分化直肠癌的ADC值测量见图1-3。

图1 男性,45岁。高分化直肠癌,距肛门12cm处直肠肿块(a:DW-MRI图,呈高信号;b:ADC 图,ADC 值为 0.982×10-3mm2/s)
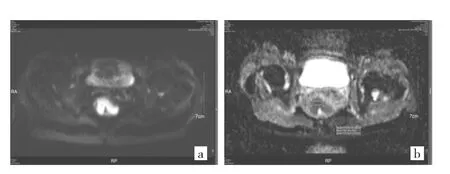
图2 女性,53岁。中分化直肠癌,距肛门5cm处直肠不规则肿块(a:DW-MRI图,呈高信号;b:ADC 图,ADC 值为 0.758×10-3mm2/s)

图3 男性,60岁。低分化直肠癌,距肛门12cm处直肠肿块(a:DW-MRI图,呈高信号;b:ADC 图,ADC 值为 0.668×10-3mm2/s)
1.4 组织病理学检查 取手术标本肿瘤实质部分进行常规HE染色和免疫组化染色。Ki-67增殖指数采用Ki-67标记阳性细胞百分比表示,Ki-67阳性细胞定义为细胞核存在明显的棕色染色[6]。从1 000个肿瘤细胞核中选取10个染色明显的区域,在400倍放大镜下进行检测。
1.5 统计学处理 应用PASW 18.0统计软件。计量资料用表示,不同肿瘤分化程度直肠癌术前ADC值比较采用单因素方差分析,术前ADC值与Ki-67增殖指数的相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌术前ADC值与肿瘤分化程度的相关性直肠癌术前 ADC 值为(0.56~1.46)×10-3mm2/s,平均为(0.83±0.16)×10-3mm2/s;术后组织病理学检查结果显示高分化29例,中分化71例,低分化25例。高、中、低分化直肠癌术前 ADC 值分别为(0.86±0.11)×10-3mm2/s、(0.77±0.10)×10-3mm2/s 和(0.65±0.04)×10-3mm2/s,差异有统计学意义(F=9.26,P<0.05),箱式图见图 4。
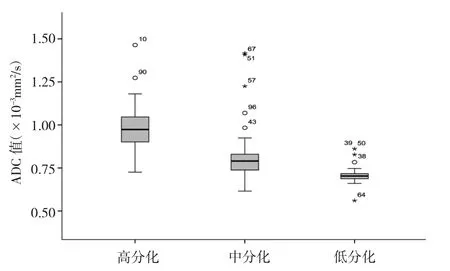
图4 125例不同分化程度直肠癌术前ADC值的箱式图
2.2 直肠癌术前ADC值与Ki-67增殖指数的相关性术后组织病理学检查结果显示Ki-67增殖指数为10%~90%,平均为(55.3±20.2)%。直肠癌术前 ADC 值与Ki-67增殖指数呈负相关(r=-0.19,P<0.05),即 Ki-67增殖指数越高,ADC值越低,见图5。
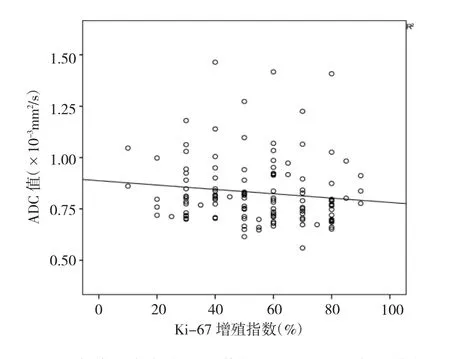
图5 125例直肠癌术前ADC值与Ki-67增殖指数的散点图
3 讨论
相关研究表明,MRI扫描多种序列可以提供形态学和功能学的信息,还与肿瘤的病理评估相对应,且新的MRI技术可以量化与评估肿瘤生物学指标[7]。DWMRI是目前唯一能检测活体组织内水分子扩散运动的无创方法,它从细胞及分子水平反映病变内部结构变化,包括细胞密度、细胞膜的完整性、坏死等,ADC值是其定量指标[8]。肿瘤的ADC值能直接反映病变区水分子弥散受限程度,间接反映肿瘤最大细胞含量区域及肿瘤细胞增殖最高的区域。直肠肿瘤细胞增殖旺盛,生长活跃,细胞代谢时结合水增多;而增殖旺盛的肿瘤细胞合成的大分子蛋白对水分子的吸附作用增强,使得细胞内外水分子活动空间相对减少,扩散运动受限[9]。DW-MRI有助于良恶性肿瘤的鉴别。研究表明,DW-MRI在鉴别肠道肿瘤良恶性方面明显优于其他MRI序列[9-10]。Busard等[11]研究发现恶性肿瘤的ADC值在(0.97~1.19)×10-3mm2/s之间,而良性肿瘤的 ADC 值在(1.37~2.69)×10-3mm2/s之间。相关文献报道的直肠癌ADC值不尽相同[8,11-12]。本组患者低分化直肠癌ADC值在(0.6~1.2)×10-3mm2/s之间,而中高分化直肠癌 ADC值在(0.78~1.46)×10-3mm2/s之间;分析原因可能与 MRI机器型号、场强和b值选取范围不同有关。李健丁等[13]研究认为结直肠癌DW-MRI序列b值取1 000s/mm2时病灶显示信噪较好,本研究采纳了该观点,b值选取了0、1 000s/mm2。肿瘤分化程度是一个重要的预后因素。本研究结果显示,不同肿瘤分化程度直肠癌术前ADC值比较,差异有统计学意义,这与Curvos-Semedo等[3]研究结果一致。但Sun等[12]对49例直肠癌患者进行研究,结果发现ADC值与肿瘤分化程度无关。原因可能与纳入病例数、ROI手工绘制方法等有关。
Curvos-Semedo等[3]研究表明,DW-MRI检查可以提供直肠癌侵袭性的信息,且ADC值越低,肿瘤侵袭性越强;同时认为肿瘤细胞的密度是影响ADC值的主要因素,这可能与ADC值来源于水分子的扩散运动,而它又通常受微观结构、细胞密度和组织中在微环境水平上存在的其他组织学成分的影响有关。因此,ADC值可能反映了特定肿瘤组织的侵袭性。Ki-67是一种贯穿表达于增殖期细胞中的核内大分子蛋白质,对维持细胞增殖活性具有重要作用,其高表达是增殖活跃的重要标记,与肿瘤的发生、发展、转移和预后等有关[14]。Ki-67高表达提示肿瘤细胞数目增多,肿瘤细胞增殖活跃,密度增大。在临床实践中,Ki-67增殖指数是常用于评估直肠癌侵袭性和预后的一种传统免疫组化标志物[4]。Bae等[4]研究认为,ADC值可能反映了特定肿瘤的免疫组化特征,从而更精确地预测特定肿瘤在初始治疗前的侵袭性和潜在反应。另有研究表明,ADC值与不同病变的Ki-67增殖指数有较强的相关性[15-16]。Kobayashi等[15]报道了ADC值与膀胱癌Ki-67增殖指数呈负相关,同时发现ADC值越低,肿瘤侵袭性越强。Heijmen等[16]研究发现,结直肠癌肝脏转移病灶ADC值与Ki-67表达水平呈高度相关。Sun等[12]研究发现,直肠癌ADC值与几个病理指标均有相关性,其中与Ki-67表达呈负相关。本研究结果亦显示,直肠癌术前ADC值与Ki-67增值指数呈负相关。
综上所述,直肠癌术前ADC值能反映肿瘤分化程度及Ki-67增殖指数的高低;ADC值越低,肿瘤侵袭性越强。直肠癌术前ADC值可作为一种无创的影像学生物标志物,用来评估肿瘤术前状况,以更好地指导临床个体化治疗方案的选择。但本研究也存在一定的局限性:(1)DW-MRI检查时间与手术时间非一致性;(2)ADC值是在影像工作站上测量的,只有圆形或椭圆形测量方法,不能任意形状描绘病灶测量,故ROI无法包括整个病灶;(3)纳入病例偏少。
