重组人长效凝血因子Ⅶ药物研发进展
2019-04-24冀倩倩朱士茂吴彦萍吴樱丹陈楚如李云富郭采平
冀倩倩 ,朱士茂 ,吴彦萍 ,吴樱丹 ,陈楚如 ,李云富 ,郭采平 *
(1.深圳市卫光生物制品股份有限公司,广东 深圳 518107;2.深圳重组血浆蛋白类创新药物工程实验室,广东 深圳 518107)
血友病是一种遗传性凝血功能障碍的出血性疾病,病症多为自发性或轻度外伤后出血不止,轻则造成患者终生残疾,重则短时间即可危及患者生命。血友病尚无根治办法,目前的治疗方法主要为替代疗法,通过长期输注血浆、缺失的凝血因子的方式来治疗。血友病治疗最严重的并发症是中和性抗体(抑制物)的形成,从而阻碍了替代疗法的止血作用。抑制物的产生导致血友病患者的致残率和死亡率增高,只有少数旁路制剂可用于这些患者的出血治疗,如活化凝血酶原复合物浓缩物(aPCC)和重组活性凝血因子Ⅶ(rFVIIa)。在A型血友病中,约30%的重症患者和5%~10%的非重症患者会产生抑制物,B型血友病患者有3%~5%会产生抑制物[1]。
活化的rFVII对于A型和B型血友病都具有良好的治疗效果,同时对体内产生抑制性抗体的血友病患者同样具有治疗效果[2],是目前临床治疗血友病的最常用药物之一。由于血液中 FVII含量较低(0.5~2.0mg·L-1,其中FVIIa仅占1%),且半衰期非常短(约2.5h),血液提取难度非常大,因此利用基因重组技术表达rFVIIa是目前唯一可行的方法。诺其是丹麦诺和诺德(Novo Nordisk)公司在1999年上市的rFVIIa,由新生仓鼠肾宿主(BHK)细胞表达。rFVIIa和血浆来源的FVIIa的结构、功能研究显示,二者仅在翻译后修饰γ羧基化和N糖基化中有微小差异,但功能基本一致,均可以缩短体外凝血时间,并对无抑制物和伴发抑制物的血友病患者均具有治疗作用[3-4]。诺其主要用于治疗存在Ⅷ因子(FVIII)或Ⅸ因子(FIX)中和抗体的先天性血友病和继发性血友病患者的自发性或手术性出血,在欧洲还被批准用于获得性血友病的治疗[5];此外,还可用于产妇分娩出血的治疗。但药物的半衰期短,约2.9h,自发性出血标准治疗方案包括单次注射 270 μg·kg-1,或出血后每 3h 注射 90 μg·kg-1,共 3 次。
在伴发抑制物的血友病患者的大手术和严重出血治疗中,rFVIIa 的有效率达 80%~90%[6],已被作为药物使用了20多年,极少出现血栓事件或免疫原性报告[7-8]。但rFVIIa蛋白的半衰期短,导致在急性出血或预防性治疗方案中需要频繁输注,不仅增加了患者的痛苦和不便,也增加了治疗成本,限制了其作为血友病预防治疗制剂的应用。凝血因子是治疗血友病不可替代的药物,患者需终身输注,为减轻患者负担,增加患者依从性,亟需开发长效rFVIIa产品。延长半衰期的长效rFVIIa可以减少注射次数,减轻患者负担和痛苦,从而改善患者的生活质量,并使rFVIIa用于血友病的预防治疗成为可能。
长效凝血因子近几年已成为国际上的研究热点。如长效FIX产品通过融合抗体Fc段或白蛋白等技术,成功地将注射频率从每周2次降低到每10~14d给药1次[9-10];长效FVIII产品将注射频率从每周3次减少到2次[11-12]。由于rFVIIa的主要临床适应证是伴发抑制物的血友病,患者病例数相对较少,致使临床研究存在难度大、周期长、成本高等问题,给rFVIIa新药的开发增加了一定的难度,至今尚无长效rFVIIa产品研制成功。本文对应用聚乙二醇(PEG)修饰、序列突变和融合蛋白技术等研制的长效rFVIIa产品进行介绍,为国内rFVIIa药物研发提供参考和依据。
国际上,包括CSL、诺和诺德、拜耳(Bayer)等多家企业均开展了长效rFVIIa产品的开发工作,大部分已进入临床研究开发阶段,如表1所示。
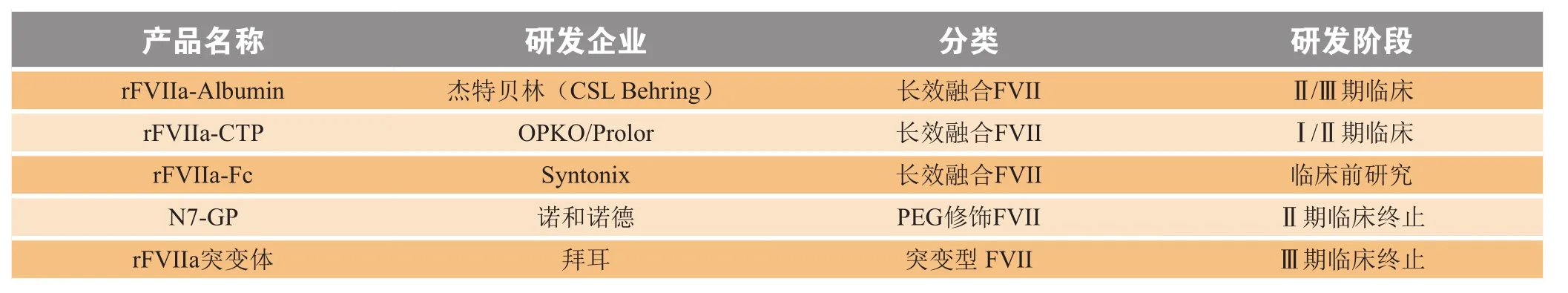
表1 长效重组活性凝血因子Ⅶ研发概况Table 1 Development review of long-acting recombinant activated FⅦ
1 重组活性凝血因子Ⅶ-白蛋白融合蛋白
人血清白蛋白(albumin)是血浆中含量最多的可溶性蛋白,半衰期长达19d,无免疫原性,组织分布广,是天然的药物载体,融合人血清白蛋白是蛋白质药物长效化改造的一种常用选择。白蛋白相对分子质量为66500,是肾小球滤过蛋白的上限,有助于延缓肾脏的滤过作用[13]。此外,白蛋白还以pH依赖的方式结合新生的Fc受体(FcRn),避免了溶酶体酶的降解,并进入再循环机制,从而延长了其半衰期[14-15]。
rFVIIa-白蛋白融合蛋白是通过cDNA拼接技术将FVII与585个氨基酸组成的白蛋白通过甘氨酸丝氨酸柔性接头连接在一起,并在哺乳动物细胞中表达实现的[16]。大鼠药代动力学研究表明,rFVIIa-白蛋白融合蛋白的半衰期比野生型rFVIIa延长了6.7倍,比商品化诺其延长5.8倍[16]。体外和体内疗效评估结果显示,rFVIIa-白蛋白融合蛋白功能活性可与商品化rFVIIa相媲美[16-17]。动物实验中,rFVIIa-白蛋白融合蛋白不仅半衰期和活性时间显著延长,还增强动物康复效果、降低了药物的血浆清除速率[17]。组织分布研究显示,在大鼠膝关节处,rFVIIa-白蛋白融合蛋白维持活性的时间相比诺其延长了10倍,这种特征更有利于提高患者的用药依从性[18]。杰特贝林在健康志愿者体内进行了rFVIIa-白蛋白融合蛋白的Ⅰ期临床研究。与商业化的rFVIIa产品相比,rFVIIa-白蛋白融合蛋白半衰期延长了约3~4倍,约8.5h,药代动力学活性显著增强,同时展示出了良好的安全性和耐受性[19]。试验中仅有1例轻微不良反应记录,表现为静脉注射位点疼痛和僵硬。注射后28d检测期内没有检测到任何抗药抗体。目前,将rFVIIa-白蛋白融合蛋白用于A型或B型血友病患者、伴发抑制剂患者以及FVII缺乏症患者的临床Ⅱ/Ⅲ期研究(NCT02484638)正在进行中。
2 重组活性凝血因子Ⅶ-人绒毛膜促性腺激素β亚基羧基末端肽融合蛋白
人绒毛膜促性腺激素β亚基羧基末端肽(Carboxylterminal peptide of human chorionic gonadotropin,CTP)也是构建长效融合蛋白的一个常用选择。CTP融合可以增加重组融合蛋白唾液酸含量,从而增加蛋白的黏度,遮蔽蛋白上的糖链,使其不被糖苷酶水解,保护蛋白质免受蛋白酶降解;同时可提高蛋白质糖基化程度,增加相对分子质量,因此可以获得更长的药物体内半衰期[20]。由于CTP是人体自身的天然蛋白片段,免疫原性非常低,且分子构建更简单灵活,不需要插入连接序列而直接在蛋白C端或N端融合。
按照氨基酸序列推算,rFVIIa-CTP融合蛋白相对分子质量约54000,但经糖基化修饰后,其相对分子质量高达70000。与rFVIIa相比,二者与组织因子(TF)的亲和力相当,但rFVIIa-CTP融合蛋白的特异性降低;在相似用药浓度情况下,rFVIIa-CTP融合蛋白显示了较弱的血小板结合力和较低的凝血酶生成量[21]。将长效rFVIIa-CTP用于健康男性的Ⅰ期临床研究(NCT02919800)以及用于血友病患者的Ⅰ/Ⅱ期临床研究(NCT02418793)目前正在同时开展中。
3 重组活性凝血因子Ⅶ-Fc融合蛋白
免疫球蛋白Fc片段与血清白蛋白相似,可通过增加功能蛋白的相对分子质量降低肾小球的滤过率,同时通过FcRn介导的、pH依赖性再循环机制有效地避免蛋白降解,从而增加融合蛋白的稳定性,延长体内半衰期[14,22]。Fc融合技术已被应用于FVIII和FIX产品的开发,在临床前和临床研究中均显示了延长的凝血因子活性和半衰期[12,23-24]。rFVIIa-Fc融合蛋白在血友病A模型小鼠体内试验中,显示了与rFVIIa相似的凝血活性功能,且半衰期延长了5.5倍[25]。
rFVIIa-Fc融合蛋白现已经SYNTONIX制药公司申请国际专利(授权公开号:PCT/US2004/013940),但尚无在人体中的临床研究开发记录。国内安源生物也申请了相关专利“改良型人凝血因子FVII-Fc融合蛋白及其制备方法与用途”(授权公开号:CN103397009B)。
4 聚乙二醇修饰的重组活性凝血因子Ⅶ
蛋白质的PEG修饰也是用于延长蛋白药代动力学和提高药效的常用方法,其原理主要是通过PEG修饰增加分子体积,降低肾小球的滤过作用,提高水溶性等。诺和诺德开发出一种由相对分子质量为40000的糖化PEG修饰的rFVIIa(产品代号:N7-GP),旨在预防A型血友病或B型血友病伴发抑制剂患者的出血发作。PEG修饰可延长rFVIIa在循环系统中的半衰期,但同时PEG分子产生的空间位阻阻碍了rFVIIa与组织因子等蛋白的结合,导致凝血功能活性下降[26-27]。在临床前试验和临床试验中,N7-GP都显示了较诺其显著延长的药物半衰期。动物实验显示,N7-GP的循环系统半衰期(高达25h)是商品化rFVIIa的5~6倍;但是等物质量的蛋白的凝血活性显著降低,需要更高的药物浓度以实现止血效果[28-29]。Ⅰ期临床试验显示,N7-GP平均半衰期为15h,与安慰剂组相比,N7-GP组平均凝血酶原时间显著降低,并表现出良好的安全性和耐受性[30]。但Ⅱ期临床研究因未显示有效的剂量效应而终止(NCT00951405)[31]。N7-GP临床Ⅱ期的失败提示,仅延长rFVIIa的半衰期是不够的,还应在体循环中维持一段时间的高水平凝血活性。
5 蛋白序列突变的重组活性凝血因子Ⅶ
拜耳开发了一种半衰期延长、活性增加的rFVIIa变体——BAY86-6150,其通过点突变方法在FVII编码序列中引入氨基酸,从而增强了rFVIIa对激活的血小板的亲和力,并产生了2个额外的N糖基化位点[32]。在临床前小鼠试验和体外研究中,BAY86-6150被证明耐受性良好,显示了增强的促凝活性,相比于商品化rFVIIa,半衰期有效延长。在早期临床试验中BAY86-6150也获得良好评价,临床表现出增强的蛋白稳定性,半衰期延长近3倍,但在Ⅱ/Ⅲ期的临床试验(NCT01625390)中,由于患者产生了可与内源性FVIIa交叉反应的抑制物,发生严重免疫反应而宣告终止研究[33-34]。推测可能与氨基酸突变引起的蛋白分子构象的改变有关[35]。
6 结语
血友病本身是一种罕见病,而FVII的主要临床适应证是伴发抑制剂的血友病,病例数相对较少,致使临床研究存在周期长、成本高等问题,给新药的开发增加了一定的难度,至今没有长效药物开发上市。
尽管一些非因子类血友病药物,如罗氏的双特异抗体emicizumab[36-37](FIXa和Ⅹ因子双特异抗体,商品名:Hemlibra)已被开发出来,但其价格高昂,推广存在一定的难度。Hemlibra用于体内产生FVIII抑制因子的A型血友病的常规预防,研究显示接受Hemlibra预防治疗的伴发抑制剂患者年出血率低于预防性旁路治疗的患者,但使用后有些患者需要再使用含有FIXa的旁路制剂才能更有效控制出血,临床试验中曾有4名患者同时使用旁路制剂发生血栓事件,尚有不清晰的缺陷需要探索。
基因治疗是目前彻底治愈血友病的唯一希望。Spark Therapeutics、BioMarin 和 UniQure Biopharma 等多家公司都在针对血友病的基因治疗进行临床试验,且初见成效[38-40]。但基因治疗也还存在一些难以避免的缺陷:患者免疫系统容易攻击修改后的细胞或肝脏细胞,导致不能分泌足够多的凝血因子,甚至发生肝细胞毒性;随着时间的推移,基因疗法效果可能会减弱;病毒载体的潜在风险等[41-46]。
伴发抑制剂的血友病患者的治疗存在着明显的未被满足的临床需求,其中最重要的是需要延长药物的给药间隔,改善临床效果。目前所有研究数据显示,rFVIIa-白蛋白融合蛋白最有希望满足以上需求,有望在未来5~10年内成功上市,从而使伴发抑制物的血友病患者预防性治疗方案成为可能。而基因治疗方法尚存在一定的问题和争议,但在长远的未来,基因治疗技术将会随着科学的进步和技术的发展逐渐完善,有望实现其一劳永逸的治疗效果。
