杨梅素及其衍生物研究进展
2019-04-24杨冲张良宋晓峰李峰李文保
杨冲 ,张良 ,宋晓峰 ,李峰 ,,李文保 ,,4*
(1. 中国海洋大学医药学院,山东 青岛 266003;2. 青岛海洋生物医药研究院,山东 青岛 266071;3. 山东慈海医疗管理集团,山东 潍坊262200;4. 青岛海洋科学与技术国家实验室,山东 青岛 266071)
杨梅素(myricetin,MYR,1)化学名为3,5,7-三羟基-2-(3,4,5-六羟基苯基)-4H-1-苯并吡喃-4-酮,属于黄酮类化合物,主要存在于藤茶茎叶或杨梅树皮和树叶中,其分子式为C15H10O8,相对分子质量318.24,呈黄色针状或颗粒状结晶,易溶于乙腈、甲醇、乙醇等极性较大的溶剂中[1]。据报道,杨梅素及其衍生物具有抗氧化、抗炎、抗肿瘤、降血糖、镇痛、保肝护肝等多种药理活性[2-3]。目前,在其抗氧化功能及降低胆固醇功效上,欧美已开发出含杨梅素的保健品FYI[4]并上市,但国内外均尚未见杨梅素及其衍生物作为新药获批上市或申请临床试验。为获得具有成药性的杨梅素衍生物,药物化学家们针对其结构进行了大量优化工作,获得了一些药理活性和成药性良好的衍生物。本文就杨梅素及其衍生物的研究进展进行综述。
1 杨梅素合成及药理活性研究
1.1 杨梅素的制备
杨梅素虽广泛存在于天然植物中,但含量较少,且分离提取工艺困难,产率较低。在杨梅素的分离提取方面,近来报道,利用硫化锌纳米片作为一种新型固相萃取材料较传统固相吸附剂硅胶显示出更好的提取能力,具有良好的应用前景[5]。方飞等[6]通过粉碎、静置、提取等工艺从杨梅树皮中获得了杨梅苷,进一步水解得到杨梅素;整个工艺收率较高,成本较低,操作简单且产物无需精制,适合工业化。

二氢杨梅素(2)与杨梅素结构极其相似,在显齿蛇葡萄叶等天然植物中含量高达30%[7]。国内外化学家均有通过使用二氢杨梅素作为起始原料合成杨梅素的相关报道。图1为以二氢杨梅素为起始原料的3种半合成杨梅素的途径:方法一,二氢杨梅素在强碱条件下开环生成查尔酮,查尔酮经Algar-Flynn-Oyamada(AFO)反应生成杨梅素[8];方法二,刘同方等[9]研究发现,加热条件下,在吡啶溶液中二氢杨梅素2、3位脱氢氧化可生成杨梅素;方法三,将二氢杨梅素与醇类(甲醇或乙醇)混合,加入次氯酸钠和催化剂(无水三氯化铝或无水三氯化铁),待反应完全后继续加入次氯酸钠溶液,分离纯化可得杨梅素[10]。

图1 杨梅素的半合成方法Figure 1 Semi-synthesis of myricetin
1.2 杨梅素药理活性研究
1.2.1 抗肿瘤活性Yang等[11]研究证实,杨梅素可以抑制JAR和JEG-3这2种绒毛膜癌细胞株的增殖,同时也可以促进细胞凋亡及调控细胞周期;研究发现,杨梅素可通过作用于丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号传导通路,减弱恶性JAR和JEG-3细胞的侵袭和血管生成。另外,针对绒毛膜癌细胞,杨梅素与目前化疗药物依托泊苷及顺铂等联用具有协同抗肿瘤细胞增殖作用。Shih等[12]探讨了杨梅素对人肺腺癌细胞株A549的抗转移作用,发现杨梅素一方面通过抑制基质金属蛋白酶(MMP)-2和尿激酶型纤溶酶原激活物(uPA),抑制肿瘤细胞黏附,且其抑制作用呈剂量和时间依赖性;另一方面通过抑制细胞外信号调节激酶1/2(ERK1/2),协同抑制人肺癌细胞的侵入与转移。Kumamoto等[13]研究发现,杨梅素与ATP竞争靶向作用于Akt,通过抑制其磷酸化及Akt激酶活性来抑制细胞转化。Phillips等[14]研究发现,杨梅素能通过抑制PI3K的活性,诱导胰腺癌细胞凋亡,进而抑制原位胰腺肿瘤并减少其转移扩散。Jiao等[15]研究显示,用不同浓度的杨梅素(0 ~ 80 µmol · L-1)作用于人乳腺癌MCF-7细胞,发现杨梅素能通过诱导细胞凋亡抑制人乳腺癌细胞的生长;进一步实验表明,杨梅素系通过调节 PAK1/MEK/ERK/GSK3β/β-catenin/cyclin D1/PCNA/survivin/Bax-Caspase-3 的信号通路发挥作用。张秀娟等[16]研究发现,杨梅素可抑制肝癌HepG-2细胞增殖并诱导其凋亡。郭海清等[17]研究表明,随杨梅素浓度增加,肝癌HepG-2细胞凋亡率增加,经线粒体途径的促凋亡因子Bax蛋白表达量增加,同时抗凋亡因子Bcl-2蛋白表达量降低。Shiomi等[18]研究发现,杨梅素可抑制人结直肠癌HCT116细胞增殖,使其增殖周期滞留在G2/M期,诱导细胞凋亡。最近,Li等[19]对腺瘤样结肠息肉病(adenomatous polyposis coli,APC)基因突变小鼠长期灌服杨梅素,发现该化合物具有较强的抑制结肠炎癌转化的作用,其机制与化合物可抑制细胞增殖、诱导凋亡、调控GSK-3β和β-catenin信号通路及抑制肠黏膜上皮细胞产生分泌炎症因子有关。
1.2.2 降血糖活性Kang等[20]给禁食过夜后链脲霉素诱导的糖尿病大鼠经口使用含杨梅素(100 mg · kg-1)或α-葡萄糖苷酶抑制剂阿卡波糖(40 mg · kg-1)的淀粉溶液,与对照组(即淀粉溶液中不含杨梅素或阿卡波糖)大鼠相比,接受杨梅素和阿卡波糖的大鼠餐后高血糖症状均得到缓解;杨梅素可通过抑制α-葡萄糖苷酶活性控制高血糖症状。Li等[21]研究表明,杨梅素是胰高血糖素样肽1受体(GLP-1R)的激动剂,具有调节血糖的功能,预测其可作为治疗2型糖尿病(T2DM)的潜在候选药物。
1.2.3 抗炎活性Lee等[22]研究表明,杨梅素可以抑制Akt、哺乳动物雷帕霉素靶蛋白(mTOR)和核因子κB(NF-κB)信号通路,减少肿瘤坏死因子-α(TNF-α)诱导的炎性介质的产生,同时可抑制活性氧的产生。Cho等[23]研究表明,杨梅素能够通过抑制脂多糖(LPS)刺激的巨噬细胞RAW264.7中NF-κB以及信号转导与转录激活子(TAT1)的磷酸化,以及诱导NF-E2相关因子(Nrf2)调控的血红素氧合酶-1(HO-1)的表达来抑制促炎介质的产生。
1.2.4 抗氧化活性有关杨梅素的抗氧化及清除自由基活性已有大量研究报道。赵丽等[24]通过1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除试验发现,杨梅素清除 DPPH 自由基的 IC50为18.34 mg · L-1,优于阳性对照药芦丁(IC50= 31.32 mg · L-1)。Qiu 等[25]研究表明,杨梅素可以阻滞新生鼠因缺血再灌注损伤而导致的心肌中超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-Px)的活性降低,使其活性升高,减少丙二醛(MDA)、活性氧簇(ROS)的生成。研究发现,杨梅素也可以阻止H2O2诱导的谷胱甘肽氧化[26]。此外,杨梅素可延长缺乏线粒体超氧化物歧化酶(SOD2p)的酵母寿命,减缓其表现出的过早老化和氧化应激敏感性。由此表明杨梅素可缓解衰老引起的氧化应激,尤其是由线粒体内源性防御所导致的细胞内氧化还原稳态失衡。
1.2.5 其他活性杨梅素在降脂及治疗神经疾病方面也具有一定的作用。杨梅素等黄酮类物质可抑制低密度脂蛋白氧化为氧化低密度脂蛋白(ox-LDL),进而减少ox-LDL携带的胆固醇在动脉壁上的积存,改善血管功能,降低动脉硬化的风险[27]。阿尔茨海默病在分子水平上存在2种比较明显的变化:一是细胞外β淀粉样蛋白1-42(Aβ1-42)沉积,二是细胞内神经元纤维缠结(NFT)[28]。通过DAPI染色法研究发现,杨梅素的抗氧化作用能够减少Aβ1-42的产生并降低其构象变化,提示杨梅素对阿尔茨海默病及局部缺血等神经性疾病或具有防治作用[29]。Ma等[30]对抑郁小鼠长期灌服杨梅素,发现其可通过介导小鼠海马区抗氧化应激而一定程度上影响脑源性神经营养因子的水平,进而改善小鼠的抑郁症状。另外,新近研究发现,杨梅素等黄酮类物质还具有一定的抗菌特性[31]。
2 杨梅素衍生物的设计、合成及活性研究
杨梅素分子具有多个酚羟基且呈平面结构,水溶性和稳定性均较差,导致其生物利用度不高,给药途径受限,以上缺陷极大限制了杨梅素的开发成药。目前,国内外学者一方面通过制剂技术解决上述问题,如利用环糊精及其衍生物与杨梅素通过分子间非共价键形成超分子包合物[32],或者开发制备成杨梅素微乳,从而改善杨梅素的水溶性及生物利用度;另一方面主要采用各种化学或生物合成手段对杨梅素分子进行结构改造,以期获得水溶性好、成药性高的杨梅素衍生物。化合物活性研究表明,清除自由基、抗氧化活性主要取决于B环上的3个相邻羟基,其C4'位羟基脱氢后生成羰基即可与邻位羟基形成氢键;相比之下,A环上C7及C5羟基抗氧化活性相对较弱;C环中C2位与C3位间的双键增强了与其相连的C3位羟基的抗氧化活性;研究发现,C2、C3位双键有利于抑制肿瘤细胞增殖,C5、C7、C3'及C4'位羟基的存在提高了化合物抗肿瘤细胞增殖的活性,但C3位羟基减弱了抑制增殖的活性[33-34]。
2.1 杨梅素酰化衍生物
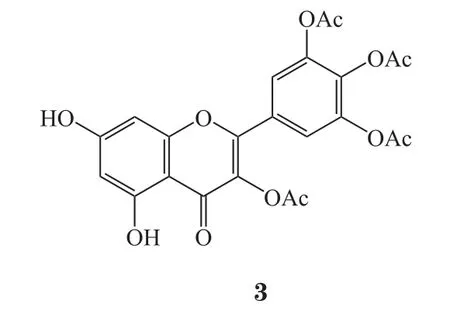
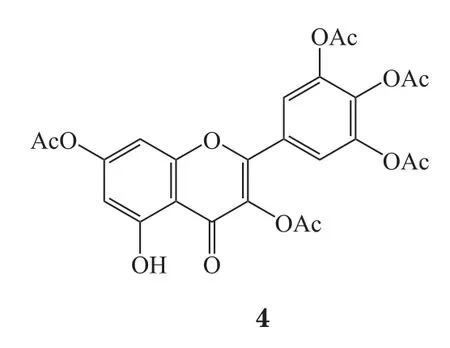
杨梅素全乙酰化衍生物可通过杨梅素在乙酸酐-吡啶[35]或乙酸酐-浓硫酸[36]作用下酯化得到。除了全乙酰化之外,区域选择性的酰化也可通过酶促反应实现。Chebil等[37]认为,对杨梅素等黄酮类化合物特定羟基位置进行乙酰化修饰后,其稳定性虽极大改善,但水溶性仍较差。孔琪[38]对杨梅素不同乙酰化衍生物(3 ~5)及杨梅素进行了体外抗菌活性测试:结果表明,上述杨梅素衍生物对供试细菌金黄色葡萄球菌、表皮葡萄球菌、大肠埃希菌、铜绿假单胞菌的体外抗菌活性与杨梅素相比无显著变化。

2.2 杨梅素甲基化衍生物
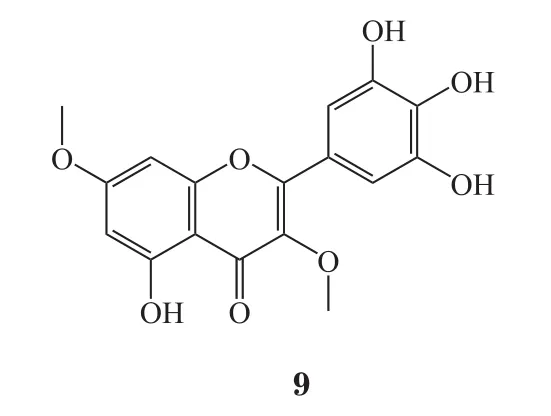
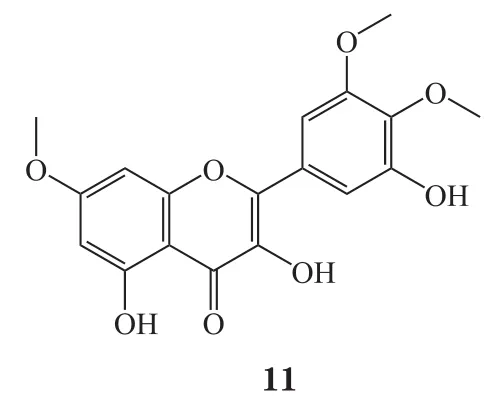
1956年,Hergert等[39]利用硫酸二甲酯与杨梅素反应得到其6个羟基全甲基化的衍生物(6),但产率较低。2002年,Matsuda等[40]在氢化钠的催化下,将杨梅素与碘甲烷反应生成化合物6,该反应产率较高且处理简单。该课题组完成杨梅素的全甲基化合成后,对杨梅素的单一或二羟基甲基化反应条件进行了研究。实验发现,以甲醇为溶剂,重氮甲烷的乙醚溶液为甲基化试剂,室温反应2h即可得到杨梅素的7位、4'位的单甲基化物(7 ~8)及少量3、7位,7、4'位的二甲基化物(9~10)和 7、3、4'位的三甲基化物(11)。课题组进一步测试了甲基化衍生物6~11对大鼠醛糖还原酶的抑制活性,结果表明,化合物9的抑制活性(IC50=12 μmol·L-1)较杨梅素(IC50=29 μmol·L-1)有一定提高,但化合物 6 抑制活性(IC50> 100 μmol·L-1)明显降低;进一步研究表明,B环邻苯三酚结构可使化合物表现出较强活性,但C3位羟基取代后使活性降低,C5位羟基取代对活性基本无影响。




Xue等[41]以杨梅苷为原料,经全甲基化后,水解失去鼠李糖苷得到裸露3-羟基的杨梅素全甲基化中间体,在此基础上,设计合成了一系列3位取代的衍生物,并测试了这些衍生物的抗癌活性。他们选用人乳腺癌Bcap-37细胞、人乳房腺瘤MDA-MB-231细胞对上述衍生物进行筛选评价。MTT试验结果表明,针对Bcap-37 细胞,与阳性对照药阿霉素(AMD,2.87 μmol·L-1)相比,化合物12和13具有较高抗肿瘤活性,IC50分别为 2.96 和 3.11 μmol·L-1;针对 MDA-MB-231 细胞,化合物 14~19抑制 MDA-MB-231 的IC50分别为 2.16、2.90、3.03、3.87、3.40 和 3.75 μmol·L-1,表现出与阿霉素相近的抗肿瘤活性。
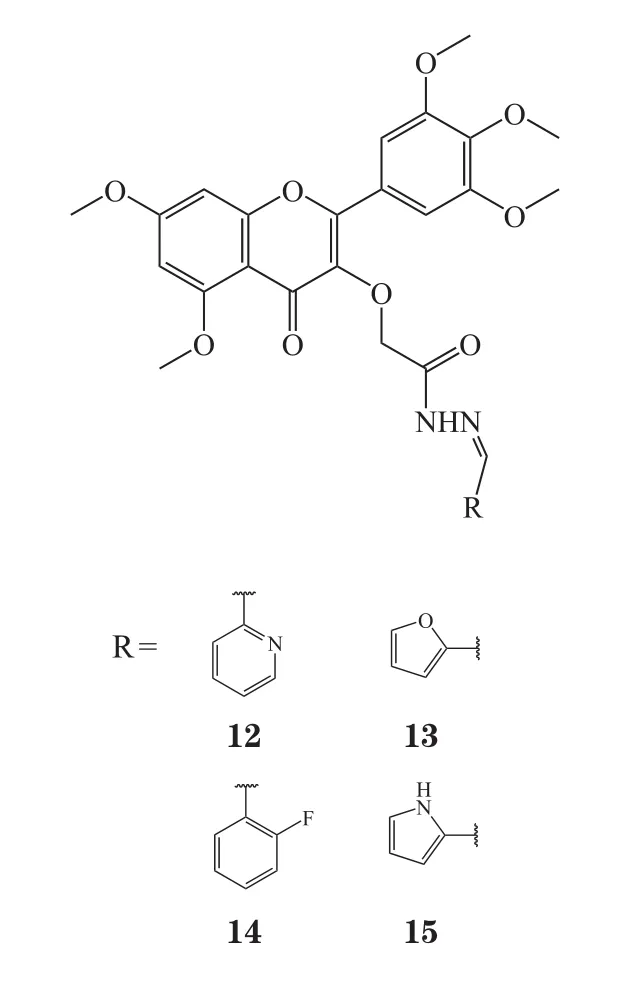

最近,肖维等[42]也在裸露3-羟基的杨梅素全甲基化中间体基础上,设计合成了12个杨梅素酰胺类衍生物。对3种不同植物来源的菌种的抗菌活性测试表明,化合物浓度均为 200 μg·L-1时,该系列衍生物均有一定抑菌活性,当R为苄基时(即化合物20),抑菌活性最佳;当R为苯基,且苯环4位取代基分别为-F(即化合物21)、-OCH3(即化合物22)、-CH2CH3(即化合物23)时,其对水稻白叶枯病菌的抑制率均高于90%;当R为环烷基时(即化合物24~25),对水稻白叶枯病菌的抑制率高于同等浓度下的阳性对照药叶枯唑(抑制率为72.85%)。研究表明,杨梅素3位取代基的电负性对抑菌活性有一定影响。

2.3 杨梅素醚化衍生物
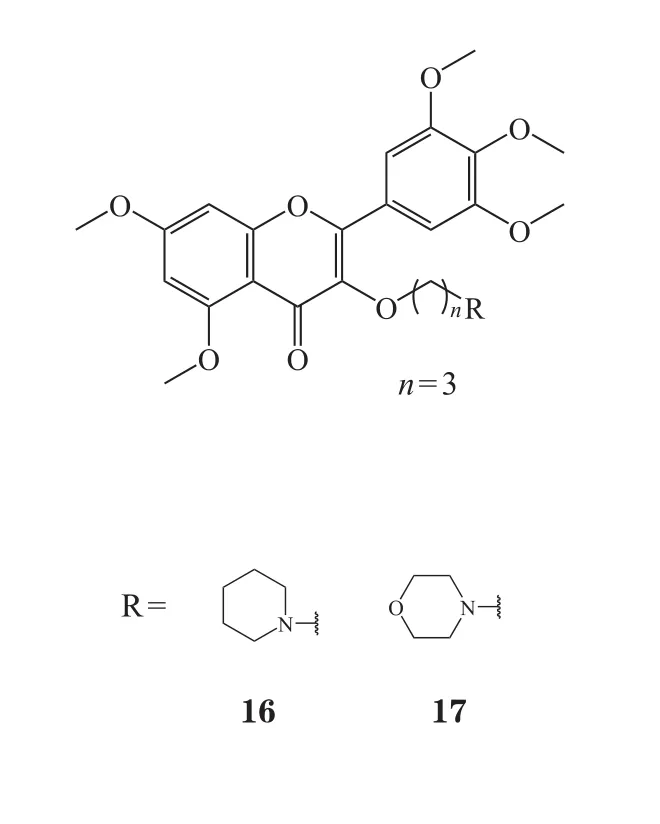
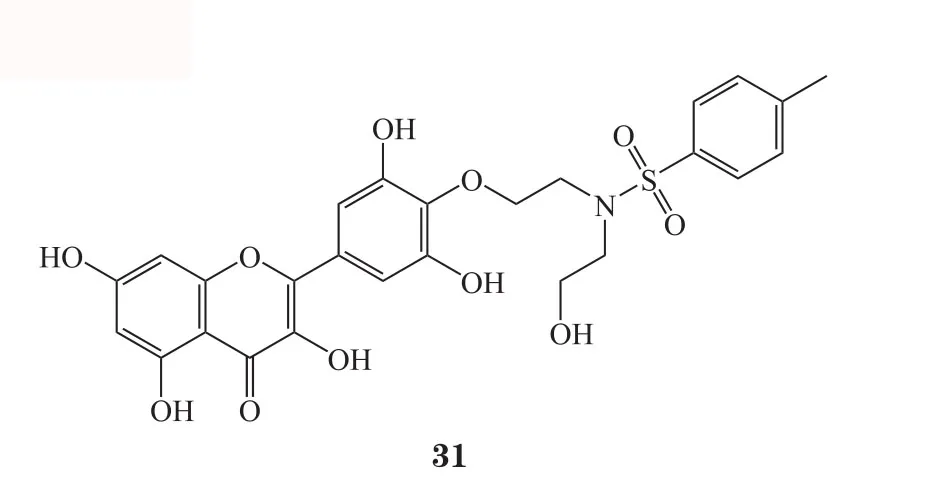
Chen等[43]评估了杨梅素、二氢杨梅素及杨梅苷对α-葡萄糖苷酶的抑制活性,结果显示,杨梅素表现出良好的抑制活性(IC50=319.3 μmol·L-1),而二氢杨梅素(IC50=633.9 μmol·L-1)和杨梅苷(IC50=837.7 μmol·L-1)抑制活性不及杨梅素。二氢杨梅素活性低于杨梅素,表明结构中C环的双键对化合物活性较为重要;杨梅苷可能是由于C环C3位缺乏羟基而导致活性低于杨梅素。因此,在保留C环双键及C3位羟基基础上,对杨梅素进行了结构修饰。基于碳-氧原子基团的拆分机制-分析,在二醇分子的两端进行亲核取代易离去基团OTs,即先将对甲基苯磺酰氯(TsCl)与醇(ROH)反应生成不同的对甲苯磺酸二醇酯,然后在弱碱条件下使OTs离去,醇链与杨梅素偶联得到6个杨梅素醚化衍生物(26~31)。通过对α-葡萄糖苷酶的抑制活性筛选发现,B环C4'位引入聚乙二醇后抑制活性增加,活性关系表明引入聚乙二醇的衍生物 27(IC50=43.8 μmol·L-1)活性最好。而在C4'位引入氮取代基团的衍生物30(IC50=41.1 mol·L-1)及衍生物 31(IC50=9.3 μmol·L-1)显示出更好的α-葡萄糖苷酶抑制活性,且较阳性对照药阿卡波糖(IC50=720.3 μmol·L-1)活性显著提高。体内实验发现,以 50 mg·kg-1的剂量口服给药,化合物 31 可以显著降低正常及链脲佐菌素诱导糖尿病大鼠的餐后血糖水平。该课题组亦对化合物31的抗菌活性进行了测定,结果表明,化合物31对供试植物细菌(蜡状芽孢杆菌、金黄色葡萄球菌、枯草芽孢杆菌、白菜软腐病菌、大肠埃希菌)均有强抑制活性,其抗菌效果优于杨梅素以及阳性对照药氨苄青霉素[44]。



2.4 杨梅素磺酸衍生物
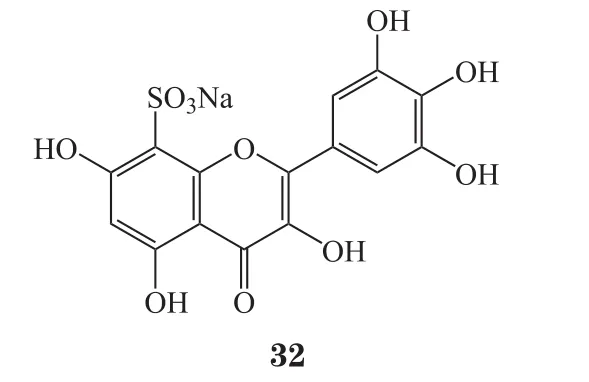
樊献俄等[45]设计合成了杨梅素磺酸衍生物及其相应的盐类化合物。实验表明,杨梅素磺酸盐衍生物具有治疗和预防心脑血管疾病的功能。首先以1 μmol·L-1血管收缩剂-血栓素A2类似物U46619收缩血管,然后累积加入不同剂量的药物(0.3、1、3、10、30、100、300、1 000 μmol·L-1),观察 SD 大鼠心脑血管的舒张反应,得到药物对收缩剂的舒张曲线,探讨受试药杨梅素磺酸盐对离体大鼠冠脉(CA)及脑基底动脉(BA)血管的影响。结果表明,在离体大鼠脑基底动脉环上,杨梅素磺酸钠(32)的 EC50为 (0.34±0.05) μmol·L-1,其对U46619所介导的SD大鼠脑基底动脉的收缩有舒张作用;研究还发现,酪氨酸激酶(JAK1、JAK2、JAK3 及 TYK2)是药物的分子作用靶点,20 μmol·L-1杨梅素磺酸钠对酪氨酸激酶JAKl、JAK2、JAK3及TYK2的抑制率分别为65.6%、103.3%、102.5%和97.6%,具有较强的抑制作用。
2.5 杨梅素糖苷化衍生物
糖苷化是重要的结构修饰方法。杨梅素的碳链骨架含多个羟基,在羟基上引入糖基,能够很大程度上改善杨梅素化合物的水溶性、生物利用度以及稳定性。杨梅素的糖苷化衍生物主要由酶促反应或糖苷化反应合成获得。糖苷化合成涉及多个官能团的保护和去保护,步骤繁琐,且区域选择性不高。高选择性的糖基转移酶可以很好地解决化学合成法的短板,因此,近年来生物酶促反应成为研究的重点。
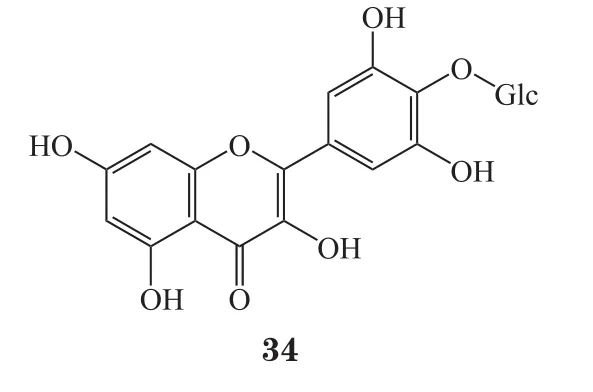
Bertrand等[46]在2006年使用从肠膜明串珠菌NRRL B-512F中分离的葡聚糖蔗糖酶和肠系膜明串珠菌NRRL B-23192中分离的交替蔗糖酶催化葡萄糖与杨梅素发生糖基化反应,分别得到B环上3位杨梅素葡萄糖衍生物(33)及4位杨梅素葡萄糖衍生物(34)。杨梅素糖基化反应前后的HPLC色谱图分析结果表明,3、4位的糖基化修饰在一定程度提高了杨梅素的水溶性。

Shimizu等[47]申请了关于改善体内杨梅素吸收和增强抗氧化能力的糖类衍生物的专利。通过将一个葡萄糖基、鼠李糖等其他单糖与杨梅素的C3'及C3位置的羟基缩合,得到取代位置不同的2类杨梅素单糖衍生物。体内外抗氧化实验表明,该类衍生物可以更有效地发挥抗氧化作用,且不同程度地改善了杨梅素的水溶性及体内吸收。实验结果显示,C3'取代衍生物抗氧化活性较低,表明B环邻苯三酚结构对于抗氧化活性的必要性。此外,该专利报道,该类衍生物对过氧化物导致的细胞老化及炎症具有潜在防治效果。
2.6 杨梅素其他衍生物
Polyakov等[48]通过对杨梅素进行一系列的取代反应,获得了杨梅素衍生物(见图2)。溶解度测试表明,新衍生物的水溶性大幅改善,尤以化合物35最为明显。但由于此类结构修饰方式对杨梅素本身结构变动过大,导致该类新衍生物在抗癌、抗菌、抗氧化及抗结核活性测试中均不及杨梅素,未能继续进行成药性研究。

图2 Polyakov等设计的杨梅素衍生物合成路线Figure 2 Synthetic route for myricetin derivatives designed by Polyakov et al
3 结语
结肠炎模型具有良好的抑制作用,疗效确切,重复性好;经比较发现,其疗效显著高于作为对照的杨梅素、柳氮磺胺吡啶、美沙拉嗪和阿司匹林;给药期间,动物体质量增长良好,未出现明显毒性反应,小鼠灌胃给药急性毒性实验显示半数致死剂量(LD50)大于5g · kg-1,具有良好的安全性。进一步的作用机制研究表明,M10能够明显抑制由于外界炎症因子刺激产生的内质网过度应激反应;另外,M10在抑制慢性炎症同时,也具有阻断炎症转化为癌症的作用,为肿瘤预防及治疗药物的开发提供了基础。
杨梅素作为一种天然的黄酮类活性成分,具有广泛的药理活性,且毒性较小,但其水溶性、生物利用度以及稳定性较差影响了杨梅素的开发应用。因此如何对杨梅素进行合理的结构改造,既能保留并增强其药理活性,又能提高其水溶性、生物利用度以及稳定性,成为目前杨梅素开发的关键和难点。为解决这些问题,药物化学家们针对杨梅素结构进行了大量优化工作,获得了一些药理活性更好、成药性更强的衍生物。可以相信,杨梅素类天然产物的开发具有重要的应用前景与现实意义。
基于曲显俊教授课题组的前期研究[49],为改善杨梅素水溶性低、稳定性差等缺点,近来,本课题组在杨梅素结构基础上进行了一系列糖基化修饰,设计合成了多个杨梅素二糖衍生物(结构通式为36),通过对这些杨梅素糖类衍生物进行体内外生物活性筛选,发现其中通过二糖修饰的杨梅素衍生物M10具有高效低毒的成药价值。实验结果显示,M10对小鼠溃疡性

