计算机辅助药物设计在抗耐药菌药物研发中的应用进展
2019-04-24石诚郑珩
石诚,郑珩
(中国药科大学生命科学与技术学院,江苏 南京 210009)
计算机辅助药物设计(computer-aided drug design,CADD)已成为制药公司和学术界的重要工具[1]。更快、更便宜的计算机以及相关软硬件的发展使得以原子尺度模拟复杂生物系统成为可能,极大地促进了CADD的发展,如扎那米韦、伊马替尼等药物被成功开发上市[2]。Singh等[3]利用CADD对其所设计的乙酰靛红腙和乙酰基螺噻嗪的文库进行筛选,得到了具有显著抗菌活性的乙酰靛红1e(该化合物对大肠埃希菌的体外IC50为1.95µmol·L-1)以及针对白色念珠菌的先导化合物 1n(其体外 IC50为 15.67µmol·L-1)。通过定量构效关系(quantitative structure-activity relationship,QSAR) 对化合物的生物活性的取代基效应进行预测,并使用分子对接研究了可接受的细菌和真菌蛋白质选择的支架,从而得到了靛红的最高的配体效率。除此以外,分子相互作用揭示了3'N取代的靛红衍生物可作为抑制细菌和真菌感染疾病的有效候选物。CADD的方法主要可分为2类[4]:基于蛋白质结构(三维)的药物设计(structurebased drug design,SBDD)和基于配体(二维)的药物设计(ligand-based drug design,LBDD)(见图1),在本综述中,笔者将分别介绍这2种方法在新型抗耐药菌药物设计和筛选中的应用。

图1 计算机辅助药物设计的代表性工作流程Figure 1 Representative workflow of computer-aided drug design
1 基于蛋白质结构(三维)的药物设计
SBDD方法主要用于分析大分子三维结构信息,通常是蛋白质或核酸,以确定对其各自生物功能很重要的关键位点和相互作用。然后利用这些信息来设计抗菌药物,其可竞争性地结合于靶标,从而中断微生物存活所必需的生物途径[5]。SBDD可以分为2类[6]:从头设计(de novo)方法和虚拟筛选(virtual screening,VS)方法。此过程中往往也会使用分子动力学(molecular dynamics,MD)模拟来深入了解配体与靶蛋白的结合模式,并研究相互作用过程中结构的变化。
1.1 De novo方法
De novo方法利用来自3D受体的信息来发现与结合位点良好匹配的小片段,然后根据适当的连接规则连接,产生一种结构新颖并可以合成的配体,用于进一步筛选。如Boibessot等[7]就基于这种策略设计出了一系列抑制细菌组氨酸激酶(histidine kinase,HK)的噻吩衍生物。组氨酸激酶是细菌双组分信号转导系统(twocomponent signal transduction system,TCS)的重要组成部分,细菌体内通常存在几十对TCS,调控了包括细菌趋化性、孢子形成、营养元素代谢以及次级代谢产物合成等许多重要的生理过程。由于TCS目前只在细菌和哺乳动物之外的真核生物中被发现,而在人类和其他哺乳动物体内尚未被发现,因此可作为新型抗菌药物作用靶标。在这个研究中,他们基于一个分辨率为1.61×10-10m的激酶WalK(PDB:3SL2)ATP结合结构域的X射线结构,设计了能与结构中关键元素形成氢键和疏水相互作用的片段,连接成新的配体化合物,再经过VS方法获得了8种能显著抑制TCS中组氨酸激酶的噻吩衍生物(1~8),其中化合物2和8对枯草芽孢杆菌等多种细菌具有广谱活性,最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)基本均在 7~32mg·L-1之间。
还有一个较好的例子是Jakopin等[8]对DNA促旋酶抑制剂的设计,DNA促旋酶和拓扑异构酶Ⅳ是Ⅱa型拓扑异构酶,它们是在转录和复制过程中监督DNA拓扑状态所需的必需细菌酶。它们的ATP酶结构域GyrB和ParE分别被认为是小分子抑制剂的可行靶标。在此研究中,作者将最近公开的一系列吡咯酰胺GyrB抑制剂作为先导结构,基于取代的5-苯基-1,2,4-二唑中心支架设计了其类似物的小型文库。其噻唑羧酸部分被二唑-羧酸生物异构取代,通过优化而得到的一系列化合物中,化合物9活性最好,其对大肠埃希菌DNA旋转酶的 IC50为 1.2µmol·L-1,对粪肠球菌 ATCC29212MIC 可达 75µmol·L-1,对大肠埃希菌拓扑异构酶Ⅳ和相应的金黄色葡萄球菌ATCC25923均表现出显著的抑制作用。


1.2 虚拟筛选
VS是一种快速且廉价的方法,利用小分子文库(见表1),可以鉴定替代目标生物分子现有配体的具有特定生物活性的化合物,或发现具有可用结构信息的未探索的已知靶标的化合物[9]。

表1 计算机辅助药物设计的各种常用软件及资源Table 1 Various commonly used softwares and resources for computer-aided drug design
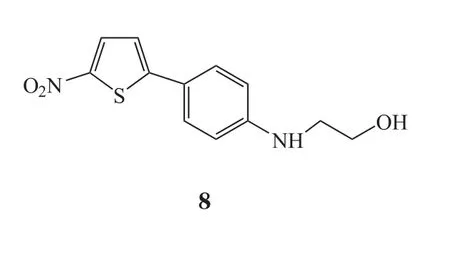
在VS过程中常需使用分子对接,用来预测化合物在特定目标结合位点的可能的结合模式,并基于其构象以及与结合口袋中发现的特征的互补性来估计亲和性[10],随着计算机技术的发展,VS也越来越多地被应用于生物领域,包括对抗生素耐药性的研究[11-12],其巨大潜力和价值已经通过各种抑制剂和拮抗剂的发现得到证实[13],例如4SC-101(10)[14],新型极光激酶A抑制剂(化合物11)[15],新型抗菌骨架ZINC00978022(化合物12)和ZINC24469052(13)[16]以及HIV-1逆转录酶和DNA聚合酶的双重抑制剂(化合物14)[17]。

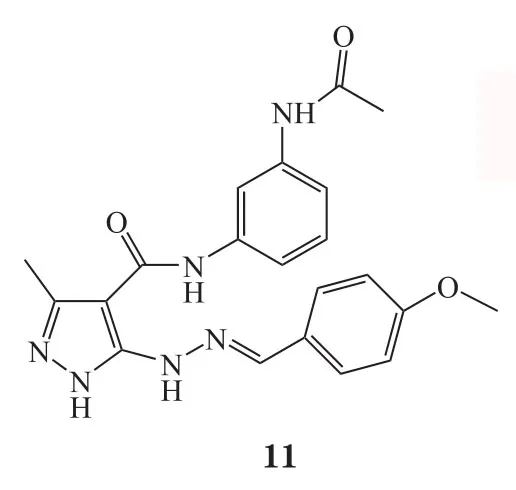
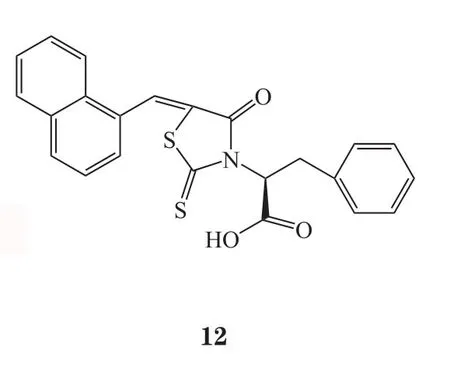
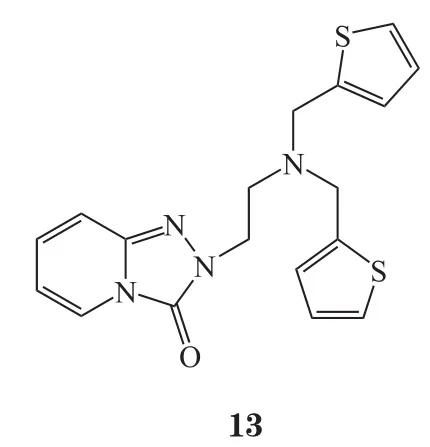

Gudzera等[18]报道了利用VS方法筛选结核分枝杆菌(M. tuberculosis)亮氨酰tRNA合成酶(Leucyl-tRNA synthetase,LeuRS)的小分子抑制剂。LeuRS在蛋白质合成中起着不可或缺的作用,它们的结构在原核生物和真核生物中存在差异,这种结构差异可用于开发抑制病原体合成酶但不抑制人类相关功能的药物,由于其酶活性位点中关键氨基酸不易发生突变,因此这类酶抑制剂不太可能诱发耐药性。最近,LeuRS已经被临床验证为开发新型抗耐药菌药物的靶标[19]。作者通过对结核分枝杆菌和人LeuRS的氨基酸序列进行比对,发现2种酶活性位点的氨基酸序列具有显著差异,可开发针对结核分枝杆菌LeuRS的选择性抑制剂。使用已知的嗜热栖热菌LeuRS结构作为模板,预测了结核分枝杆菌LeuRS的三维结构,通过筛选100000个有机化合物的化合物文库,最终发现6种对结核分枝杆菌LeuRS具有抑制活性的化合物。其中活性最好的化合物2,6-二溴-4-{[4-(4-硝基-苯基)-噻唑-2-基 ]-亚肼基甲基 }-苯酚(15),对结核分枝杆菌耐药株LeuRS的IC50为2.27μmol·L-1。对所有活性化合物的抗结核分枝杆菌耐药株H37Rv作用进行检测,4-{[4-(4-溴-苯基)-噻唑-2-基 ]亚肼基甲基}-2-甲氧基-6-硝基-苯酚(16)表现出最佳活性,IC50为 10.01 μmol·L-1。
除此以外,VS也经常与其他方法联用,最近,Li等[20]利用分子对接模拟与基于分子相互作用的指纹(interaction fingerprints,IFPs)的方法对金属-β-内酰胺酶(metal beta lactamase,MBL)VIM-2 晶体结构进行VS,得到能与重要的催化活性位点残基如Arg228、Asn233、Phe61、Tyr67和Asp120以及锌离子相互作用的化合物,再使用荧光法进行二次筛选,用核磁共振光谱方法检测了化合物与apo-VIM-2以及含有锌离子的Zn(II)VIM-2的结合模式,最后通过结晶学分析发现了MBL抑制的新模式,该化合物与活性位点锌离子相邻残基结合,但不涉及金属螯合。这可能有助于筛选临床上有用的靶向MBL的抑制剂。
2 基于配体(二维)的药物设计
在潜在药物靶标结构未知的情况下,使用诸如同源性建模或从头结构预测等方法预测该结构是具有挑战性的,因此我们需要从一组对相关靶标(受体或酶)具有活性的配体中取得信息,从而鉴定能够产生生物学活性的结构或物理化学性质(分子描述符)[21]。
2.1 定量构效关系
QSAR方法主要基于将目标药物相互作用活性与各种分子描述符相关联的统计学。由于结构相似的分子倾向于显示相似的生物活性[22],可根据计算实验确定的生物活性与小配体结合剂的各种性质之间的相关性来获得QSAR。QSAR和药效团模型之间的一个区别在于,药效团模型是基于活性配体的必要或基本特征构建的,而QSAR除了考虑基本特征外,还考虑了影响活性的特征,在建立QSAR后,可以使用交叉验证[23]等方法对这些模型进行验证。通过对分子特征的研究,QSAR模型可用于预测新型分子的生物活性和筛选分子数据库以找到潜在的活性分子。
最近,为发现抗革兰阴性细菌的有效抗生素,Lee等[24]对鲍氏不动杆菌 KASⅢ(abKAS III)的抑制剂YKsa-6进行了QSAR研究,评估了YKsa-6类似物中疏水基团羟基的位置和数目等对其抗革兰阴性细菌活性的作用,发现这些化合物的疏水性对抗革兰阴性细菌活性是很关键的。基于此筛选出2个活性化合物YKab-4(4-[(3-氯-4-甲基苯基)氨基亚氨基甲基 ]苯-1,3-二醇)(17)和YKab-6(4-[[3-(三氟甲基)苯基]氨基亚氨基甲基]苯酚)(18),其表现出强效抗菌活性,对 abKAS III的 MIC 为 2~8mg·L-1。
QSAR的成功取决于选择的分子描述符以及模型预测生物活性的能力。通过将统计学方法应用于线性QSAR可以选择对预测生物活性很重要的分子描述符,然而,生物活性与分子描述符之间的关系并不总是线性的。利用机器学习方法,如神经网络和支持向量机方法可生成QSAR非线性拟合模型来解决这个问题。通常使用主成分分析(principal component analysis,PCA)去除非独立的描述符来简化拟合的复杂性。如Ciura等[25]使用薄层色谱获得大环内酯类抗生素的亲脂性和疏水性参数,利用色谱数据和计算的亲脂性之间的统计学相关性构建QSAR模型,预测了大环内酯类抗生素对化脓性链球菌、肺炎链球菌和单核细胞增生李斯特菌等微生物的生物活性。




2.2 药效团模型
药物筛选旨在鉴定含有不同骨架的化合物,他们具有特定的3D结构与靶标产生相互作用[26],因此,当前药效团的研究可以基于候选化合物的生物活性构象,将结合位点信息也并入药效团模型中。获得药效团模型的方法也常基于配体分子的叠合[22]。几种常用的自动药效团生成程序包括Discovery Studio、PHASE、LigandScout和MOE等,已经广泛运用到药物筛选中,一个典型的例子是Eissa等[27]对所合成的一系列新的(6-甲氧基-2-萘基)丙酰胺衍生物潜在抗菌活性的探索,使用Discovery Studio2.5软件进行药效团生成,用于指导构建3D-QSAR药效团模型,预测化合物活性。
在缺少受体3D信息和一组活性配体的情况下,可以创建序列衍生的3D药效团模型。根据相似的受体可以与类似的配体结合的概念,3D药效团可以使用同源模型和3D晶体结构来检测蛋白质家族中配体生物分子识别的共同序列基序,并创建单一特征药效团数据库。如Koseki等[28]使用的基于药效团的VS方法,他们使用MOE软件构建含有461383种化合物的虚拟库(化合物信息来自ChemBridge数据库),通过对候选化合物KTP3的结构进行相似性搜索和筛选,鉴定了2种具有显著活性的化合物——KTPS1和KTPS2,它们对耻垢分枝杆菌的半数最大抑制浓度分别为8.04和17.1µmol·L-1,这些化学物质的结构和生物学信息可能有助于开发用于治疗结核病的新型抗生素。虽然药效团模型也有其局限性,但这对于有限或没有受体和配体信息的药物靶标是具有吸引力的技术。
3 结语与展望
虽然CADD具有明显的优势,但必须指出的是,CADD还面临着一些挑战,例如如何准确识别和预测配体结合模式和亲和力等。药物发现需要面对的困难之一是药物多态现象。当药物具有不同的形式如化学式相同但结构不同时,则会发生药物多态性,这对成功研发药物有很大的影响。为了满足实际的需要,研究者们往往也会同时使用SBDD和LBDD的方法,因为这2种方法在优点和缺点上可以互补,在药物研发工作中结合不同的基于结构和基于配体的设计策略也已经被确认为比任何单一方法都更有效[6],一个例子是杂合对接程序HybridDock[29],它结合了基于结构和基于配体的方法。这种杂合方法能显著改善结合构象和结合亲和力的预测结果。
随着多重耐药的爆发,CADD为抗耐药菌新药的研发提供了新的思路。常用策略包括对靶向突变蛋白的小分子调节剂的设计,在已知耐药突变体结构的情况下,设计构建其与药物结合形成的复合物,并从复合物中得到有价值的信息。Frey等[30]就是基于此,通过确定二氢叶酸还原酶(dihydrofolate reductase,DHFR)的双突变体(H30N/F98Y)与抗叶酸剂所形成的复合物晶体结构,从而发现了金黄色葡萄球菌DHFR中的突变抗性机制。除此以外,借助计算机手段还有可能探索由其他机制(与蛋白质突变无关)而导致的耐药性,一个典型的例子是β-内酰胺酶抑制剂的开发[31],研究人员使用化合物库的VS和结构引导优化,得到数百种晶体结构(独立存在或与抑制剂结合的形式存在),使得可能深入了解所涉及的抑制机制,从而发现有效的抑制剂(内酰胺和非内酰胺)[32],如clavulanate(19)、tazobactam(20)和sulbactam(21)。除此以外,CADD也可用于描述抑制剂与不太可能发生突变的蛋白质区域的相互作用,从而揭示新的耐药机制,避免抗性的发展[33]。


总而言之,以上的例子已经成功证明了CADD在开发抗耐药菌药物方面的潜力,虽然也有着一些限制,但是毫无疑问,这种以知识为导向的方法已经成为药物设计过程中的一个重要部分。它能够通过利用已有的受体-配体相互作用的知识和理论,来指导药物的发现、能量和结构优化,以及优化合成路线,在过去的10年中,随着基因组、后基因组计划的开展,人们已经鉴别出大量疾病相关的潜在靶点,理论计算方法诸如蛋白质结构预测、虚拟高通量筛选和对接等已被用于加速药物发现过程,学术界和制药工业使用基于配体的方法筛选到许多广谱抗结核药物,目前正在评估其临床疗效。
从算法的角度上,CADD还需要重点研究分子柔性以及溶剂,提高药物对受体的靶向性以及计算效率。与此同时,需要整合现有的基于硅片的技术,将化学、结构生物学、生物信息学以及计算技术领域有机地结合起来。由此,可减轻虚拟药物发现方法的一些缺点,并且尽可能挖掘CADD的全部潜力。
