平衡转化率问题分析
2019-04-24湖北罗功举
湖北 罗功举
平衡转化率问题分析是化学平衡知识中的一个重要考点,也是一个较难点,有些学生碰到这类问题常常束手无策,容易出错。故将其常考题型及解题方法归类分析如下,以供学习参考。
一、定性比较
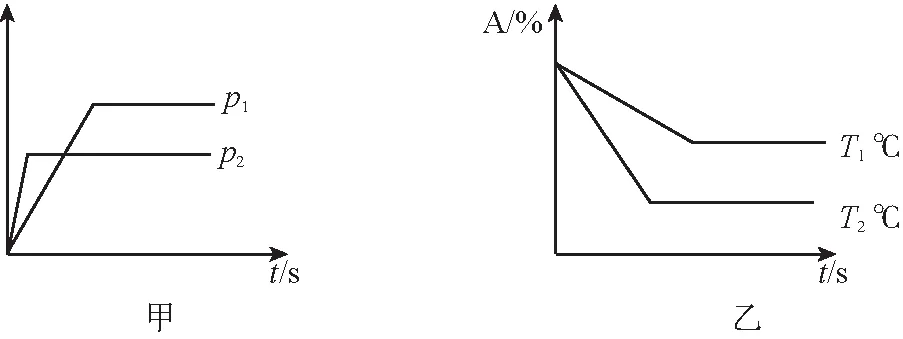
方法精要:对于比较抽象性的问题,可以采用模型分析法,即先虚拟一个过渡态(此时平衡不移动,则百分含量、平衡转化率不变,n、c是否变化看问题类型,是T、V条件时 Δn≠0情况还是T、V条件时Δn=0情况或是T、P条件),然后看平衡实际移动情况,若n总增大、p总增大(绝热容器考虑T变化),则平衡向气态物质计量数之和减小的方向移动;再结合平衡移动规律,判断转化率、n、c的变化。以SO2与O2反应生成SO3为例:

甲甲2 mol SO2+1 mol O22 mol SO2+1 mol O2虚拟(将2个甲压缩到一个容器中,平衡不移动)→
4 mol SO2+2 mol O2乙
虚拟后,甲、乙(两容器体积相同)中平衡转化率相等;但实际上,乙中n总增大、p总增大,平衡正向移动,故乙中的转化率大于甲中的转化率。


表1
下列说法正确的是
( )
A.c1+c2=c3B.α2+α3>1
C.p1+p2 【解析】甲中投入1 mol N2、3 mol H2,乙容器中投入 2 mol NH3,恒温恒容条件下,甲容器与乙容器是等效平衡,各组分的物质的量、含量、容器内压强等完全相等,且α1+α2=1;而甲容器投入1 mol N2、3 mol H2,丙容器加入2 mol N2、6 mol H2,丙中加入量是甲中的2倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器为等效平衡,所以丙所到达的平衡,可以看作在恒温且容积是甲容器2倍的条件下,到达平衡后,再压缩体积为与甲容器体积相等所达到的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向正反应方向移动,所以丙中氮气、氢气转化率大于甲,即α3>α1,平衡时丙中的NH3浓度比甲的 2倍还要大。 A项,由分析可知,平衡时c1=c2,而2c1 【点评】遇到定性比较问题时,先要寻找或设置一个“比较标准”,再用模型法将其他问题的变化情况展示出来,然后与“比较标准”对照,得出结论。 方法精要:涉及定量计算问题时,一般用“三段式”法列式、厘清各物质的有关量,再根据反应速率计算式、平衡常数计算式、已知条件等列式求出转化浓度(Δc),然后用转化率计算式进行求算。其计算步骤如下: 1.三段式模式 c(初)(mol·L-1)n1n20 0 2.列式计算 依据有反应速率计算式、平衡常数计算式、已知条件等,列式计算,最后求出转化浓度(Δc)。 3.求算转化率 ( ) A.5% B.17% C.25% D.33% 起始浓度(mol/L) 1.0 0 0 转化浓度(mol/L)x0.5x0.5x 平衡浓度(mol/L) 1.0-x0.5x0.5x 【点评】用“三段式”进行计算时,若涉及平衡常数,①起始量、转化量、平衡量用浓度单位为宜,否则易出现错误;②先写K的表达式,再带入数据,计算求解。 方法精要:分析化学反应速率或化学平衡图象题时,主要按以下方法进行判断: 1.看图象:一看面,即纵、横坐标的意义,都要与化学原理相联系,特别是与平衡移动原理相联系;二看点,即起点、拐点、交点、终点;三看线,即线的走向和变化趋势;四看辅助线,即等温线、等压线、平衡线等;五看量的变化,如浓度变化、温度变化、转化率变化、物质的量的变化等。 2.依据图象信息,利用平衡移动原理,分析可逆反应的特征:吸热还是放热(由温度变化情况推导),气体化学计量数增大、减小还是不变(由压强变化情况推导),有无固体或纯液体参加或生成等。纵坐标为反应速率时,可用三步分析法推导:一看反应速率是增大(外因可能是增大浓度、加压、升温、加催化剂)还是减小(外因可能是减小浓度、减压、降温);二看v正、v逆的相对大小,其交点为平衡点;三看化学平衡移动的方向。 3.先拐先平:在化学平衡图象中,先出现拐点的反应先达到平衡,可能是该反应的温度高、浓度大、压强大或使用了催化剂。 4.定一议二:勒夏特列原理只适用于一个条件的改变,所以图象中有三个变量时,先固定一个量不变,再讨论另外两个量的关系。 ( ) 图1 A.温度T1℃比T2℃高 B.正反应为放热反应 C.甲图纵轴可以表示A的转化率 D.甲图纵轴可以表示混合气体平均相对分子质量 【解析】A项,分析乙图,温度越高,化学反应速率越快,先达到平衡状态,所以T1℃比T2℃低,故错误;B项,升高温度,A的百分含量减小了,即升温平衡正向移动,所以该反应的正方向为吸热反应,故错误;C项,分析甲图,增大压强,化学反应速率加快,先达到平衡状态,所以p2大于p1,加压,化学平衡逆向移动,A的转化率减小,所以甲图纵轴可以表示A的转化率,故正确;D项,增大压强,化学平衡逆向移动,气体总分子数减小,气体总质量不变,所以混合气体平均相对分子质量增大,所以甲图纵轴不能表示混合气体平均相对分子质量,故错误。答案为C。 【点评】分析图象类问题时,一要弄清楚点、线、面的含义;二要注意将图象的意义(外因与结果的对应关系)与规律内容相结合;三要灵活选择方法,如排除法、代入法等。 跟踪练习: ( ) A.可逆反应的化学方程式中化学计量数:a>b+c B.压缩容器的容积时,v正增大,v逆减小 C.达到新平衡时,物质X的转化率减小 D.达到新平衡时,混合物中Z的质量分数增大 ( ) A.平衡后CO的体积分数为40% B.平衡后CO的转化率为25% C.平衡后水的转化率为50% D.平衡后混合气体的平均相对分子质量为24 ( ) 图2 A.p3>p4,Y轴表示A的转化率 B.p3>p4,Y轴表示B的质量分数 C.p3>p4,Y轴表示B的转化率 D.p3>p4,Y轴表示混合气体的平均相对分子质量 【解析】1.A项,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍,说明平衡向逆反应方向移动,则应有a 【解析】2.设达到平衡时,反应消耗CO的体积为x。 起始体积: 30 mL 20 mL 0 0 变化体积:xxxx 平衡体积: 30 mL-x20 mL-xxx 由题意知:20 mL-x=x,故x=10 mL二、定量计算

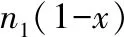



三、图象分析