基于“考纲”下的高三化学专题复习对策——以“物质结构与性质”为例
2019-04-24河北颜建河代景坤
河北 颜建河 代景坤
高三复习,如何才能获取正确的备考方向呢?这是我们广大师生所要面临的首要问题,给高三学生一个高效的备考方向,教师要建立基于化学学科核心素养的单元教学内容体系,强化学生学科素养和学习潜力的培养。这就要求我们的教师在复习中紧扣“考纲”,着眼于“专题”复习,才能做到提“效”增“益”。从近年来的高考试题中不难发现,高考命题注重考查能力,强化对化学学习能力的要求。其着眼点主要体现在:第一,接受、吸收、整合化学信息的能力;第二,分析和解决化学问题的能力;第三,化学实验与探究的能力。基于此,依据化学的学科体系和学科特点,立足“课本”,强化“基础”;突出“主干”,体现“方法”,才是复习之本。本文从以下几个方面对物质结构与性质进行针对性的复习,以实现复习的最大效益。
对策之一:立足“考纲”,明晰考点
《物质结构与性质》在高考中属于选考内容。立足“考纲”,明晰考点,特别要强化《考试大纲》对每个知识内容的要求层次,努力做到由点到线,由线到面,形成完整的知识基础体系,实现对基础知识的再认识,做到了解、理解(掌握)、综合应用的目的。所以考生必须认真对照课本进行针对性的复习,以期真正掌握,学以致用。
对策之二:明晰“考点”,强化知识
基础和能力是相辅相成的,没有基础,能力就缺少了扎根的土壤。《考试大纲》明确了对知识内容的层次要求,特别是涉及理解(掌握)和综合运用的知识,必将成为高考的核心考点。为此,在复习备考中要做到能领会所学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。能“知其然”,还能“知其所以然”,从而实现知识的再升华。同时,高考强调命题要突出主干知识(核心知识)考查,不回避考试热点和传统题型,不再过分强调知识的覆盖面,而是抓住主干知识,突出能力测试的主导地位。
热点之一:原子结构
1.核外电子排布式书写
(1)由元素名称书写核外电子排布式
①前三周期主族元素可以根据最外层电子数书写。例如,S的最外层电子数为6,其电子排布式为[Ne] 3s23p4。
②第四周期的元素从K开始数,数到几,外围电子数就是几。例如,Fe,从钾开始数到Fe为8,其电子排布式为 [Ar] 3d64s2;Se,从钾开始数到Se为16,其排布式为 [Ar] 3d104s24p4。
(2)由原子序数书写核外电子排布式
①原子序数较小的常根据构造原理书写。例如,原子序数为6的C,其电子排布式为1s22s22p2。
②原子序数大于18的。例如,31号元素,我们也可以用31-18=13,然后再填充13个电子,即[Ar] 3d104s24p1。
说明:①能级交错(先排4s,再排3d);24号元素Cr及29号元素Cu价电子层特殊分别为3d54s1、3d104s1,所以Cr有6个未成对电子;②书写时3d在前4s在后,失去电子时,先失4s电子,再失3d电子。
2.电离能、电负性大小判断
(1)规律:在周期表中,电离能、电负性从左到右逐渐增大,从上往下逐渐减小。
(2)特性:同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素。
(3)方法:我们常常应用化合价及物质类别判断电负性的大小。例如,O与Cl的电负性比较:①HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl;②Al2O3是离子化合物、AlCl3是共价化合物,可知O的电负性大于Cl。
热点之二:分子的立体构型
1.化学键类型的判断方法
(1)共价单键是σ键、共价双键中含1个σ键和1个π键、共价三键中含有一个σ键和两个π键。
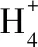
2.中心原子杂化轨道和价层电子对数的判断方法
杂化轨道数=价层电子对数=中心原子孤对电子对数(未参与成键)+中心原子形成的σ键个数。
3.中心原子孤对电子对数的判断方法
4.要注意运用孤对电子进行判断
(1)有孤对电子的分子均是极性分子。
(2)有孤对电子的分子,因为孤对电子的排斥力大,所以键角均小于无孤对电子的分子键角。例如,第ⅣA族元素Sn的化合物SnBr2分子中的键角小于三角形的120°,NH3、H2O分子中的键角小于正四面体的109°28′。
热点之三:物质的结构与物质的关系
1.判断晶体类型的方法
(1)类比法:记住几种常见晶体类型及结构。例如,金刚石、晶体硅、二氧化硅、氯化钠等。据此,采用类比方法进行判断。例如,氮化铝晶体与金刚石类似,可推断出氮化铝晶体的立体结构与晶体类型。
(2)熔沸点法:原子晶体的熔沸点及硬度很高、分子晶体的熔沸点及硬度低。例如,金属单质一定是金属晶体。
2.判断物质熔沸点的方法
(1)分子晶体还要注意氢键,能形成氢键的元素为第二周期中的后三种元素:N、O、F,所以凡含有N—H、O—H、F—H键的化合物均可以形成氢键。例如,NH3、氨基酸、NH2—NH2、H2O、醇、HF等。
说明:氢键只与物质的物理性质有关。例如,熔沸点、溶解性等,而与物质的化学性质无关。
(2)氢键分为分子内氢键和分子间氢键,分子内氢键对熔沸点几乎没有影响。
(3)离子晶体与晶格能有关,离子半径越小和离子所带电荷越多,晶格能越大。
(4)比较原子晶体之间熔沸点一般看共价键的键能大小或键长(原子半径大小)。
3.判断溶解性
依据“相似相溶”原理,极性分子(或盐)易溶于极性溶剂,非极性分子易溶于非极性溶剂,含有氢键的易溶于含有氢键的溶剂。
4.判断酸性
(1)结构相似的气态氢化物的酸性与共价键的键能有关。
(2)含氧酸的酸性与非羟基氧的数目有关。
热点之四:晶体的空间结构与性质
1.晶体化学式的求法

2.有关晶胞各物理量的关系
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a3×ρ×NA=n×M,a表示晶胞的棱长,ρ表示密度,NA表示阿伏加德罗常数,n表示1 mol晶胞中所含晶体的物质的量,M表示相对分子质量,a3×ρ×NA表示1 mol晶胞的质量。
3.记住一些常见晶体的晶胞
(1)氯化钠,配位数为6、一个晶胞中有4个Na+、4个 Cl-。
(2)氯化铯(体心立方),配位数为8、一个晶胞中有1个Cs+、1个Cl-。
(3)干冰(面心立方),配位数为12、一个晶胞中有 4个 CO2。
4.配位数的计算方法
在计算有关配位数及与它最近且距离相等的原子(或离子)时,常用的方法:
(1)记忆法。例如,NiO的晶体结构类型与氯化钠的相同,可知Ni、O的配位数均为6。
对策之三:强化“知识”,真题训练
练习是化学总复习的重要组成部分,是运用知识解决问题的再学习、再认识过程,也是促进知识迁移、训练思维、提高分析问题和解决问题能力的重要途径,但练习量必须合理,以保证质量为前提,避免简单的机械重复和陷入“题海”。为此,在复习选修3 《物质结构与性质》内容时,考生更应该强化课本知识,依据“考纲”对知识内容的要求层次,认认真真地梳理每一个知识点,做到了解、理解(掌握)、综合运用三个层次。同时,要实现这一目标,必须认真研读近几年的高考真题,了解高考命题方向,通过训练复习,提高解题技巧和准确性,优化解题思路和方法。做到在解决化学问题(习题)时,能从课本上查找依据的能力,明确认识试题的“源头”、基础都出自课本,来自课本。无论是简单题、难题的“根”都离不开课本,且都能从课本上找出依据,培养分析问题和解决问题的能力。
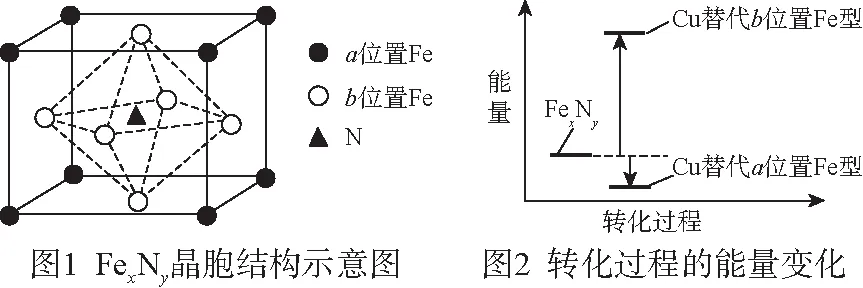
【例1】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为________。
(3)C、H、O三种元素的电负性由小到大的顺序为________。
(4)乙醇的沸点高于丙酮,这是因为________。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。

(1)Fe的原子序数为26,Fe3+基态核外电子数为23,且3d电子为半充满稳定结构,可知Fe3+基态核外电子排布式为[Ar]3d5或 1s22s22p63s23p63d5。

(3)非金属性越强,电负性越大,则C、H、O三种元素的电负性由小到大的顺序为H (4)乙醇的沸点高于丙酮,这是因为乙醇分子间存在氢键,导致沸点高。

