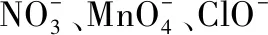高考离子反应试题中陷阱的布设和预警
2019-04-24甘肃
甘肃 车 琳
新一轮课改化学学科提出五大核心素养,究其核心,关键还是思维能力培养。根据高考题型及化学学科的特点,对学生的训练,我们的策略是“先死后活,活中有死”,即知识储备要丰富;只有在丰富的知识储备基础上,才能拥有活跃的思维。而高考试题也正是基于上述两点要求,特别在思维的难度、跨度、灵敏度要求上较高,其题型特点往往会布设许多陷阱,或是提供多重信息,设置许多干扰因素,增加试题的难度;总结这些试题的规律特点,有助于提高学生的思维能力。事先明确其可能的陷阱,以防止学生掉入陷阱;才能提高做题的正确率和临场考试的应变能力。


气体,则溶液的颜色变化为
( )
A.绿色变深 B.浅绿色变得更浅
C.变黄 D.无明显变化
【解析】本题考查学生接受、吸收、整合化学信息的能力,试题中隐藏硝酸根离子在酸性环境中具有强氧化性的特性,学生易忽略硝酸亚铁这个信息;思维集中到水解平衡移动上,导致错误。同时这个试题要求学生对离子在溶液中的颜色也要熟悉,才能做出正确的判断。如果把硝酸亚铁变换为硫酸亚铁,那结果截然不同。
【答案】C
二、通过多信息干扰,增加试题难度,因此要深刻挖掘

( )


【答案】BC
三、看似单一信息,埋伏两面性
例3(2015·江苏·6)常温下,下列各组离子一定能在指定溶液中大量共存的是
( )



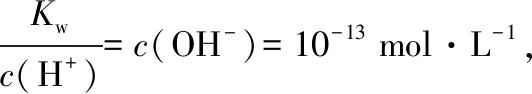
【答案】B
四、多重矛盾的干扰,造成不确定性,因此要注意多方情况

( )
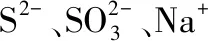
C.一定没有Ag+、Al3+
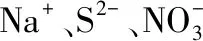

【答案】C
五、肯定中的否定,要注意思维的联想性
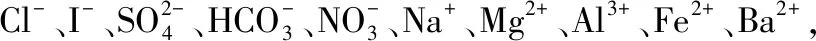
①加几滴甲基橙试液,溶液变红色;
②浓缩,加铜片和浓H2SO4,加热,有无色气体产生,后在空气中又变成红棕色;
③加BaCl2溶液,立即生成白色沉淀,取上层清液,加AgNO3溶液,出现白色沉淀,且不溶于HNO3;
④加NaOH溶液,有白色沉淀生成,当NaOH过量时沉淀部分溶解。
(1)溶液中肯定存在的离子是。
(2)溶液中肯定不存在的离子是。
(3)为进一步确定其他离子,应该补充的实验是。
(4)写出实验④中所有反应的离子方程式:。
(3)不能确定的是Na+、Cl-,需要进一步检验Na+、Cl-。钠离子采用焰色反应检验,若火焰呈现黄色,则说明原溶液中含有Na+;氯离子检验方法:取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3,若有沉淀生成,证明存在Cl-,否则不存在。
(3)首先取少量原溶液进行焰色反应,其次取少量原溶液,加入Ba(NO3)2溶液后,静置,取上层清液加入AgNO3溶液和稀HNO3



六、信息杂乱,利用思维导图,化繁为简

①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是;所含阴离子相同的两种盐的化学式是。
(2)D的化学式为,D溶液显碱性的原因是(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是;E和氨水反应的离子方程式是。
(4)若要检验B中所含的阳离子,正确的实验方法是
。
【解析】根据①~⑥的实验现象,因信息量大,防止造成混乱,可用下面的思维图式,因水溶液均为无色,可排除有色离子Cu2+、Fe3+,可直接从以下离子入手,根据共存情况和可能的组合,画出思维导图,化繁为简,从纷乱中理出头绪:
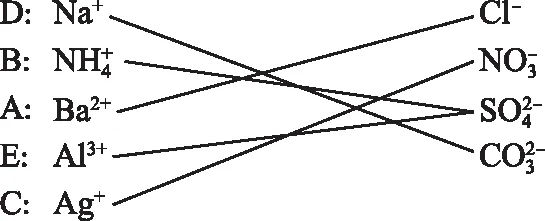
可判断出A为BaCl2,B为(NH4)2SO4,C为AgNO3,D为Na2CO3,E为Al2(SO4)3,据此解答,思路清晰,防止造成混乱。
【答案】(1)Cu2+、Fe3+(NH4)2SO4、Al2(SO4)3