解析探究性试题 培育学科核心素养
2019-04-24浙江方大学
浙江 方大学
科学探究活动是学生学习化学的一种方式,科学探究是化学学科核心素养的重要组成部分。《普通高中化学课程标准》(2017年版)给化学探究活动提出了明确的要求,即认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论;能和同学交流实验探究的结果,提出进一步探究或改进的设想;能尊重事实和证据,破除迷信,反对伪科学;养成独立思考、敢于质疑和勇于创新的精神。
探究型试题涉及的知识一般为课内知识,其中注重的是真实情境下研究问题、分析问题的过程和方法,设问点可以是问题的名称,信息、数据整合与应用,实验过程的完善、分析、比较、评价和改进,对给出实验现象的解释(尤其是异常现象的解释),根据实验对未知实验现象的大胆预测等。随着课程改革和高考改革的进行,培养学生终身学习的能力、信息搜集与数据整合的应用能力、探究能力将越来越被重视。现结合高考试题对探究型试题的命题基本原则、呈现过程、常见题型进行分析。
一、基本原则
(1)真实性原则:所设计的情境应该源于真实的生产、生活、实验,不能凭空捏造。情境和有价值的实验密切关联,体现探究性和实用性。
(2)科学性原则:要想某个实验更能够说明问题,一般要设计一个对照性的实验;所设计的实验中的平行反应,试剂的取用应该是等量的;对多因素影响的实验,要研究某个因素的影响,要人为控制条件,使众多变量中,只能在单因子的变量条件下探究等。
(3)体验性原则:让学生经历探究的全过程或某些关键环节,再现一个从困顿到澄明的问题解决过程,在解题过程中认识到科学探究是进行科学解释和发现、创造和应用的科学实践活动,达到有效评价学生探究素养的目的。
二、探究过程
科学探究过程包括提出问题和假设、设计方案、实施实验、获取证据、分析解释或建构模型、形成结论及交流评价等核心要素。教师应指导学生从问题和假设出发,明确研究目的,依据研究目的设计方案,基于证据进行分析和推理。
三、常见题型
1.数据图形分析探究型:(2017·北京·26·节选)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程如图1:
图1
资料:TiCl4及所含杂质氯化物的性质
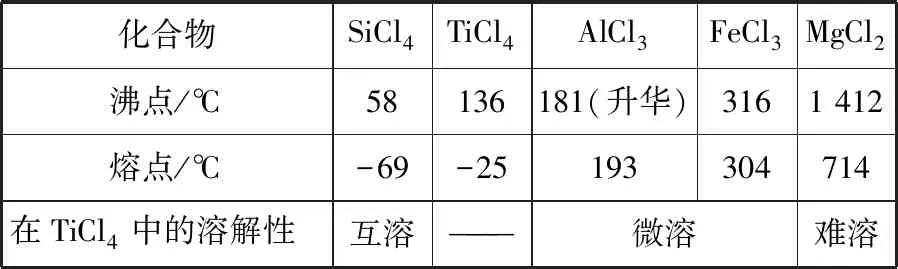
化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸点/℃58136181(升华)3161 412熔点/℃-69-25193304714在TiCl4中的溶解性互溶———微溶难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。

①沸腾炉中加碳氯化生成TiCl4(g)和CO(g),氯化过程中CO和CO2可以相互转化,根据图2判断:CO2生成CO反应的ΔH________(填“>”“<”或“=”)0,判断依据:_______。
②氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。如图3所示:
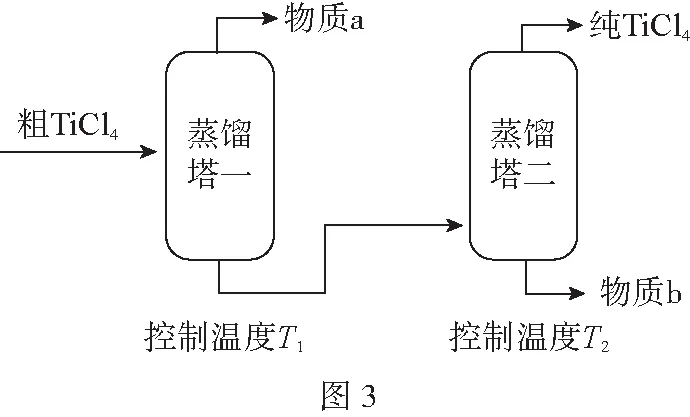
物质a是____________,T2应控制在____________。

【点评】本题考查物质的制备实验,为高频考点,把握流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合。
备考建议:(1)观察数据、图形要全面、仔细;(2)结合原有知识,分析角度要全面;(3)影响变量要遵循“多定一变”的原则。
2.实验方案选择评价型:(2017·江苏·19)某科研小组采用如图4方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
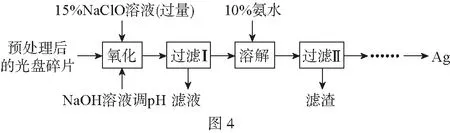




(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为____________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为____________。
HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是____________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并____________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为____________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:____________(实验中须使用的试剂有:2 mol·L-1水合肼溶液,1 mol·L-1H2SO4)。

(1)“氧化”阶段需在80℃条件下进行,不超过水的沸点,则适宜的加热方式为水浴加热,故答案为水浴加热。

(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中,减少Ag的损失。故答案为将洗涤后的滤液合并入过滤Ⅱ的滤液中。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应。故答案为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应。
(5)由信息③可知,从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案为向滤液中滴加2 mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置、过滤、洗涤、干燥。故答案为向滤液中滴加2 mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置、过滤、洗涤、干燥。
【点评】本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离提纯方法、实验技能为解答的关键,侧重分析能力和实验能力的考查,注意信息的应用及实验设计。
备考建议:(1)根据题的要求,利用自己的知识,仔细分析流程图中每步操作的实验原理和物料进出。(2)对实验方案优劣评价的角度常见有绿色化学(环保)、原子经济、实验条件的可行性等。

向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:

序号取样时间/min现象ⅰ3产生大量白色沉淀;溶液呈红色ⅱ30产生白色沉淀,较3 min时量少;溶液红色较3 min时加深ⅲ120产生白色沉淀,较30 min时量少;溶液红色较30 min时变浅
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于(用离子方程式表示),可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:________。

【点评】本题涉及物质的性质探究,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的严谨性和可行性的评价。
备考建议:(1)对于题中的异常现象要根据自己的原有知识进行大胆的排查、推测。(2)推测的正确性要靠实验来验证,如果题中给出验证实验,要仔细分析其是否合理;如果题中没给出验证实验,自己要设计合理的实验验证。

