对勒夏特列原理常见误解分析及教学建议
2019-04-24山东刘树领
山东 刘树领
勒夏特列原理是法国科学家亨利·勒夏特列于 1888年概括提出的。尽管它是源自于对实际工农业生产的一个经验性总结,但两次诺贝尔奖得主、著名化学家鲍林曾在学生毕业典礼上告诫学生:“你可以忘记化学中的很多东西,但不要忘记勒夏特列原理”,由此可知勒夏特列原理在化学家眼里是多么的重要。但当前许多教材编者正是基于其源自于经验总结,故认为其缺少科学推理,且在实际应用中易出现错误,导致编写教材时对其进行淡化处理,没有给予其应有的重要地位。事实上,在教学中只要勒夏特列原理应用得当,就能避免过多繁杂的定量计算与分析,使得平衡移动方向问题的解答变得简单,在当前倡导变化观念与平衡思想等化学核心素养方面具有重要的指导与引导作用。在此抛砖引玉,期待各位教材编写专家、化学同仁重新审视勒夏特列原理,并给予其足够的重视。
1 对勒夏特列原理常见错误观点的分析
1.1 对勒夏特列原理内容的翻译存在误解
经百度百科搜索,其英文描述“Every system in stable chemical equilibrium submitted to the influence of an exterior force which tends to cause variation either in its temperature or condensation (pressure,concentration,number of molecules in the unit of volume),in its totality or only in some of its parts,can undergo only those interior modifications change of temperature,or of condensation,of a sign contray to that resulting from the exterior force.”。现将对应的中文译文摘录为“任何稳定化学平衡系统承受外力的影响,无论整体地还是仅仅部分地致使其温度或压缩度(压强、浓度、单位体积的分子数),若它们单独发生的话,系统可以做内在的调节,使温度或压缩度发生变化,该变化与外力引起的改变是相反的。”由勒夏特列原理的原始描述可知,该原理只说明了平衡移动方向与外力(即外界条件)改变方向是相反的,即可以定性判断平衡移动的方向,但没有定量分析移动后的结果。由此可知,勒夏特列原理内容并没有“减弱”这一含义,只有平衡向外界改变的反方向移动这一属性,所以说当前人教版鲁科版等教材把勒夏特列原理内容描述为“如果改变影响平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动”,是偏离了勒夏特列原理的本意,出现一些令人遗憾的错误也就不可避免,正如“真理越雷池一步就是谬论”。若把“减弱”改为“阻碍”“抵制”等词语,就能重现勒夏特列原理的伟大。
1.2 勒夏特列原理仅是一个经验总结,缺少严密的理论推导


1.2.1浓度对化学平衡的影响

1.2.2压强对化学平衡的影响

1.2.3温度对化学平衡的影响

由上述定量分析可知:改变影响平衡体系(浓度、压强或温度)中任一条件时,平衡总是向阻碍这种改变的方向移动,这证明了勒夏特列原理具有严密的数学推理依据。
1.3 对三个外界影响因素内涵存在误解
影响化学平衡的三个外界因素浓度、压强、温度,大家都比较熟悉,但在具体应用时常常因其内涵理解出现歧义,而导致在解答问题时不知如何分析。

(1)保持体积不变,升高温度;
(2)保持温度和体积不变,充入一定量的氨气;
(3)保持温度和体积不变,充入一定量的氦气;
(4)保持温度和压强不变,充入一定量的氦气;
(5)保持温度和压强不变,充入一定量的氮气。
【分析】(1)体积不变、升高温度时,有人根据气体方程pV=nRT知,温度升高,平衡体系压强增大,故得出平衡应正向(气体物质的量减少)移动的错误结论,究其错因就是对温度与压强影响存在误解。温度影响的外在特征就是指只改变平衡体系的温度,不改变平衡体系的各组分浓度,而压强影响的实质特征就是浓度影响。
(2)温度和体积不变,充入一定量的NH3时,有人依据pV=nRT推知,容器内充入NH3必然导致平衡体系的压强增大,故得出平衡正向移动的错误结论,究其错因就是对浓度和压强影响存在认识上的误解。浓度影响是指平衡体系中只有一种组分的浓度发生变化,而压强影响是指平衡体系的各组分浓度同等程度地增大或缩小,否则就不属于压强影响的范畴。
(3)温度和体积不变,充入氦气时,有人依据pV=nRT推知,容器内充入氦气导致压强变大,故得出平衡正向移动的错误结论,究其错因就是对压强影响存在误解。压强影响是通过改变反应体系的浓度来实现的,稀有气体不参与任何化学反应,对平衡体系中各组分的浓度没有任何影响,故平衡不移动。通常所说的压强影响是指平衡体系(或反应体系)的压强,不一定就是容器内的压强。事实上容器内压强是平衡体系(或反应体系)压强与非组分(或杂质)气体压强加和而成,当容器内不存在非组分(或杂质)气体时,则容器内压强与平衡体系(或反应体系)压强是等同关系;当容器内存在非组分(或杂质)气体时,则容器内压强大于平衡体系(或反应体系)压强。本题中虽然充入氦气,但并没有改变平衡体系的压强,其简单判断方法就是分析平衡体系的各组分浓度有没有发生变化。
(4)温度和压强不变,充入氦气时,有人根据容器内压强不变而得出平衡不移动的错误结论,究其原因就是没有理解影响平衡的压强就是平衡体系的压强,只有平衡体系的压强不变时平衡才不发生移动。事实上充入氦气,容器体积增大,平衡体系的压强变小,故平衡向逆反应方向移动。

综上所述,勒夏特列原理中涉及的浓度、压强、温度等的具体含义为:浓度改变仅是指温度不变时平衡体系中的一种组分浓度发生变化;压强改变仅是指温度不变时平衡体系的压强变化,表现在所有气体组分的浓度均同等程度地发生变化;温度改变是指在所有组分浓度不变时只有平衡体系的温度发生变化。
1.4 对勒夏特列原理使用条件的误解
化学平衡的实质从微观上讲是正逆反应速率相等,从宏观上讲是各组分的浓度不再发生变化,而勒夏特列原理则是研究平衡受到外界因素影响的变化方向,因而运用勒夏特列原理解答相关问题时,首先给定反应是否达到平衡状态,若没有达到平衡则不能使用;其次是分析改变了哪一种外界条件,若多种外界条件改变则不能使用。


图1
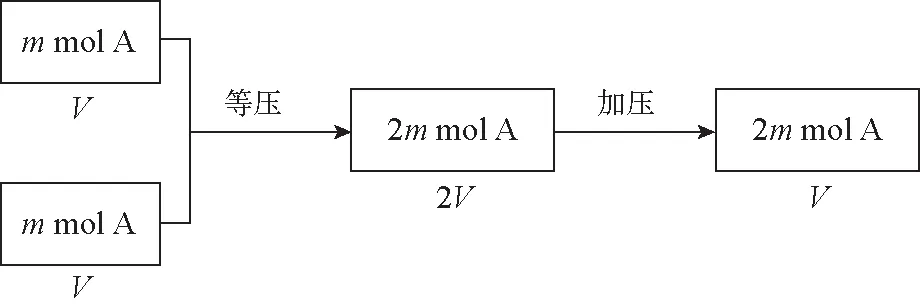
【分析】根据平衡实质可知,a、b两图象中正逆反应速率曲线的交点恰好是反应达到平衡状态,交点之前均没有达到平衡,故不能运用勒夏特列原理,其温度、压强的变化可以认为是反应自身进行导致的结果;交点之后的正逆反应速率不再相等,则分别是由外界温度、压强变化导致的,因而可以运用勒夏特列原理来解答反应的能量变化(放热或吸热)、反应前后气体的总物质的量变化(变大、变小或不变)等问题,即a图象中正反应是放热反应,b图象中(a+b) 同理对c图象,根据反应物X的百分含量变化特点可判断,在Q点之前反应是正向进行,直到Q点时恰好达到平衡,因而Q点之后的变化才能运用勒夏特列原理分析得出正反应为放热反应。 由上述分析可知,勒夏特列原理使用时首先要找到旧平衡状态,然后再分析外界改变的是哪一种条件。平衡之前的改变可以认为是反应在达到平衡状态的过程中自身引发的改变。 化学平衡无论如何移动,最终都会达到新的平衡状态,其中伴随着组分浓度、百分含量、压强大小、转化率等物理量的变化。 ( ) A.增大为原来2倍 B.比原来大,但不到2倍 C.不变 D.减小 【分析】此题答案在B、C之间出现争议。有人依据所学勒夏特列原理认为:在一定温度下,缩小体积则导致体系压强增大、CO2浓度瞬间变大,使平衡将逆向移动来减弱体系压强、CO2浓度增大,故再次平衡后“CO2的浓度比原来大但不到2倍”,即选B 。有人根据平衡常数K=[CO2]可知,温度不变时则K不变,则新平衡的CO2浓度与原平衡时相同,故答案为C。为何出现此矛盾呢? 其实,平衡移动方向与移动结果是两个不同的概念,移动方向仅是与外界改变的方向相反,属于过程阶段,而移动结果则是平衡状态时对应的各种物理量,这个结果可以是原状态也可以出现变化,故正确答案为C。 勒夏特列原理尽管来源于过去实际工业生产经验的总结,但随着时代的发展焕发出其科学活力并展现出应用的广泛性。 科学研究的目的就是从错综复杂的现象中找到其隐含的本质关系,进而用通俗易懂的文字或公式表达出来,所以科学不是为了追求复杂与故作深奥,而是为了简明扼要,通常用模型来体现。勒夏特列原理不但能运用于化学平衡,还能使用于其他的平衡系统,如物理学上粒子之间的引力与斥力之间的均衡关系、物体的静止或匀速状态、电磁感应等;化学上离子键、共用电子对的稳定,溶液中各种平衡体系等;生物学上的生态平衡、种群平衡、元素或物质的循环系统等;医学上的免疫系统相对稳定性、内环境酸碱度、血液中红白细胞的相对稳定等;心理学上的情绪逆反、距离产生美等,都可以运用勒夏特列原理去分析、去理解,都是平衡系统本身对外界因素影响的一种反应与调整,这种调整既可以完全恢复也可以部分恢复。突出勒夏特列原理的灵活运用,能够使学生感受到不同学科之间的共性与融合,形成完整的科学知识体系,利于培养学生学以致用、灵活迁移解答实际问题的能力。 分析或解答问题时,一般习惯于从宏观角度给予分析与研究,而勒夏特列原理具有得天独厚的宏观定性分析功能,因此突出其重要性,利于培养学生的宏观思维、整体思维及思维的简洁性。 【分析】平衡中再通入mmol A时,A浓度瞬间增大,故平衡一定正向移动。为了讨论方便,不妨先构建等温等容下的等同平衡,然后再在等温等压下把两个平衡体系加和,最后在等温等容条件下分析、解答问题。具体过程如图2所示。 图2 在两个平衡体系加和过程中,因温度与压强不变,故平衡不发生移动,各组分浓度、转化率等物理量均无变化,但在加压下使体积由2V恢复原状V时,则依据勒夏特列原理较易分析。 (1)当a=(b+d)时,平衡不移动,A平衡转化率不变。 (2)当a>(b+d)时,平衡正向移动,A平衡转化率变大。 (3)当a<(b+d)时,平衡逆向移动,A平衡转化率变小。 假若运用浓度商与平衡常数大小关系来判断时,则需列三段式来计算(第1次平衡转化率为x,第2次平衡转化率为y)。 第1次通入mmol A时,达到平衡时 起始量(mol)m0 0 第2次通入mmol A时,重新达到平衡时 起始量(mol) 2m0 0 由上可知,分析平衡移动方向及平衡转化率大小关系等问题时,勒夏特列原理更简洁快速。 勒夏特列原理尽管源自于经验总结,但现在已经通过数理逻辑推理可得,因而在教学中应淡化其是经验总结的教学意识,毕竟经验不是科学,是没有经过严密的逻辑推理证明的,可能存在意外情况。因在教学中,从平衡常数与浓度商之间的关系角度给予其定量分析与证明,以突出勒夏特列原理的科学性、逻辑性。 勒夏特列原理只能用来判断平衡移动的方向、没有判断平衡移动结果的功能,所以把人教版教材描述“如果改变影响平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向减弱这种改变的方向移动”中“减弱”修改为“抵制”或“阻碍”,只不过是“抵制”或“阻碍”的结果大多数为减弱、个别为抵消(反应式只有一侧为气体的可逆反应符合)而已。1.5 对勒夏特列原理的用途误解

2 勒夏特列原理重要性的体现
2.1 勒夏特列原理具有普适性
2.2 勒夏特列原理具有简洁性







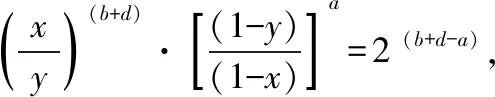
3 教学建议
3.1 突出勒夏特列原理的科学性
3.2 修改当前勒夏特列原理内容的文字描述
3.3 突出勒夏特列原理使用的条件

