高温胁迫对月季生理特性和叶绿素荧光参数的影响
2019-04-23张方静谭殷殷张旻桓金晓玲
张方静,罗 峰,谭殷殷,张旻桓,邢 文,金晓玲,2
(1.中南林业科技大学,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南 长沙 410004)
月季(RosachinensisJacq)为蔷薇科蔷薇属植物,半常绿低矮灌木,四季开花,故又称长春花、斗雪红、四季花等,是我国传统十大名花之一,在园林和花卉市场上占有非常重要的地位。月季生长最适温度为15~26 ℃,30 ℃以上的高温会导致月季花芽停止分化,无法正常开花,同时还会导致白粉病、黑斑病等病害产生,严重影响其观赏价值。因此,了解月季耐热性机制成为研究重点。目前,关于月季耐热性研究主要集中在生理方面,游离脯氨酸(Pro)含量、可溶性糖(SS)含量、超氧化物歧化酶(SOD)活性、叶绿素(Chl)含量、丙二醛(MDA)含量、相对电导率(Rec)、可溶性蛋白(SP)含量均与月季耐热性有关[1-2]。近年来,众多研究表明,叶绿素荧光分析技术能够反映高温对植物的伤害,是筛选植物耐高温品种的重要技术手段,被广泛应用于植物耐热性研究[3-5]。关于叶绿素荧光在月季抗逆性研究中的应用,主要体现在利用叶绿素荧光来评价月季的耐弱光性,以及土壤水分胁迫下月季的光合特性等[6-7]。月月红和月月粉是最初被引种至欧洲参与品种培育的中国种源之一,大部分鲜切花都是由这2种月季作为父母本杂交而来[8],对于月季的育种有着重要的意义。关于这2种月季对高温的生理响应和叶绿素荧光特性尚未见报道。鉴于此,以月月红和月月粉为试材,研究高温胁迫对2种月季生理指标和叶绿素荧光特性的影响,并结合主成分分析及隶属函数综合评价其耐热性,为研究月季耐热性机制提供理论基础。
1 材料和方法
1.1 试验材料
材料为月月红和月月粉的2年生扦插苗。
1.2 试验方法
试验于2018年3月在中南林业科技大学园林植物实验室中进行。选取生长健壮、长势一致的月月红、月月粉盆栽苗,培养基质配方为V(泥炭土)∶V(椰糠)∶V(蛭石)=3∶1∶1,高温处理前把植株放入人工气候箱(25 ℃)中培养7 d,随后进行高温处理,温度分别为25、30、35、40、45、50 ℃,连续高温诱导8 h,利用电导率仪测定2种月季在不同处理温度下的电导率,根据Logistic方程,计算半致死温度(LT50)。
根据LT50设置胁迫温度为45 ℃,胁迫时间为0、2、6、12、24 h,以0 h为对照。处理过程中空气相对湿度为80%,光照强度为5 000 lx。处理时间过后,立即取高温处理不同时间段的叶片,测量Rec、Chl含量、叶绿素荧光参数,剩余叶片用液氮速冻后放入超低温冰箱(-80 ℃)保存,以备测定其余生理指标。每棵植株上选取3片叶进行测量。
1.3 测定指标与方法
Rec采用电导仪测定法,Chl含量采用丙酮、乙醇混合液提取法,MDA含量采用硫代巴比妥酸(TBA)法,SS含量采用蒽酮比色法,SP含量采用考马斯亮蓝染色法,Pro含量采用茚三酮显色法,SOD活性采用NBT法[9]。
采用LI-6400型便携式光合仪(Li-Cor,Lincoln,美国)测定叶绿素荧光参数[10]:光化学猝灭系数(qP)和非光化学猝灭系数(qN)、最大荧光产量(Fm)、光合电子传递速率(ETR)、有效光化学量子产量(Fv′/Fm′)、固定荧光(Fo)。所有指标测定均重复3次。
1.4 数据处理及分析
(1)运用隶属函数法计算2种月季的隶属函数值,通过隶属函数值来评价2种月季的耐热性[11]。公式如下:若耐热指标与耐热性正相关,其公式为:
U(xi)=(xi-ximin)/(ximax-ximin),i=1,2,3,…,n
若耐热指标与耐热性负相关,其公式为:
U(xi) = 1-(xi-ximin) /(ximax-ximin)
式中,U为隶属函数值;xi为某项指标测定值;ximin、ximax为所有参试材料中该项指标的最小值和最大值。
(2)耐热性主成分分析权重系数计算方法[12]如下:
Wi=pi/∑pi,i=1,2,3,…,n
其中,i表示各指标,pi为各种指标在第i各主成分的贡献率,Fij表示该指标在第j主成分上的负荷量,Yij表示第j主成分的贡献率,Wi表示第i各主成分在所有主成分中的重要程度。
(3)耐热性综合指数计算方法[11]如下:
D=∑[U(xi)×Wi],i=1,2,3,…,n
其中,D代表供试材料耐热性综合指数,D越大表示其耐热性越强,反之则越弱。
采用Excel软件处理数据,采用SPSS 20.0软件进行显著性分析、主成分分析,采用Origin 9.0进行制图。
2 结果与分析
2.1 高温胁迫对2种月季生理指标的影响
2.1.1 2种月季LT50的确定 根据相对电导率拟合的Logistic方程可得出2种月季的LT50(表1)。由表1可知,月月红和月月粉的拟合度(R2)分别为0.94、0.79,均达到了显著水平(P<0.05)。月月红、月月粉的LT50分别为49.33、50.04 ℃。

表1 不同高温处理下月月红和月月粉的LT50
注:*、**表示显著、极显著。
Note:*,** indicate significant,extremely significant difference.
2.1.2 细胞膜透性 由图1A可知,2种月季的Rec随高温胁迫时间延长均逐渐升高。2种月季不同胁迫时间的Rec均差异显著(P<0.05)。高温胁迫2 h,月月红与CK无显著差异,月月粉与CK差异显著;高温胁迫6~12 h,2种月季均与CK差异显著,月月红Rec显著上升,月月粉无显著变化;高温胁迫12~24 h,月月红和月月粉的Rec均显著上升。
由图1B可知,2种月季的MDA含量随高温胁迫时间延长均呈先上升后下降的趋势。2种月季不同胁迫时间的MDA含量均差异显著(P<0.05)。高温胁迫2~12 h,2种月季MDA含量均显著高于CK;高温胁迫24 h,月月红与CK无显著差异,月月粉与CK差异显著。
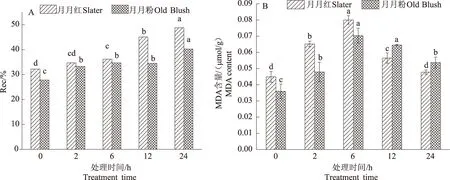
不同小写字母表示在0.05水平差异显著,下同
2.1.3 渗透调节物质 如图2A所示,2种月季的SP含量随高温胁迫时间延长均呈现先上升后下降再上升的趋势。2种月季不同胁迫时间的SP含量均差异显著(P<0.05)。高温胁迫2 h,2种月季的SP含量均与CK无显著差异;高温胁迫6 h,2种月季SP含量均与CK差异显著,且达到最大值;高温胁迫12 h,2种月季SP含量均下降;高温胁迫24 h,月月红与CK无差异显著,而月月粉与CK差异显著。
如图2B所示,随高温胁迫时间延长,月月红Pro含量呈现先升高后下降的趋势,月月粉则呈现先上升后下降再上升的趋势。2种月季不同胁迫时间的Pro含量均差异显著(P<0.05)。高温胁迫2~6 h,月月红Pro含量均与CK差异显著,月月粉均与CK差异不显著,且月月红Pro含量显著上升;高温胁迫12 h,2种月季的Pro含量均与CK差异显著;高温胁迫24 h,月月红与CK差异不显著,月月粉与CK差异显著。
由图2C可知,2种月季SS含量随高温胁迫时间延长均呈现先上升后下降的趋势。2种月季不同胁迫时间的SS含量均差异显著(P<0.05)。高温胁迫2 h,2种月季的SS含量与CK相比均无显著差异;高温胁迫6 h,2种月季SS含量均与CK差异显著,且月月红SS含量达到峰值;高温胁迫12 h,月月红SS含量与CK无显著差异,而月月粉SS含量与CK差异显著且达到峰值;高温胁迫24 h,月月红与CK无显著差异,而月月粉与CK差异显著。
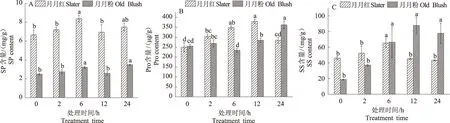
图2 高温胁迫下月月红和月月粉SP、Pro、SS含量的变化Fig.2 The change of soluble protein, proline and soluble sugar content of Slater and Old Blush under high temperature stress
2.1.4 SOD活性 如图3所示,2种月季SOD活性随高温胁迫时间延长均呈先上升后下降的趋势。2种月季不同胁迫时间的SOD活性均差异显著(P<0.05)。高温胁迫2 h,月月红与CK无显著差异,而月月粉则差异显著;高温胁迫6 h,2种月季均与CK差异显著,且月月红的SOD活性达到峰值;高温胁迫12 h,2种月季均与CK差异显著,且月月粉的SOD活性达到峰值;高温胁迫24 h,2种月季SOD活性均与CK差异显著。

图3 高温胁迫下月月红和月月粉SOD活性的变化Fig.3 The change of SOD activity of Slater and Old Blush under high temperature stress
2.1.5 Chl含量和叶绿素荧光参数 如图4A所示,随着高温胁迫时间延长,月月红的Chl含量呈现先下降后上升的趋势,月月粉的Chl含量呈下降趋势。2种月季不同胁迫时间的Chl含量均差异显著(P<0.05)。高温胁迫2 h,2种月季的Chl含量均与CK无显著差异;高温胁迫6~12 h,2种月季均与CK差异显著;高温胁迫24 h,月月红与CK无显著差异,而月月粉则差异显著。
如图4B—4G所示,随着高温胁迫时间延长,2种月季的Fm、qP、ETR、Fv′/Fm′均呈现下降的趋势,qN、Fo呈现缓慢上升趋势。2种月季不同胁迫时间的叶绿素荧光参数均具有显著差异(P<0.05)。高温胁迫2 h,除月月红Fo外,2种月季其余各指标均与CK差异显著;高温胁迫6 h,2种月季的所有叶绿素荧光参数均与CK差异显著,其中,Fm、qP、ETR、Fv′/Fm′显著低于CK,而qN、Fo显著高于CK;高温胁迫12~24 h,月月红Fm、qP、ETR、Fv′/Fm′均显著下降,而月月粉除Fm、Fv′/Fm′显著下降外,qP、ETR无显著变化,月月红的qN与Fo均显著上升,月月粉则表现为Fo显著上升,而qN无显著变化。
2.2 2种月季耐热指标的筛选
对月月红和月月粉13项指标进行主成分分析,通过各指标的贡献率可得知各指标的重要性。由表2可知,月月红、月月粉3个主成分的累计贡献率分别达到了93.579%、95.841%。月月红第1主成分贡献率为56.410%,包括Rec、qP、qN、Fm、ETR、Fv′/Fm′、Fo等7项指标,反映了高温胁迫对细胞膜透性和光合作用的影响,月月粉第1主成分贡献率为74.114%,包括Chl含量、SS含量、Rec、Pro含量、MDA含量、qP、qN、Fm、ETR、Fv′/Fm′、Fo等指标,主要反映高温对膜透性、渗透调节物质和光合作用的影响;月月红第2主成分贡献率为25.992%,包括SS含量、SP含量、SOD活性、MDA含量等4项指标,主要说明了高温胁迫对膜透性、渗透调节物质和保护酶活性的影响,月月粉第2主成分贡献率为13.906%,指标为SOD活性,反映了高温胁迫对保护酶的影响;月月红第3主成分贡献率为11.178%,包括Pro含量、Chl含量,主要反映了叶绿素情况,月月粉第3主成分贡献率为7.821%,主要指标为SP含量,反映了高温对渗透调节物质的影响。

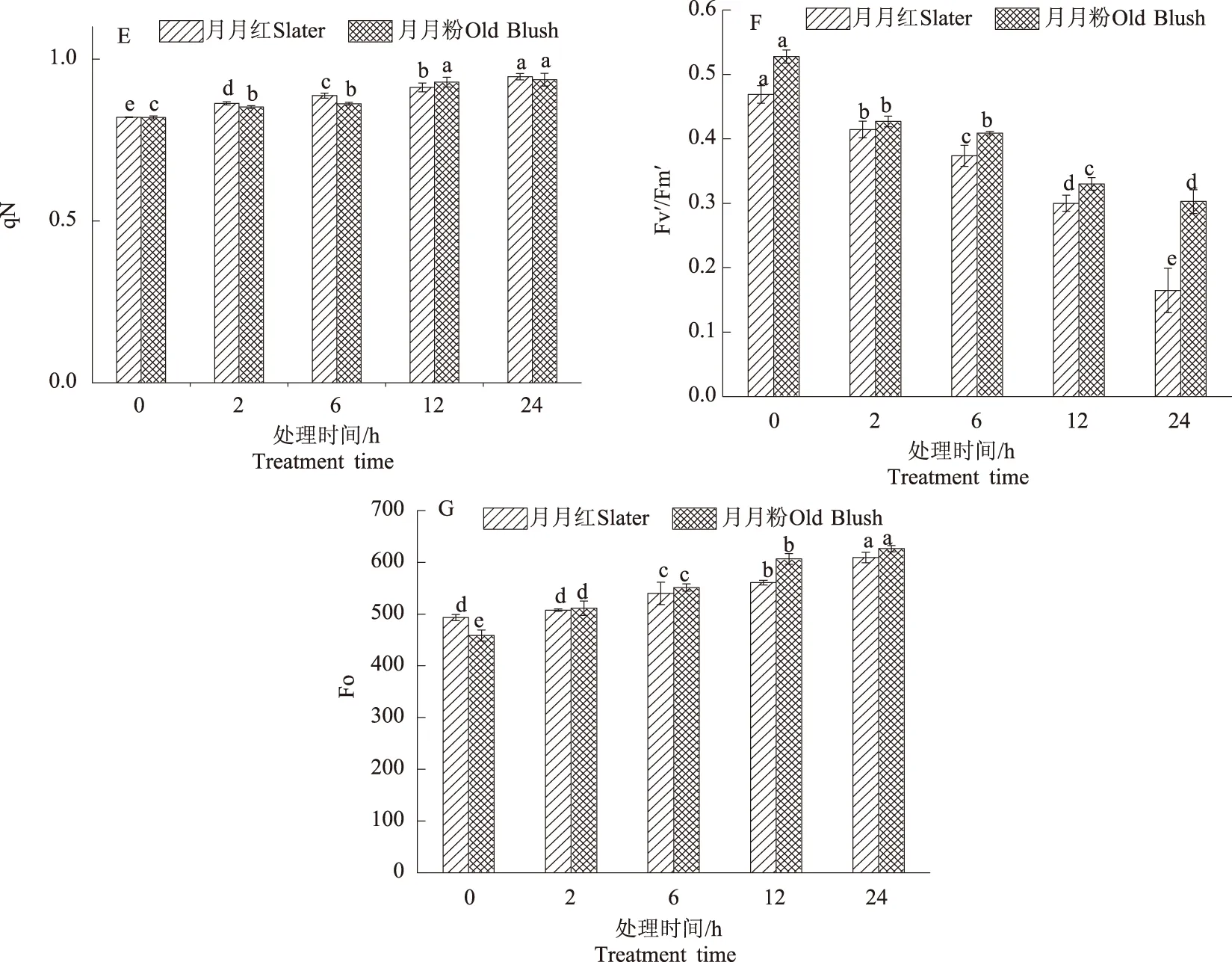
图4 高温胁迫下月月红和月月粉Chl含量、Fm、qP、ETR、qN、Fv′/Fm′、Fo的变化Fig.4 The change of Chl content,Fm,qP,ETR,qN,Fv′/Fm′,Fo of Slater and Old Blush under high temperature stress
综上所述,月月红生理指标Rec、SS含量、SOD活性、MDA含量和荧光参数qP、qN、Fm、ETR、Fv′/Fm′、Fo载荷量较大,可作为月月红耐热性的鉴定指标;月月粉生理指标Chl含量、SS含量、Rec、SOD活性和荧光参数qP、qN、Fm、ETR、Fv′/Fm′、Fo载荷量较大,可作为月月粉耐热性的鉴定指标。
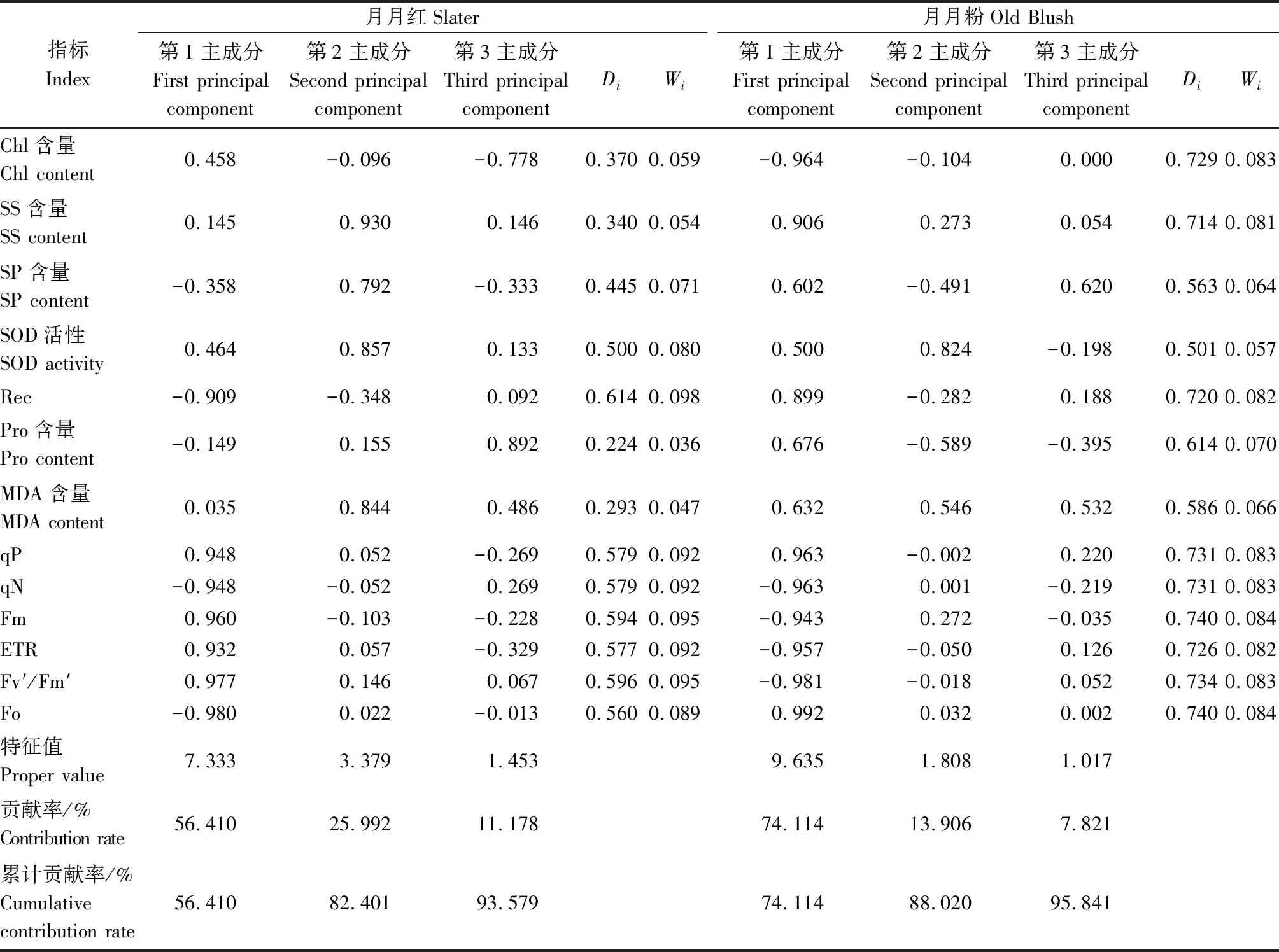
表2 月月红和月月粉耐热指标主成分分析
2.3 2种月季耐热性综合评价
通过对2种月季的Chl含量、SS含量、SP含量、SOD活性等13项指标的耐热性隶属函数值进行计算,并根据主成分分析结果对各指标进行合成,获得2种月季的耐热性综合指数(D)(表3)。月月红的综合指数为0.520,月月粉的综合指数为0.496,说明月月红的耐热性稍强于月月粉。
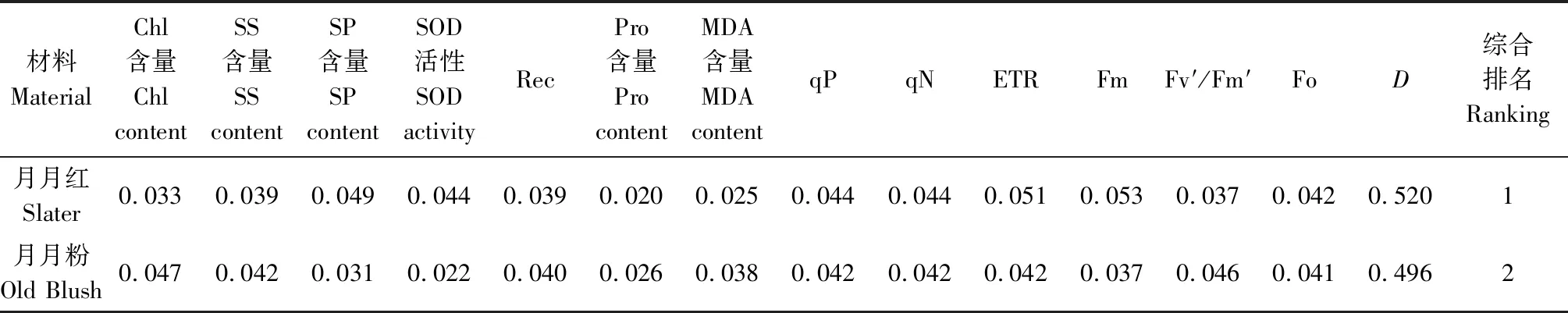
表3 月月红和月月粉耐热指标隶属函数值Tab.3 Heat resistance index membership function value of Slater and Old Blush
3 结论与讨论
众多研究表明,高温胁迫下,植物的生理代谢及光合作用会发生不同程度的变化,主要表现为叶绿素降解,细胞膜透性增大,活性氧含量增加,启动抗氧化酶和非酶抗氧化物质发生应答性变化[13],以及光合作用过程中光能的吸收和转化、能量转运和PSⅡ的活性等,在植物光合作用与环境关系的研究中起着重要作用[14]。前人研究认为,本试验中所有生理指标均能作为月季耐热性鉴定指标,而本试验通过对13个指标进行主成分筛选,认为生理指标Rec、SOD活性、SS含量、MDA含量、Chl含量和荧光参数qP、qN、Fm、ETR、Fv′/Fm′、Fo与月季的耐热性密切相关。
高温会导致膜内脂的变化,使其细胞膜透性增大,细胞内电解质会有不同程度的外渗,伤害越大,外渗越大,电导率增加越大[15]。在高温胁迫下随着胁迫时间增加,2种月季Rec均显著增大,与杨华庚等[16]研究蝴蝶兰的结果一致。MDA是膜脂过氧化产物之一,随着膜伤害的发生,使其体内可溶性物质大量渗漏[17]。本研究表明,随着高温胁迫时间的延长,2种月季MDA含量呈先升后降趋势,在处理6 h均达到峰值,随后下降,可能是由于胁迫强度太大导致不能正常合成MDA,月月红胁迫24 h与CK无显著差异,而月月粉差异显著,说明高温对月月粉伤害更显著。
SP和Pro都是重要的渗透调节物质,植物遭受高温会主动积累SP、Pro,以此来抵御高温带来的伤害[18-19]。本试验中,2种月季SP、Pro含量随着胁迫时间延长均有不同程度的增加,说明Pro、SP在月季抗高温机制中有较大作用。且月月红SP含量明显高于月月粉,说明月月红抵御高温能力强于月月粉。2种月季SS含量呈先上升后下降的趋势,月月红在胁迫6 h达到峰值,随后下降,月月粉在12 h达到峰值后下降,这与叶小梅等[20]研究的高温胁迫下月季SS含量变化趋势一致,胁迫前期通过积累SS抵御高温,胁迫后期可能是由于高温下植物呼吸作用大于光合作用,消耗体内SS,从而造成SS含量下降。但在胁迫24 h后,月月红与CK无显著差异,月月粉差异显著,说明高温对月月粉伤害更大。
有研究表明,SOD活性与植物耐热性息息相关,并随高温胁迫时间延长呈先上升后下降的趋势[21-22],这与本试验中所显示趋势一致,出现这种趋势的原因可能是胁迫前期,植物自身能够提高SOD活性来抵御高温伤害,后期胁迫时间过长而超过植物本身的承受能力,使得酶活性下降[15]。本试验中,月月红处理6 h达到峰值,且SOD活性明显高于月月粉,说明此期间月月红抵御高温能力更强,而月月粉则在处理12 h后达到峰值,说明月月红对高温响应主要在胁迫前期,月月粉在后期。
PSⅡ对逆境胁迫非常敏感,高温会导致其结构和功能发生变化[23]。研究表明,qP、qN、ETR、Fm、Fv′/Fm′、Fo均与植物耐热性有关[24-25]。本试验中,45 ℃的高温能够诱导2种月季的Fo、qN上升,钟敏等[14]认为,Fo上升可能是高温使PSⅡ反应中心产生破坏,从而导致电子传递受阻,qN上升说明高温使叶片光能热耗散增加,有利于耗散过剩光能,从而适应高温。高温下2种月季的Fm、qP、ETR、Fv′/Fm′均随胁迫时间延长呈下降趋势,且均在处理24 h达到最低值,表明高温使PSⅡ反应中心光化学转换效率下降。就2种月季而言,月月红胁迫2 h后Fm、qP、ETR、Fv′/Fm′下降幅度最大,而月月粉在胁迫6~12 h下降波动最大,说明胁迫前期月月红对高温的响应明显,而月月粉响应高温主要在后期,前人研究中也有类似结果[26]。此外,Chl含量与植物光合效率密切相关,植物叶片的受损情况能够反映高温对植物的伤害程度。高温会导致月季Chl含量下降[26]。本试验中,月月红Chl含量呈先下降后上升的趋势,月月粉Chl含量呈下降趋势,后期上升可能是由于胁迫时间短,没有达到抑制光合作用的程度,叶绿素不稳定[27]。胁迫至24 h,月月红Chl含量与CK差异不显著,而月月粉差异显著,说明高温对月月粉伤害更明显。
本研究从生理特性及叶绿素荧光方面初步探讨了2种月季的耐热机制和应激反应,筛选出与月季耐热性相关的指标,并进行耐热性评价。高温对植物的影响是多方面的,可以利用生理特性和叶绿素荧光来分析植物受逆境伤害程度。后期可考虑从热激蛋白或热激转录因子等方面深入分析其耐热机制。
